扩展功能
文章信息
- 何敏超
- HE Min-Chao
- 4种常用阿尔茨海默病评测量表与提高后的服药依从性相关研究
- A study on the relationship between four neuropsychological scales and medication adherence in patients with Alzheimer's disease
- 国际神经病学神经外科学杂志, 2021, 48(1): 40-45
- Journal of International Neurology and Neurosurgery, 2021, 48(1): 40-45
-
文章历史
收稿日期: 2020-09-04
修回日期: 2021-01-06
阿尔茨海默病(Alzheimer's disease,AD)是慢性神经退行性疾病[1],目前有数种成熟、广泛使用的神经心理评测量表对其评测,包括阿尔茨海默病评定量表认知部分(Alzheimer's Disease Assessment Scale-Cognitive Subscale, ADAS-Cog)、日常生活能力量表(Activity of Daily Living Scale, ADL)、神经精神症状问卷(Neuropsychiatric Inventory, NPI)、基于临床医师对病情变化印象及照料者访谈量表(The Clinician Interview-Based Impression of Change, plus carer interview, CIBIC-Plus)等,分别评测患者的认知功能、日常生活功能、精神行为异常及总体功能,已广泛应用于各种临床药物试验(甘露寡糖二酸、多奈哌齐、苯磷硫胺、丁苯酞等)[2]。良好的服药依从性是AD治疗的基础,AD患者的依从性普遍不高,约为50%左右[3]。既往我们甄别出部分影响AD患者服药依从性的消极主观因素,涉及患者、照料者、医护人员,消除了这些因素后,患者的服药依从性提高,并且服药规律有所改变[3]。AD患者具有高龄、认知功能下降、服药需依靠照料者等特点[4],目前尚无专门的AD患者服药依从性评测工具。本文拟研究上述4种量表是否会与提高后的AD患者服药依从性相关,从而可使用现存量表预测AD患者服药依从性。
1 对象与方法 1.1 研究对象采用前瞻性研究设计,选取2014年6月—2017年12月本院门诊及住院诊断为阿尔茨海默症的患者(共31例)入选实验。入组后进行10个月的随访,第1、2、3、4、5、7及10个月末进行量表评测及依从性记录。第2次随访后有2人因病情变化退出试验,有1人在最后1次随访时脱落。
入选标准:根据2011年NINCDS-ADRDA标准诊断为很可能AD,受试者有稳定及充分交流的照料者,并签署知情同意书。根据简易智力状态检查量表(Mini-mental State Examination, MMSE)分数及总体衰退量表(global deteriorate scale, GDS)确定痴呆程度为轻、中度的患者(主要标准为MMSE分数:初中及以上文化程度11~26分,小学文化程度11~22分;同时参考GDS量表评定为轻度-中度)。
排除标准:重度、极重度痴呆;非AD性痴呆;生命体征不稳定及不能配合研究者;小学文化水平以下患者。
1.2 提高服药依从性的措施及计算方法试验开始前主要研究者对参与研究的医师、患者及照料者均进行药物服药依从重要性教育;每次访视医师均对患者及照料者进行访视,鼓励患者及家属提高依从性;临床药师为每名患者独立建档,放服药记录卡,每次发药前记录发药数量,计算服用后的剩余药物并发放下一阶段药物,记录服药依从性;照料者监督患者服药,服药完毕再勾画记录卡,把漏服或忘服等依从性不佳情况均记录下来。
经广州市第一人民医院医学伦理委员会批准[(2014)穗一院伦审字第034号],使用无药理作用的胶囊作为实验药物。因服药次数(每日2次)及每次服药粒数(3粒)较多,故服药依从性的测量采用药片计数法直接测量,服药依从率的具体计算方式是:(发放药物数量-剩余药物数量)/(处方的每日药物数量×两次访视间的天数)×100%。
对于服药过量的处理(即服药依从率超过100%),既往研究有几种方案,一种是对数据舍弃不用,还有一种将依从率超过105%的数据将按70%计算,服药依从率在100%~105%间均记为100%[5]。但这可能会导致依从性异常偏高,故本研究以依从性100%为起点,超过部分视为依从性不佳,将超出部分从100%中减除(如实际测量依从性为150%,则本研究将其转换为:100-(150-100)%=50%)。
1.3 量表的实施及数据收集同一位神经科主治医师为所有患者进行筛选量表(MMSE及GDS)以及实施除了CIBIC-Plus量表外所有的实验量表(ADAS-cog、ADL、NPI);另有一位神经科主治医师独立完成CIBIC-Plus量表的评估。研究者收集患者姓名、年龄、性别、文化程度,照料者与患者的关系,入组前疾病持续时间,入组时MMSE分数及GDS级别,每次访视的服药依从率,ADAS-cog、ADL、NPI、CIBIC分数。其中NPI量表分为患者精神行为异常总分(频率×严重程度)及照料者心理压力两部分。
1.4 统计学方法采用SPSS 23.0软件进行统计;采用OriginPro 8.0 SR2进行制图。各量表分数及服药依从性均符合方差齐性,但均不符合正态分布。根据临床经验(人口基数、年龄发病率及国人就诊习惯),患者认知功能、日常行为功能、整体功能分布应遵循正态分布,服药依从率及精神行为异常遵循偏态分布。CIBIC-plus分5级,有序等级变量可视为区间连续变量[6],故服药依从率与CIBIC-plus相关检验采用两样本相关分析的Kendall检验,该检验对等级资料检验效能更优[6],与其余量表分数相关性分析采用两样本相关分析的Spearman检验。因为非正态分布资料不能做偏相关分析,故对量表分数及服药依从率进行秩和转换,ADL分数及服药依从率做升序排列,其余量表做降序排列(因量表分数越高则功能恶化越严重),转换后纳入与服药依从性有关的人口学因素[3]作为偏相关控制变量进行偏相关分析。对ADAS-cog 12个条目的分数与服药依从率进行Spearman相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 随访期间服药依从性分析入组患者中,男性占41.5%。平均年龄(74.25±7.132)岁。小学、初中、高中、大学及以上文化程度分别为38.1%、17.0%、34.7%及10.2%。照料者中,40.1%为配偶,42.9%为子女。平均病程(2.05±1.243)年。入组时MMSE平均分为(18.68±4.65)分。GDS轻度及中度认知功能减退分别占55.1%及37.4%。入组患者总体平均服药依从率为91.75%(中位数96.67%±14.18%);服药依从性大于80%者占87.0%,大于90%者占76%。随访期间服药依从性及各量表变化见图 1及图 2。
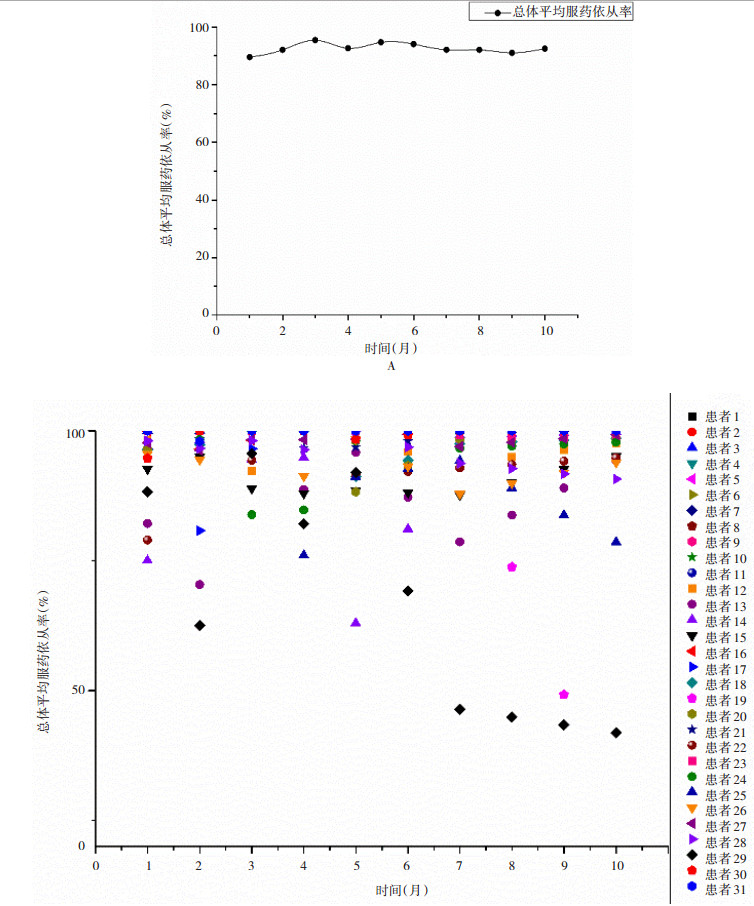
|
| A:所有入组患者总体平均服药依从率;B:入组患者的各月服药依从率 图 1 阿尔茨海默病患者服药依从性的变化 |
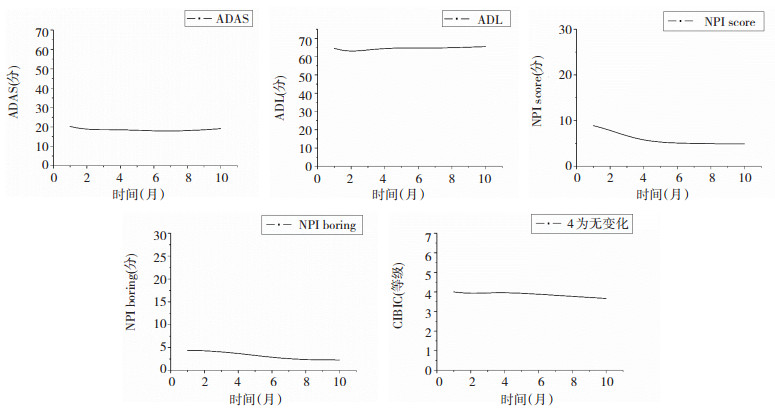
|
| NPI量表分为患者精神行为异常总分(频率×严重程度,图示为NPI score)及照料者心理压力(图示为NPI boring)两部分。CIBIC的分级设定:①明显改善;②中等改善;③轻度改善;④无变化;⑤轻度恶化;⑥中等恶化;⑦明显恶化 图 2 阿尔茨海默病患者4种神经心理评测量表的变化 |
对4种神经心理评测量表与AD患者服药依从率做非参数相关检验,均未发现相关性(表 1)。我们之前研究中可见患者部分相关客观因素(性别及病程)与服药依从率具有或接近有相关性[3],故将其作为控制因素纳入行秩和变换后的偏相关分析,结果亦未见相关性。见表 1。
| 量表 | 相关系数 | P值 | 偏相关系数 | P值 |
| ADAS-cog | 0.121 | 0.147 | -0.097 | 0.303 |
| ADL | -0.090 | 0.281 | -0.112 | 0.237 |
| NPI-患者 | 0.047 | 0.570 | -0.046 | 0.626 |
| NPI-照料者 | 0.138 | 0.096 | -0.119 | 0.206 |
| CIBIC-plus | -0.015 | 0.839 | 0.025 | 0.794 |
| 注:相关系数为Spearman Rho系数/Kendall tau_b系数。ADAS-cog:阿尔茨海默病评定量表—认知部分,ADAS-cog分数越高则患者认知功能损害越严重,因此负相关表明认知功能下降与对应量表分数升高相关。ADL:日常生活活动能力量表。NPI-患者:神经精神症状问卷—患者严重程度。NPI-照料者:神经精神症状问卷—照料者心理压力。CIBIC-Plus:临床医师通过面谈对变化的影响。 | ||||
阿尔茨海默病评定量表-认知部分的命令和结构性2个条目分数与服药依从性具有相关性(P < 0.05,相关系数分别为0.201及0.177)。见表 2。
| ADAS-cog | 相关系数 | P值 |
| 单词记忆 | 0.019 | 0.822 |
| 物体命名 | 0.042 | 0.612 |
| 命令 | 0.201 | 0.015 |
| 结构性练习 | 0.177 | 0.033 |
| 意向性练习 | 0.105 | 0.206 |
| 定向力 | 0.060 | 0.472 |
| 单词辨认任务 | 0.131 | 0.114 |
| 回忆测试 | 0.013 | 0.873 |
| 口头语言能力 | -0.088 | 0.289 |
| 找词困难 | -0.066 | 0.431 |
| 口头语言理解能力 | 0.005 | 0.948 |
| 注意力 | 0.017 | 0.843 |
多项观察研究表明,非干预下AD患者服药依从性仅有50%左右[7]。影响服药依从性的因素包括主客观因素。本研究根据既往研究[3],针对主观因素采取改进措施,结果除1例外,其余患者的服药依从性均提高至90%以上。临床上采用CIBIC、MMSE、GDS等量表对ADA患者进行总体评估[8-9];采用特定神经心理学量表评测各认知领域功能,如ADAS-Cog[10-11]、ADL[8-9,12]、NPI[8]、CIBIC-Plus[3]等,分别评测认知功能、社会和日常功能以及精神行为症状、总体认知功能[8-9]。这些量表已被广泛应用于科研与临床药物临床试验(如丁苯酞,课题编号2018ZX09711001-003-021;苯磷硫胺片加载盐酸多奈哌齐片,临床批件号2016L00324;甘露寡糖二酸,临床批件号2006L02492、2011L00942)。ADAS-cog评测认知功能很精确,但未能对患者日常生活能力、社会交往及精神行为功能进行评价,评价患者社会和日常生活能力需依靠ADL[13],而其部分项目涉及服药功能。NPI主要评测AD患者精神行为症状及照料者心理压力。既往文献认为认知功能快速降低、行为异常的增加[14]、照料者压力太大[15]均能明显降低AD患者的服药依从率[14],故利用现有量表预测AD服药依从性存在可能,但本实验结果否定了这个可能。
整体功能未见相关性,是否意味着量表中所有的条目与依从性均无相关性?ADAS-cog分别评测患者记忆力、语言、实践能力、注意力4个方面[11,16]。结果显示命令和结构性练习两个条目分数(代表实践能力)与服药依从性有弱相关关系,而与记忆力、定向力、注意力或语言能力无关。这与既往文献认为痴呆患者依从性下降与注意力、记忆力下降有关[17]有所不同,但既往研究与本研究最重要的差异在于是否有照料者帮助服药。AD患者的服药能力明显依靠照料者[17],独自进行服药管理的患者,服药依从性下降[18]。
本研究的设计消除了患者自行服药这个因素,依赖照料者负责服药管理。加强照料者以及医师、药师的作用(主要也是通过影响照料者)以后,患者自身的记忆力、注意力与服药行为失去了关联,而与执行能力、实践能力或者视空间能力相关,表明在改善AD患者服药依从性上,其关键干预点为照料者。
AD患者与认知功能正常患者的服药依从性模式不同,有其独有的困难[17],上述AD评测量表对服药依从性不适用,那我们是否还有其他选择?除经典的Morisky量表外[19],还有多种量表用于评价服药依从性[20],如服药测试(MedTake test)、服药管理能力评定(medication management ability assessment)等。但这些均非为AD患者定制的量表,对痴呆患者的效力不佳[17],且对照料者在依从性管理上的作用重视不够[21]。
关于服药过量的处理,既往定性研究[5]认为,超过105%的服药率可设定为70%,这是基于正常人偶然也可能存在失误的考虑。但本文作者认为这将导致依从性的异常增高,因为过量服药的程度也会有不同,100%与95%或105%是有差异的,但95%与105%无差别。本文第一次采用了以100%为基点,将超过100%的部分从100%扣除的方法去处理服药过量问题。
该研究主要的局限在于排除了诊断为重度及极重度AD患者,因有研究认为这类患者继续服药获益不高,主动停用乙酰胆碱酯酶抑制剂类药物反而可减少药物不良反应及药物费用[22]。尚有部分与有关痴呆严重程度分级和鉴别诊断的相关量表未纳入研究,如临床痴呆量表等,但其所评测的功能类似ADAS-cog及CIBIC-Plus,笔者认为其相关性类似已纳入的量表,故未行检测。本研究结果提示,未来需建立一个AD患者专用服药依从性量表。
| [1] |
尹文文, 余先锋, 孙中武. 阿尔茨海默病和轻度认知障碍患者脑网络变化特点的研究进展[J]. 国际神经病学神经外科学杂志, 2019, 46(4): 461-465. |
| [2] |
彭丹涛, 许贤豪, 侯青云, 等. 安理申治疗轻中度阿尔茨海默病有效性及安全性的临床研究[J]. 中华神经科杂志, 2002, 35(1): 19-21. DOI:10.3760/j.issn:1006-7876.2002.01.007 |
| [3] |
何敏超. 提高服药依从性后Alzheimer' s病患者服药依从性的相关因素变化[J]. 临床神经病学杂志, 2019, 32(1): 65-68. |
| [4] |
Kremenchugsky S, Wick JY. Medication safety, adherence, and deprescribing in patients with dementia[J]. Sr Care Pharm, 2019, 34(6): 351-362. DOI:10.4140/TCP.n.2019.351 |
| [5] |
Baisley K, Baeten JM, Hughes JP, et al. Summary measures of adherence using pill counts in two HIV prevention trials: the need for standardisation in reporting[J]. AIDS Behav, 2013, 17(9): 3108-3119. DOI:10.1007/s10461-013-0542-9 |
| [6] |
王旭. SPSS数据处理与分析. 北京: 人民邮电出版社, 2016.
|
| [7] |
Borah B, Sacco P, Zarotsky V. Predictors of adherence among Alzheimer's disease patients receiving oral therapy[J]. Curr Med Res Opin, 2010, 26(8): 1957-1965. DOI:10.1185/03007995.2010.493788 |
| [8] |
贾建平, 王荫华, 张振馨, 等. 中国痴呆与认知障碍诊治指南(三): 神经心理评估的量表选择[J]. 中华医学杂志, 2011, 91(11): 735-741. DOI:10.3760/cma.j.issn.0376-2491.2011.11.007 |
| [9] |
肖世富. 神经心理测验和评定量表在阿尔茨海默病的应用及价值[J]. 中国现代神经疾病杂志, 2005, 5(3): 137-140. DOI:10.3969/j.issn.1672-6731.2005.03.001 |
| [10] |
Kueper JK, Speechley M, Montero-Odasso M. The Alzheimer's disease assessment scale-cognitive subscale (ADAS-cog): modifications and responsiveness in pre-dementia populations. a narrative review[J]. J Alzheimers Dis, 2018, 63(2): 423-444. DOI:10.3233/JAD-170991 |
| [11] |
黄娴娴, 何敏超. 阿尔茨海默病评定量表在我国的研究进展[J]. 医学综述, 2017, 23(16): 3202-3206. DOI:10.3969/j.issn.1006-2084.2017.16.018 |
| [12] |
de Paula JJ, Albuquerque MR, Lage GM, et al. Impairment of fine motor dexterity in mild cognitive impairment and Alzheimer's disease dementia: association with activities of daily living[J]. Braz J Psychiatry, 2016, 38(3): 235-238. DOI:10.1590/1516-4446-2015-1874 |
| [13] |
简文佳, 时晶, 倪敬年, 等. 日常生活能力量表鉴别痴呆与轻度认知损害[J]. 中国老年学杂志, 2014, 34(4): 865-868. DOI:10.3969/j.issn.1005-9202.2014.04.001 |
| [14] |
Gardette V, Lapeyre-Mestre M, Piau A, et al. A 2-year prospective cohort study of antidementia drug non-persistency in mildto-moderate Alzheimer's disease in Europe: predictors of discontinuation and switch in the ICTUS study[J]. CNS Drugs, 2014, 28(2): 157-170. |
| [15] |
Dhikav V, Singh P, Anand KS. Medication adherence survey of drugs useful in prevention of dementia of Alzheimer's type among Indian patients[J]. Int Psychogeriatr, 2013, 25(9): 1409-1413. DOI:10.1017/S1041610213000744 |
| [16] |
王华丽, 舒良, 司天梅, 等. 阿尔茨海默病评定量表中文译本的效度和信度[J]. 中国临床心理学杂志, 2000, 8(2): 89-93. |
| [17] |
El-Saifi N, Moyle W, Jones C, et al. Medication adherence in older patients with dementia: a systematic literature review[J]. J Pharm Pract, 2018, 31(3): 322-334. DOI:10.1177/0897190017710524 |
| [18] |
Cooper C, Carpenter I, Katona C, et al. The AdHOC study of older adults' adherence to medication in 11 countries[J]. Am J Geriatr Psychiatry, 2005, 13(12): 1067-1076. |
| [19] |
Morisky DE, Green LW, Levine DM. Concurrent and predictive validity of a self-reported measure of medication adherence[J]. Med Care, 1986, 24(1): 67-74. |
| [20] |
Arlt S, Lindner R, Rösler A, et al. Adherence to medication in patients with dementia: predictors and strategies for improvement[J]. Drugs Aging, 2008, 25(12): 1033-1047. |
| [21] |
Hudani ZK, Rojas-Fernandez CH. A scoping review on medication adherence in older patients with cognitive impairment or dementia[J]. Res Social Adm Pharm, 2016, 12(6): 815-829. |
| [22] |
Peyro Saint-Paul L, Martin J, Gaillard C, et al. [Sudden discontinuation of anti-dementia drugs in moderate and severe Alzheimer's disease in a residency for dependent elderly people: a longitudinal descriptive pilot study][J]. Therapie, 2015, 70(4): 313-319. |
 2021, Vol. 48
2021, Vol. 48




