扩展功能
文章信息
- 罗小彬, 钟亚丽, 徐尚沂, 陈礼刚, 杨福兵
- LUO Xiao-Bin, ZHONG Ya-Li, XU Shang-Yi, CHEN Li-Gang, YANG Fu-Bing
- 肿瘤治疗电场联合替莫唑胺化疗与单独使用替莫唑胺化疗对胶质母细胞瘤临床疗效比较的Meta分析
- Meta-analysis of the clinical efficacy of tumor treating fields combined with temozolomide chemotherapy and temozolomide chemotherapy alone for glioblastoma
- 国际神经病学神经外科学杂志, 2020, 47(6): 595-601
- Journal of International Neurology and Neurosurgery, 2020, 47(6): 595-601
-
文章历史
收稿日期: 2020-05-20
修回日期: 2020-11-16
2. 贵州中医药大学研究生院, 贵州 贵阳 550000
2. Graduate School of Guizhou University of Traditional Chinese Medicine, Guiyang 550000, Guizhou, China
胶质母细胞瘤(Glioblastoma,GBM)是一种恶性程度极高的原发性脑部肿瘤,其具有病死率高、预后差的特点[1]。目前GBM的主要治疗方式包括手术、放疗、化疗、免疫治疗、分子靶向治疗等[2],但患者预后仍不理想。目前替莫唑胺(Temozolomide,TMZ)是GBM患者最常使用的化疗药,有研究表明大约有55%的患者缺乏O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)而导致患者出现替莫唑胺耐药[3-4]。正是由于耐药性的发生,更加迫切需要一种有效治疗GBM的疗法。最近的研究发现,肿瘤治疗电场(tumor treating fields,TTF)能有效作用于肿瘤细胞,并抑制肿瘤细胞的增殖。TTF是一种非侵入式的由换能器提供的低强度、中频(200 kHz)交变电场,其可以选择性干扰细胞分裂[5-6]。在2011年,TTF获得美国食品药品管理局(food and drug administration,FDA)批准,用于治疗复发性GBM[7]。随后在2015年被批准作为新诊断GBM的辅助疗法[8]。有研究发现TTF和TMZ具有协同抗肿瘤的作用[9],因此,为了比较TTF+TMZ与单纯使用TMZ这两种方式治疗GBM患者的临床疗效和安全性,我们进行了此次分析。
1 对象与方法 1.1 检索策略由2名研究人员按照PRISMA(Preferred Reporting Items for Systematic Reviews and Meta-Analyses)的标准[10],独立检索Pubmed、Cochrance、Embase、Ovid、Scopus、Web of science、中国知网、万方数据知识服务平台、维普中文期刊数据库、中国生物医学文献服务系统数据库、谷歌学术,自建库到2020年4月5日的文献,当对检索到的文献具有争议时由第三名研究者决定是否纳入。检索词为:“Glioblastoma”、“Grade IV Astrocytoma”、“Glioma, Grade IV”、“Tumor Treating Fields”、“Temozolomide”、“GB”、“GBM”、“TTF”、“TMZ”、“胶质母细胞瘤”、“IV级星形细胞瘤”、“IV级胶质瘤”、“肿瘤治疗电场”、“电场治疗”、“替莫唑胺”。采用主题词加自由词的形式进行检索。
1.2 文献纳入和排除标准纳入标准:①胶质母细胞瘤的诊断符合“世界卫生组织2016年脑胶质瘤分类”中GBM的诊断标准[11];②所有纳入文献的研究类型都应基于随机对照实验(randomized controlled trials,RCT);③干预措施为肿瘤治疗电场联合替莫唑胺与单纯使用替莫唑胺化疗的疗效对比;④文献中详细叙述了入组的患者样本量、结局指标、并发症、出组患者样本量。
排除标准:①排除研究内容与本研究内容不一致、非中英文、重复的文献;②排除研究类型为:综述、系统评价、Meta分析、个案、会议、指南、动物研究等文献;③排除单纯TTF与多种化疗药物比较的文献。
1.3 资料提取和文献质量评价对纳入文献提取其第一作者、年份、实验分组、实验样本数、性别、年龄、Karnofsky功能状态评分、总体生存率(overall survival,OS)和无进展生存期(progression free survival,PFS)、风险比(HR,95%CI)、MGMT启动子区域甲基化状态、表皮生长因子受体(epidermal growth factor receptor,EGFR)、异柠檬酸盐脱氢酶1基因(isocitrate dehydrogenase 1 gene, IDH1)突变的表达产物IDH1R132H、不良反应。研究人员采用Cochrane风险偏倚评估工具[12]对纳入文献进行随机分配方法、分配方案隐蔽、盲法、结果数据的完整性、选择性报告研究结果、其他偏倚来源等6个指标的质量评价。总分6分,≤3分为高度偏倚风险,3~5分为中度偏倚风险,≥5分为轻度偏倚风险。
1.4 统计学方法使用Review Manager(https://training.cochrane.org/online-learning/core-software-cochrane-reviews/revman/revman-5-download/download-and-installation,版本:5.3)进行Meta分析,对不含风险比但含生存曲线的文献,使用Engauge Digitizer(http://markummitchell.github.io/engauge-digitizer/,版本:12.0)提取生存分析数据,然后使用Tierney在2007年发表的Excel程序间接计算HR及95%CI[13-15]。对所得结果进行异质性检验,P>0.1且异质性(I2)<50%使用固定效应模型,反之则使用随机效应模型进行Meta分析,结果以森林图和漏斗图展示。
1.5 两者比较的疗效评价两者疗效比较的主要标准是OS和PFS,次要疗效评价标准为MGMT、EGFR、IDH1-R132H状态、血液系统紊乱、胃肠功能紊乱、神经系统紊乱等不良反应。
2 结果 2.1 文献检索结果通过对上述数据库进行初筛得到247篇文献,再通过谷歌学术获得58篇文献,共305篇;剔除重复文献186篇,排除非中英文、综述、系统评价、专家评论、信函、动物实验等文献39篇,再排除研究内容不吻合、干预措施与结局指标不一致、无实验数据的文献78篇,通过阅读参考文献添加2篇文献,最终纳入4篇文献,筛选流程如图 1所示。
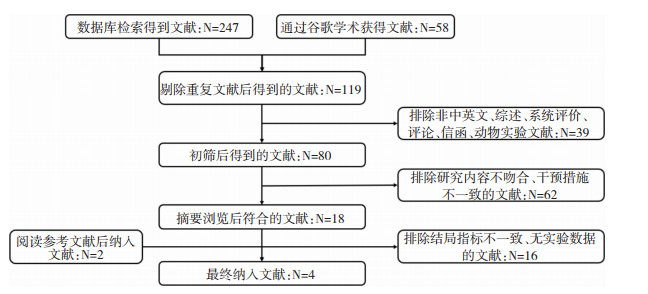
|
| 图 1 文献筛选流程图 |
通过对文献的梳理,得到纳入文献的一般特征,见表 1;结局指标纳入情况,见表 2。纳入的文献采用Review Manager软件提供的Cochrane风险偏倚评估工具进行质量评价,总分6分,3篇文献为4分,1篇3分,达到标准为“+”,未达到标准为“-”,不清楚为“?”。风险偏倚如图 2所示。
| 编号 | 作者 | 年份 | 试验方法 | 试验分组 | 总样本 | 性别(男/女) | 年龄(岁)平均中位年龄 | ofsky per平均值 | 干预措施 | 患者GBM的情况 | 主要结局指标 | |
| OS(95%CI) | PFS(95%CI) | |||||||||||
| 1 | Eilon D Kirson | 2009 | RCT | TTFields+TMZ | 10 | - | - | - | - | 新诊断GBM | 39.0 | 38.8 |
| 同期TMZ | 32 | - | - | - | - | 新诊断GBM | 3.7 | 7.8 | ||||
| 2 | Roger Stupp | 2015 | RCT | TTFields+TMZ | 210 | 140/70 | 57 | 90 | TTF>18 h/d,TMZ 150~200 mg/(m2·d) | 胶质母细胞瘤(幕上) | 20.5(16.7~25.0) | 7.1(5.9~8.2) |
| TMZ | 105 | 67/38 | 58 | 90 | 150~200 mg/(m2·d) | 胶质母细胞瘤(幕上) | 15.6(13.3~19.1) | 4.0(3.3~5.2) | ||||
| 3 | Roger Stupp | 2017 | RCT | TTFields+TMZ | 466 | 316/150 | 56 | 90 | TTF>18 h/d,TMZ 150~200 mg/(m2·d) | 胶质母细胞瘤(幕上) | 20.9(19.3~22.7) | 6.7(6.1~8.1) |
| TMZ | 229 | 157/72 | 57 | 90 | 150~200 mg/(m2·d) | 胶质母细胞瘤(幕上) | 16.0(14.0~18.4) | 4.0(3.8~4.4) | ||||
| 4 | Chae Yong Kim | 2020 | RCT | TTFields+TMZ | 24 | 15/9 | 53 | 90 | TTF>18 h/d,TMZ 120~150 mg/(m2·d) | 胶质母细胞瘤(幕上) | 27.2(21~NA) | 6.2(4.2~12.2) |
| TMZ | 15 | 11/4 | 57 | 90 | 120~150 mg/(m2·d) | 胶质母细胞瘤(幕上) | 15.2(7.5~24.1) | 4.2(1.9~11.2) | ||||
| ID | 作者 | 年份 | OS HR | PFS HR |
| 1 | Eilon Kirson | 2009 | 0.78(0.15~4.10) | 3.32(1.9~5.9) |
| 2 | Roger Stupp | 2015 | 0.74(0.56~0.98) | 0.58(0.45~0.76) |
| 3 | Roger Stupp | 2017 | 0.63(0.53~0.76) | 0.63(0.52~0.76) |
| 4 | Chae-Yong Kim | 2020 | 0.25(0.06~1.00) | NR |

|
| 图 2 筛选文献偏倚风险情况 |
4篇RCT文献报告了患者的OS[9, 16-18],对纳入研究进行异质性检验,P=0.43,I2=0%,采用固定效应模型分析,结果表明TTF+TMZ组的OS优于单纯应用TMZ组(HR:0.65,95%CI: 0.56~0.76,P=0.000),差异有统计学意义。见图 3。
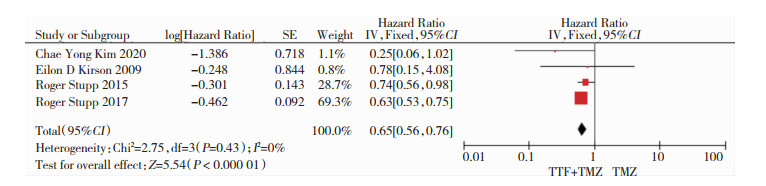
|
| 图 3 OS的比较结果 |
3篇研究报告了患者的PFS[9, 16-17],进行异质性检验,P < 0.01,I2=94%,异质性高,分析其可能是由于样本量太小而导致,去除该篇文献后,异质性降低,故去除该篇文献后采用固定效应模型分析,结果表明TTF+TMZ组的PFS优于单纯应用TMZ组(HR:0.61,95%CI: 0.52~0.71,P=0.000),其差异有统计学意义。见图 4。
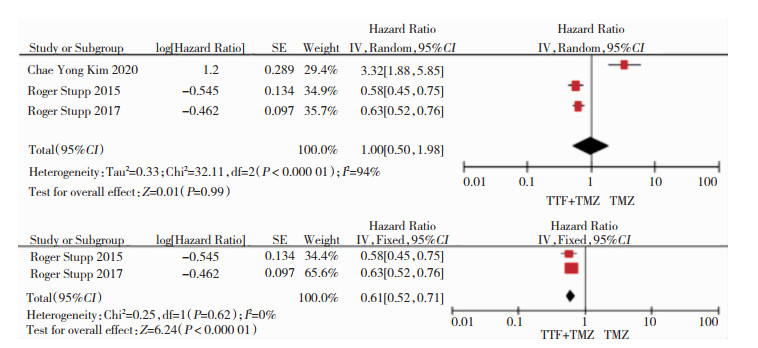
|
| 图 4 PFS的比较结果 |
MGMT启动子区域甲基化状态[16-18](OR:0.86,95%CI: 0.65~1.13, P=0.913),IDH1-R132H[17-18](OR:1.54,95%CI:0.64~3.68, P=0.873),EGFR[17-18](OR:1.24,95%CI:0.85-1.82, P=0.680),不良反应中血液系统紊乱[16-18](OR:1.32,95%CI:0.86~2.01, P=0.846),胃肠功能紊乱[16-18](OR:1.24,95%CI:0.68-2.26, P=0.105),神经系统紊乱[16-18](OR:1.05,95%CI:0.70-1.57, P=0.257),两组对比差异无统计学意义(P<0.05)。
2.4 敏感性分析和发表偏倚采用去除每一条研究的方法比较其HR/OR值,在PFS中出现了一个异质性极强的文献,去除后其值波动不明显,可以认为其所纳入文献的稳定性良好,对Meta分析的结果无明显影响。使用Review Manager软件所提供的漏斗图对所纳入文献进行发表偏倚评价,其文献所形成的点均在漏斗以内,提示结果不存在发表偏倚。见图 5。
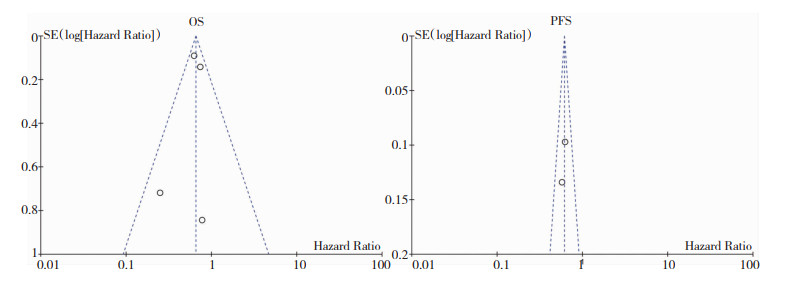
|
| 图 5 所纳入文献的OS和PFS的发表偏倚评价 |
GBM是中枢神经系统的一种恶性肿瘤,其在2018年的发病率约为3.2/100 000[19],诊断和治疗后的中位生存期约为15个月[20],5年生存率约为5%[21]。由于GBM患者预后差、生存质量低,针对其目前已研究出多种治疗手段,最终结果都不如人意,但TTF的出现,为治疗来带希望。
TTF是一种治疗癌症的新方法,已在胰腺癌[22]、骨肉瘤[23]、胸膜间皮瘤[24]中取得良好的疗效。它是由换能器、导线、电池3部分构成。它通过在特定的部位安置换能器,产生中频低强度的交流电场,阻断肿瘤细胞的有丝分裂过程, 达到杀伤肿瘤的目的[25]。有趣的是,静止的细胞却不受影响[26]。它的作用原理是通过抑制微管蛋白聚合,使细胞器发生电泳,然后干扰肿瘤细胞胞内结构,最终抑制肿瘤细胞的迁移[27]。由于设备便携、疗效可靠,不良反应轻微等特点,其已被多个国家批准用于癌症的治疗。国内于2020年上半年获批上市,适应证为年龄22岁以上经组织病理学或影像学诊断的复发性幕上胶质母细胞瘤及新诊断的幕上胶质母细胞瘤患者[28]。国内临床试验中发现,研究中期结果显示新发GBM患者的中位PFS为6.4个月,复发GBM患者的中位PFS为4.5个月,新发GBM的PFS大于复发的PFS,这和笔者的研究结果是一致的,但由于研究时间太短,故疗效性和安全性有待检验[29]。
KIRSON等[9]研究发现TTF和TMZ具有协同抗肿瘤的作用,以及TTF和TMZ两者具有可联合的可行性。在此基础上,STUPP等[16-17]发起一个Ⅲ期临床试验(https://clinicaltrials.gov/,NCT00916409,EF-14试验),用于比较两者的安全性和有效性。中期分析结果表明,两者的PFS有差异(TTF+TMZ组为7.1个月,单纯TMZ组为4.0个月,P < 0.01);最后的结果显示,TTF+TMZ组的OS较单纯使用TMZ组具有差异(TTF+TMZ组为20.9个月,单纯TMZ组为16.0个月,P < 0.01)。研究还发现TTF+TMZ组和单纯使用TMZ组的全身毒副作用没有差别。但TTF+TMZ组的局部皮肤毒性(换能器与头皮接触的部位)的发生率较高,约43%的患者出现轻至中度皮肤刺激,2%的患者出现严重皮肤反应(3级不良反应事件),研究结果与KIRSON和KIM等相似[9, 18]。
虽然其在GBM的治疗形势中持续向好,但目前仍有些许问题。有研究人员指出临床试验具有以下问题:①没有使用“安慰剂设备”[30];②作用机制尚不明确[30];③综合治疗价格昂贵[8];④随机试验中的盲法应用不足。针对以上问题,在2015年ASCO的EF-14试验的讨论下,对于愿意接受治疗且没有禁忌证的GBM患者,应考虑将TTF视为一种治疗选择[31]。CONNOCK等[32]通过建模发现TTF仍是不具备成本的方法。本文的局限性:①纳入文献的数量不多,部分文献指标未予以报道,导致相关统计指标不准确,可能出现偏倚,需要在后续的研究中继续完善;②纳入文献限于中英文文献,可能导致偏倚。
总之,TTF在GBM上的治疗具有良好的前景,目前,已经有多项关于TTF的研究[8],如与贝伐单抗联合治疗复发性GBM(NCT02663271,NCT02743078,NCT01894061)、与突变衍生的肿瘤疫苗联合治疗化疗后新诊断的GBM(NCT03223103)、与蛋白酶体抑制剂联合治疗新诊断的GBM(NCT02903069)。Meta分析的结果表明, TTF+TMZ组与单纯使用TMZ组比较,前者的OS和PFS长于后者,其有效性和安全性优于后者。本研究的结果可以为我国的GBM患者带来福音,可改善患者预后,提高患者的生存质量。
| [1] |
Wirsching HG, Galanis E, Weller M. Glioblastoma[J]. Handb Clin Neurol, 2016, 134: 381-397. |
| [2] |
Alifieris C, Trafalis DT. Glioblastoma multiforme:pathogenesis and treatment[J]. Pharmacol Ther, 2015, 152: 63-82. |
| [3] |
Hegi ME, Diserens AC, Gorlia T, et al. MGMT gene silencing and benefit from temozolomide in glioblastoma[J]. N Engl J Med, 2005, 352(10): 997-1003. DOI:10.1056/NEJMoa043331 |
| [4] |
Karachi A, Dastmalchi F, Mitchell DA, et al. Temozolomide for immunomodulation in the treatment of glioblastoma[J]. Neuro Oncol, 2018, 20(12): 1566-1572. DOI:10.1093/neuonc/noy072 |
| [5] |
Kirson ED, Dbaly V, Tovarys F, et al. Alternating electric fields arrest cell proliferation in animal tumor models and human brain tumors[J]. Proc Natl Acad Sci U S A, 2007, 104(24): 10152-10157. DOI:10.1073/pnas.0702916104 |
| [6] |
Fonkem E, Wong ET. NovoTTF-100A:a new treatment modality for recurrent glioblastoma[J]. Expert Rev Neurother, 2012, 12(8): 895-899. DOI:10.1586/ern.12.80 |
| [7] |
European Society for Medical Oncology. FDA approves expanded indication for medical device to treat glioblastoma multiforme[EB/OL]. (2015-10-14)[2020-04-29]. https://www.esmo.org/oncology-news/FDA-Approves-Expanded-Indication-for-Medical-Device-to-Treat-Glioblastoma-Multiforme.
|
| [8] |
Fabian D, Guillermo Prieto Eibl MDP, Alnahhas I, et al. Treatment of glioblastoma (GBM) with the addition of tumor-treating fields (TTF):a review[J]. Cancers (Basel), 2019, 11(2): 174. DOI:10.3390/cancers11020174 |
| [9] |
Kirson ED, Schneiderman RS, Dbaly V, et al. Chemotherapeutic treatment efficacy and sensitivity are increased by adjuvant alternating electric fields (TTFields)[J]. BMC Med Phys, 2009, 9: 1. |
| [10] |
Shamseer L, Moher D, Clarke M, et al. Preferred reporting items for systematic review and meta-analysis protocols (PRISMA-P) 2015:elaboration and explanation[J]. BMJ, 2015, 350: g7647. |
| [11] |
Wesseling P, Capper D. WHO 2016 classification of gliomas[J]. Neuropathol Appl Neurobiol, 2018, 44(2): 139-150. DOI:10.1111/nan.12432 |
| [12] |
汪洋. Cochrane偏倚风险评估工具简介[J]. 中国全科医学, 2019, 22(11): 1322. |
| [13] |
Mitchell M, Muftakhidinov B, Winchen T, et al. Engauge digitizer[EB/OL]. (2020-12-04)[2020-04-25]. http://markummitchell.github.io/engauge-digitizer.
|
| [14] |
Tierney JF, Stewart LA, Ghersi D, et al. Practical methods for incorporating summary time-to-event data into meta-analysis[J]. Trials, 2007, 8: 16. DOI:10.1186/1745-6215-8-16 |
| [15] |
周支瑞, 张天嵩, 李博, 等. 生存曲线中Meta分析适宜数据的提取与转换[J]. 中国循证心血管医学杂志, 2014, 6(3): 243-247. DOI:10.3969/j.1674-4055.2014.03.02 |
| [16] |
Stupp R, Taillibert S, Kanner AA, et al. Maintenance therapy with tumor-treating fields plus temozolomide vs temozolomide alone for glioblastoma:a randomized clinical trial[J]. JAMA, 2015, 314(23): 2535-2543. DOI:10.1001/jama.2015.16669 |
| [17] |
Stupp R, Taillibert S, Kanner A, et al. Effect of tumor-treating fields plus maintenance temozolomide vs maintenance temozolomide alone on survival in patients with glioblastoma:a randomized clinical trial[J]. JAMA, 2017, 318(23): 2306-2316. DOI:10.1001/jama.2017.18718 |
| [18] |
Kim CY, Paek SH, Nam DH, et al. Tumor treating fields plus temozolomide for newly diagnosed glioblastoma:a sub-group analysis of Korean patients in the EF-14 phase 3 trial[J]. J Neurooncol, 2020, 146(3): 399-406. DOI:10.1007/s11060-019-03361-2 |
| [19] |
Ostrom QT, Gittleman H, Truitt G, et al. CBTRUS statistical report:primary brain and other central nervous system tumors diagnosed in the United States in 2011-2015[J]. Neuro Oncol, 2018, 20(suppl_4): iv1-iv86. DOI:10.1093/neuonc/noy131 |
| [20] |
Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study:5-year analysis of the EORTC-NCIC trial[J]. Lancet Oncol, 2009, 10(5): 459-466. DOI:10.1016/S1470-2045(09)70025-7 |
| [21] |
Thakkar JP, Dolecek TA, Horbinski C, et al. Epidemiologic and molecular prognostic review of glioblastoma[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(10): 1985-1996. DOI:10.1158/1055-9965.EPI-14-0275 |
| [22] |
Jo Y, Oh G, Gi Y, et al. Tumor treating fields (TTF) treatment enhances radiation-induced apoptosis in pancreatic cancer cells[J]. Int J Radiat Biol, 2020, 96(12): 1528-1533. DOI:10.1080/09553002.2020.1838658 |
| [23] |
Oh JY, Lee YJ, Kim EH. Tumor-treating fields inhibit the metastatic potential of osteosarcoma cells[J]. Technol Cancer Res Treat, 2020, 19: 1533033820947481. |
| [24] |
Wang YF, Pandey M, Ballo MT. Integration of tumor-treating fields into the multidisciplinary management of patients with solid malignancies[J]. Oncologist, 2019, 24(12): e1426-e1436. |
| [25] |
Kirson ED, Dbaly V, Tovarys F, et al. Alternating electric fields arrest cell proliferation in animal tumor models and human brain tumors[J]. Proc Natl Acad Sci U S A, 2007, 104(24): 10152-10157. DOI:10.1073/pnas.0702916104 |
| [26] |
Giladi M, Schneiderman RS, Voloshin T, et al. Mitotic spindle disruption by alternating electric fields leads to improper chromosome segregation and mitotic catastrophe in cancer cells[J]. Sci Rep, 2015, 5: 18046. |
| [27] |
蔡泽豪, 康勋, 李晓燕, 等. 肿瘤治疗电场在脑胶质母细胞瘤治疗中的现状与前景[J]. 中国肿瘤临床, 2019, 46(24): 1247-1250. DOI:10.3969/j.issn.1000-8179.2019.24.725 |
| [28] |
国家药品监督管理局. 肿瘤电场治疗仪产品获批上市[J]. 微创医学, 2020, 15(3): 326. |
| [29] |
中国新闻网. 首项肿瘤电场治疗中国人群真实世界数据公布[J]. 肿瘤防治研究, 2020, 47(10): 810. |
| [30] |
Wick W. TTFields:where does all the skepticism come from?[J]. Neuro Oncol, 2016, 18(3): 303-305. DOI:10.1093/neuonc/now012 |
| [31] |
Mehta M, Wen P, Nishikawa R, et al. Critical review of the addition of tumor treating fields (TTFields) to the existing standard of care for newly diagnosed glioblastoma patients[J]. Crit Rev Oncol Hematol, 2017, 111: 60-65. DOI:10.1016/j.critrevonc.2017.01.005 |
| [32] |
Connock M, Auguste P, Dussart C, et al. Cost-effectiveness of tumor-treating fields added to maintenance temozolomide in patients with glioblastoma:an updated evaluation using a partitioned survival model[J]. J Neurooncol, 2019, 143(3): 605-611. DOI:10.1007/s11060-019-03197-w |
 2020, Vol. 47
2020, Vol. 47




