扩展功能
文章信息
- 庞淼, 肜小聪, 蔡春娥
- PANG Miao, RONG Xiao-Cong, CAI Chun-E
- 白头翁皂苷D对胶质瘤细胞转移和凋亡的影响及机制研究
- Pulsatilla Saponin D regulates the invasion, migration and apoptosis of glioma cells U251MG by targeting c-MET
- 国际神经病学神经外科学杂志, 2020, 47(6): 587-594
- Journal of International Neurology and Neurosurgery, 2020, 47(6): 587-594
-
文章历史
收稿日期: 2020-08-13
修回日期: 2020-11-18
胶质瘤是成人中枢神经系统最常见的原发性肿瘤,胶质瘤的高迁移和侵袭性导致复发率高,也意味着预后较差,其中胶质母细胞瘤占整个脑胶质瘤比例的60%以上[1]。胶质瘤治疗方式包括手术切除,放射疗法和化学疗法,虽然胶质瘤的诊断和适当的全身治疗取得了进展,但患有胶质母细胞瘤的患者中位生存期仅为9~12个月,并且不到3%的患者存活超过5年[2]。因此,揭示胶质母细胞瘤的发病机制,寻找新的有效治疗靶点已成为当前研究的热点。白头翁皂苷D(Pulsatilla saponin D, PSD)是从毛茛科植物白头翁Pulsatilla chinensis (Bunge) Regel的干燥根提取分离的皂苷类单体化合物,对多类肿瘤具有很强的抗肿瘤作用[3]。已有研究表明,PSD可抑制胶质瘤细胞系U87MG、U251MG细胞增殖,在G0/G1期阻滞细胞周期,通过肿瘤坏死因子受体途径和线粒体途径介导细胞凋亡,诱导细胞自噬[4]。说明PSD对胶质瘤的治疗作用。本文旨在研究PSD是否通过靶向间质表皮转化因子(cellular mesenchymal-epithelial transition factor,c-MET)对胶质母细胞瘤细胞U251MG转移和凋亡的影响。
1 材料和方法 1.1 主要药物和主要试剂PSD(HY-N0834)购自美国MedChemexpress LLC公司,分子式:C47H76O17,相对分子量:913.096,纯度≥98%;Roswell Park Memorial Institute 1640(RPMI 1640)培养基(61870-127)、胎牛血清(26400-036)、青-链霉素(15140-122)、胰蛋白酶(25200-056)购自美国Gibco公司,Transwell(L-B1126)购自美国Corning公司,BCA蛋白浓度测定试剂盒(P0012S)、Hoechst 33258染色液(C1017)、CCK-8试剂盒(C0037)购自上海碧云天生物技术研究所;Anti基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)(ab37150)、尿激酶型纤溶酶原激活物(urokiase type plasminogen activator,uPA)(ab131433)、纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,PAI-1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、cleaved caspase-3(ab2302)、cleaved caspase-9(ab2324)、C-MET(ab10728)、β-actin(ab8227)、PHA-665752 c-MET inhibitor (ab219583)均购自英国Abcam公司。
1.2 细胞处理、活力检测及分组正常星形胶质细胞和胶质瘤细胞U251MG来源于美国典型培养物保藏中心,将细胞培养于RPMI 1640培养基(含10%胎牛血清、1×105 u/L青霉素和1×105 u/L链霉素)中,置于5%二氧化碳CO2、37℃的恒温培养箱中培养。培养基每2 d更换1次,每3 d传代1次,实验用细胞为对数生长期细胞。
将正常星形胶质细胞和胶质瘤细胞U251MG用不同剂量PSD(0.0、2.5、5.0、7.5、10.0、15.0及20.0 μmol/L)处理,连续培养细胞4 d,每天检测待测细胞数,绘制增殖曲线。用培养基将CCK-8溶液稀释到10%,再用CCK-8溶液将待测细胞制成1×106个/mL的细胞悬液,37℃培养4 h,450 nm处检测吸光度(A)值,计算细胞活力。
通过计算PSD对U251MG细胞的IC50值,选用无显著毒性的0.0、1.0、2.0及5.0 μmol/L PSD处理U251MG细胞,将细胞分为四组:PSD 0.0 μmol/L组、PSD 1.0 μmol/L组、PSD 2.0 μmol/L组和PSD 5.0 μmol/L组。
1.3 划痕实验检测细胞迁移情况使用Marker笔在细胞培养板背面画一条水平线,画线后将U251MG置于细胞培养板中培养,待细胞铺满时,利用枪头垂直于所画水平线进行划痕。划痕后用PBS冲洗细胞培养板,再加入无血清的培养液继续培养细胞。分别于0和24 h取样并拍照,划痕闭合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.4 Transwell检测细胞侵袭情况取300 μL无血清培养基,4℃下加入60 μL Matrigel混匀,平均加入小室,置于37℃培养箱中孵育5 h,将100 μL细胞用无血清培养基清洗3次,配成细胞悬液加入Transwell小室,下室中加入600 μL含有20%磷酸盐缓冲液(FBS)的培养基,置于37℃培养箱中孵育24 h,取出Transwell用PBS洗2遍,5%戊二醛固定,0.1%结晶紫染色0.5 h后于荧光显微镜下观测。
1.5 Hoechst 33258染色检测细胞凋亡根据Hoechst试剂盒说明书步骤操作,将各组细胞接种于48孔板中,每组3个复孔,相应处理后,吸弃上清液,向每孔中加入200μL浓度为5 μg/mL的Hoechst染液,染色5 min,用PBS清洗,在荧光显微镜下进行检测。每个样本随机观察10~20个视野进行计数。凋亡率=凋亡细胞数/细胞总数×100%。
1.6 逆转录-聚合酶链反应(RT-PCR)检测c-MET mRNA水平用Trizol法从胶质瘤细胞U251MG中提取总RNA,用Nanodrop分光光度计测定A(A260/A280)值,按照试剂盒说明书步骤进行cDNA的合成和PCR的扩增,反应条件:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,扩增35个循环,72℃延长10 min。采用2-ΔΔCt法进行定量计算。
1.7 Western blotting检测MMP-2、uPA、PAI-1、VEGF、cleaved caspase-3、cleaved caspase-9和c-MET蛋白表达水平收集各组细胞用BCA试剂盒提取总蛋白并测定蛋白质含量。提取等量蛋白质样品,100℃变性5 min。然后使用SDS-PAGE凝胶电泳法分离并转移至PVDF膜,4℃条件下加入相应一抗并孵育过夜,清洗,然后在4℃下加入辣根过氧化物酶标记的二抗孵育2 h,最后加入发光液,曝光处理。Image J软件统计灰度值。
1.8 PHA-665752对胶质瘤细胞U251MG的影响加入c-MET抑制剂PHA-665752,将细胞随机分为4组:Control组、PSD 5.0 μmol/L组、PHA-665752 5.0 μmol/L组和PHA-665752+PSD 5.0 μmol/L组。检测加入抑制剂后各组细胞迁移、侵袭和凋亡及相关蛋白的表达水平。
1.9 统计学方法采用SPSS 17.0软件对实验数据进行分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果 2.1 PSD对正常星形胶质细胞和胶质瘤细胞U251MG细胞活力的影响不同剂量PSD作用于正常星形胶质细胞和胶质瘤细胞U251MG 4 d后细胞活力的抑制作用不同,经Shapiro-Wilk正态性检验均符合正态分布,差异有统计学意义(F=265.134、72.343,均P=0.000)。与0.0 μmol/L剂量(100.14±3.26)%PSD相比较,10.0、15.0及20.0 μmol/L剂量(76.47±3.53、68.48±2.32、60.16±2.35)%PSD正常星形胶质细胞活力下降,差异有统计学意义(P<0.01)。与0.0 μmol/L剂量(100.22±3.32)%PSD相比较,5.0、7.5、10.0、15.0、20.0 μmol/L剂量(81.25±3.26、63.08±4.69、49.64±3.17、30.07±2.33、26.03±2.27)%PSD U251MG细胞活力下降,差异有统计学意义(P<0.05)。见图 1。

|
| A:胶质瘤细胞U251MG细胞活力;B:正常星形胶质细胞细胞活力。*与0 μmol/L剂量比较,P<0.05 图 1 细胞活力(x±s,n=3) |
各组细胞迁移率及侵袭细胞数经Shapiro-Wilk正态性检验均符合正态分布,差异有统计学意义(F=289.370、31.201,均P=0.000)。与PSD 0.0 μmol/L组(83.93±3.75)%相比较,PSD 1.0、2.0及5.0 μmol/L组(64.45±3.64、48.52±2.43、23.91±2.14)%细胞迁移率均下降,差异有统计学意义(P<0.05)。与PSD 0.0 μmol/L组(234.48±30.13)相比较,PSD 1.0、2.0及5.0 μmol/L组(196.88±23.31、147.47±18.19、76.32±6.07)侵袭细胞数均降低,差异有统计学意义(P<0.05);各组细胞MMP-2、uPA、PAI-1、VEGF蛋白表达水平经Shapiro-Wilk正态性检验均符合正态分布,差异有统计学意义(F=113.111、205.869、116.191、152.970,均P=0.000)。与PSD 0.0 μmol/L组相比较,PSD 1.0、2.0及5.0 μmol/L组MMP-2、uPA、PAI-1、VEGF蛋白表达水平均降低,差异有统计学意义(P<0.05)。见图 2。

|
| A:细胞划痕实验检测细胞迁移(×200);B:Transwell检测细胞侵袭;C:MMP-2、uPA、PAI-1、VEGF蛋白表达;D:MMP-2、uPA、PAI-1、VEGF蛋白表达水平直方图。1:PSD 0.0 μmol/L组;2:PSD 1.0 μmol/L组;3:PSD 2.0 μmol/L组;4:PSD 5.0 μmol/L组。*与PSD 0.0 μmol/L组比较,P<0.05 图 2 PSD对U251MG细胞迁移和侵袭的影响(x±s,n=3) |
凋亡细胞的细胞核呈亮蓝色,以亮蓝色斑点密度表示细胞凋亡程度。各组细胞细胞凋亡率经Shapiro-Wilk正态性检验均符合正态分布,差异有统计学意义(F=21.181,P=0.000)。与PSD0.0 μmol/L组(12.35±2.03)%比较,PSD 1.0、2.0及5.0 μmol/L组(18.25±2.22、23.36±3.08、30.18±4.13)%细胞凋亡率升高,差异有统计学意义(P<0.05);各组细胞cleaved caspase-3、cleaved caspase-9蛋白表达水平经Shapiro-Wilk正态性检验均符合正态分布,差异有统计学意义(F=93.616、103.614,均P=0.000)。与PSD 0.0 μmol/L组相比较,PSD 1.0、2.0及5.0 μmol/L组cleaved caspase-3、cleaved caspase-9蛋白表达水平升高,差异有统计学意义(P<0.05)。见图 3。

|
| A:Hoechst 33258染色检测细胞凋亡(×200);B:细胞凋亡率;C:cleaved caspase-3、cleaved caspase-9蛋白表达;D:cleaved caspase-3、cleaved caspase-9蛋白表达水平直方图。1:PSD 0.0 μmol/L组;2:PSD 1.0 μmol/L组;3:PSD 2.0 μmol/L组;4:PSD 5.0 μmol/L组。*与PSD 0.0 μmol/L组比较,P<0.05 图 3 PSD对U251MG细胞凋亡和cleaved caspase-3、cleaved caspase-9蛋白表达水平的影响(x±s,n=3) |
各组细胞c-MET mRNA和蛋白表达水平经Shapiro-Wilk正态性检验均符合正态分布,差异有统计学意义(F=75.383、72.213,均P=0.000)。与PSD 0.0 μmol/L组相比较,PSD 1.0.、2.0及5.0 μmol/L组c-MET mRNA和蛋白表达水平降低,差异有统计学意义(P<0.05)。见图 4。
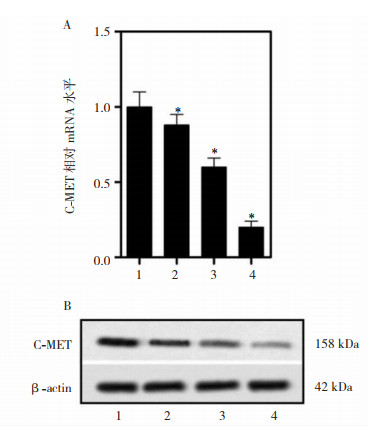
|
| A:C-MET mRNA水平;B:c-MET蛋白表达;1:PSD 0.0 μmol/L组;2:PSD 1.0 μmol/L组;3:PSD 2.0 μmol/L组;4:PSD 5.0 μmol/L组。*与PSD 0.0 μmol/L组比较,P<0.05 图 4 PSD对c-MET mRNA水平和蛋白表达水平的影响(x±s,n=3) |
PSD联合PHA-665752处理后c-MET蛋白表达水平经Shapiro-Wilk正态性检验均符合正态分布,差异有统计学意义(F=249.420,P=0.000)。与Control组(1.30±0.10)相比较,PHA-665752 5.0μmol/L组(0.80±0.07)、PSD 5.0μmol/L组(0.15±0.04)和PSD 5.0μmol/L+PHA-665752 5.0 μmol/L组(0.03±0.02)c-MET蛋白表达水平降低,差异有统计学意义(P<0.05)。见图 5。

|
| 图 5 PSD联合PHA-665752对c-MET蛋白表达水平的影响(x±s,n=3) |
各组细胞迁移率经Shapiro-Wilk正态性检验均符合正态分布,差异有统计学意义(F=174.950,P=0.000)。与Control组(83.38±5.38)%比较,PSD 5.0μmol/L组(24.36±6.34)%细胞迁移率降低(P<0.01),PHA-665752 5.0 μmol/L组(127.77±4.55)%细胞迁移率升高(P<0.01),PHA-665752 5.0 μmol/L+PSD 5.0 μmol/L组(69.62±5.88)%细胞迁移率低于PHA-665752 5.0 μmol/L组。
各组细胞侵袭数经Shapiro-Wilk正态性检验均符合正态分布,差异有统计学意义(F=67.418,P=0.000)。与Control组(235.72±30.73)相比较,PSD 5.0μmol/L组(78.17±17.02)细胞侵袭数降低(P<0.01),PHA-665752 5.0 μmol/L组(408.04±34.62)细胞侵袭数升高(P<0.01),PHA-665752 5.0 μmol/L+PSD 5.0 μmol/L组(223.25±28.48)细胞侵袭数低于PHA-665752 5.0 μmol/L组。
各组细胞MMP-2、uPA、PAI-1、VEGF蛋白表达水平经Shapiro-Wilk正态性检验均符合正态分布,差异有统计学意义(F=155.770、211.387、136.656、165.158,均P=0.000)。与Control组相比较,PSD 5.0 μmol/L组MMP-2、uPA、PAI-1、VEGF蛋白水平降低(P<0.01),PHA-665752 5.0 μmol/L组MMP-2、uPA、PAI-1、VEGF蛋白水平升高(P<0.01),PHA-665752 5.0 μmol/L+PSD 5.0 μmol/L组MMP-2、uPA、PAI-1、VEGF蛋白水平低于PHA-665752 5.0 μmol/L组。
各组细胞细胞凋亡率经Shapiro-Wilk正态性检验均符合正态分布,差异有统计学意义(F=39.518,P=0.000)。与Control组(12.07±2.11)%相比较,PSD 5.0 μmol/L组(30.09±3.04)%细胞凋亡率升高(P<0.01),PHA-665752 5.0 μmol/L组(5.79±3.28)%细胞凋亡率降低(P<0.01),PHA-665752 5.0μmol/L+PSD 5.0 μmol/L组(10.49±3.17)%细胞凋亡率高于PHA-665752 5.0 μmol/L组。
各组细胞cleaved caspase-3、cleaved caspase-9蛋白表达水平经Shapiro-Wilk正态性检验均符合正态分布,差异有统计学意义(F=74.235、86.139,均P=0.000、)。与Control组相比较,PSD 5.0 μmol/L组cleaved caspase-3、cleaved caspase-9蛋白水平升高(P<0.01),PHA-665752 5.0μmol/L组cleaved caspase-3、cleaved caspase-9蛋白水平降低(P<0.01),PHA-665752 5.0 μmol/L+PSD 5.0 μmol/L组cleaved caspase-3、cleaved caspase-9蛋白水平高于PHA-665752 5.0 μmol/L组。见图 6。
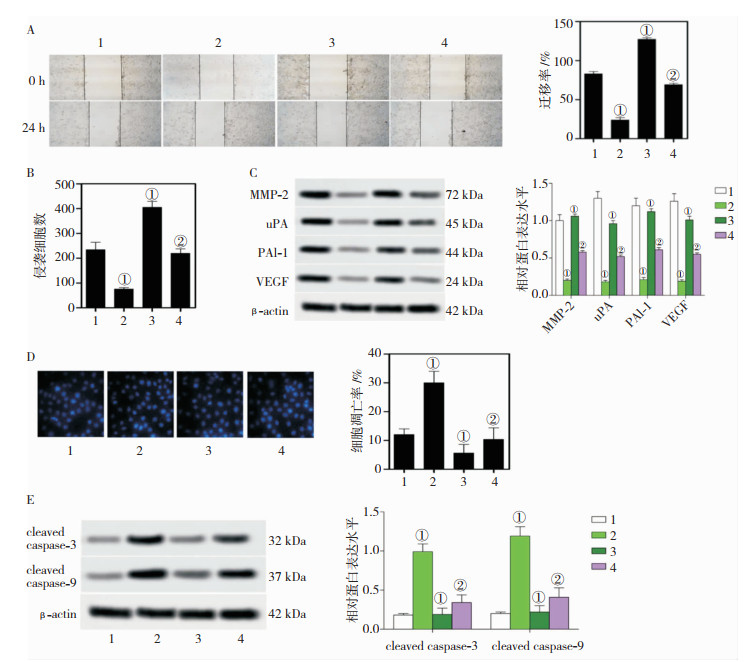
|
| A:划痕法检测细胞迁移(×200);B:细胞侵袭(×200);C:MMP-2、uPA、PAI-1、VEGF蛋白表达;D:Hoechst 33258染色检测细胞凋亡;E:cleaved caspase-3、cleaved caspase-9蛋白表达。1:Control组;2:PSD 5.0 μmol/L组;3:PHA-665752 5.0 μmol/L组;4:PHA-665752+PSD 5.0 μmol/L组。①与Control组比较,P<0.01;②与PHA-665752 5.0 μmol/L组比较,P<0.01 图 6 PSD联合c-MET抑制剂对U251MG细胞的影响(x±s,n=3) |
神经胶质瘤是神经外胚叶衍化出的胶质细胞恶性病变引发的颅内肿瘤[5]。神经胶质瘤被认为是所有癌症中最具破坏性的肿瘤,因为它们主要影响大脑或脊髓细胞[6]。胶质瘤的特征在于高增殖潜力,浸润性生长行为,肿瘤内异质性和肿瘤复发,胶质瘤可以影响所有年龄段的人[7]。由于胶质瘤的各种治疗方式,如手术、放射治疗和化学疗法普遍存在局限性,且治疗胶质瘤一线化疗药物常常受到化学抗性反应的持久性的限制[8],杀伤肿瘤细胞的同时也同时杀伤正常组织细胞。因此,迫切需要促进创新药物开发的研究。
白头翁是银莲花属多年生草本植物,广泛分布于中国东北地区,根常用作中药用于治疗阿米巴和细菌性痢疾[9]。PSD是从白头翁的干燥根提取分离的五环三萜类皂苷类单体化合物,近年来药理实验研究发现,PSD具有抗肿瘤作用,对肝癌、肺癌、乳腺癌、胶质瘤、结肠癌、胰腺癌和胃癌具有很强的抗癌活性[10-15]。本研究发现PSD具有抑制正常astrocyte细胞和胶质瘤U251MG细胞活力的作用,说明PSD对胶质瘤细胞具有杀伤作用。
神经胶质瘤是一种具有高度侵袭性、迁移性和血管生成的脑癌,由于对放射和化疗的抵抗以及该肿瘤的高度侵入性,单个胶质瘤细胞可以在整个大脑侵入,并且继发病产生的位置常常远离原发肿瘤,因而降低了手术切除的疗效[16]。基质金属蛋白酶具有降解细胞外基质中各种蛋白成分,从而破坏肿瘤细胞侵袭的组织学屏障,促进细胞迁移,在肿瘤细胞的侵袭和迁移过程中起关键作用[17]。胶质瘤的侵袭性依赖于肿瘤细胞侵袭期间细胞外基质的蛋白水解,uPA与uPAR结合催化纤溶酶原转化为纤溶酶,从而导致有效的蛋白水解作用[18]。已在侵袭性胶质母细胞瘤中观察到uPA过表达[19],因此,降低uPA表达可限制胶质瘤侵袭。PAI-1是纤溶酶原-纤溶酶系统中的主要调节因子,是uPA的主要抑制剂,通过它抑制纤溶酶原激活,已有研究证明胶质瘤中PAI-1过表达与胶质瘤患者较短存活率相关[20]。VEGF是胶质母细胞瘤血管生成反应的关键调节因子,在临床实验中,抗血管生成治疗结果令人鼓舞[21]。Zhang等[22]研究发现紫草素以剂量依赖性方式抑制MMP-2的表达减弱胶质母细胞瘤细胞系U87和U251MG的增殖,迁移和侵袭能力。Ryu等[23]研究发现白藜芦醇通过下调uPA和uPAR表达减少胶质瘤细胞U373MG的侵袭。Liu等[24]研究发现碳离子辐射通过下调VEGF和MMP-2表达抑制胶质瘤和内皮细胞的侵袭和迁移。本研究结果与上述研究结果一致,PSD通过下调MMP-2、uPA、PAI-1、VEGF蛋白表达抑制细胞迁移和侵袭。
细胞凋亡是一种程序性细胞死亡,其中细胞被破坏而不会将有害物质释放到周围区域。细胞凋亡通过消除旧的,不必要的和患病的细胞在体内发育和维持中起关键作用[25]。凋亡途径分为线粒体和死亡受体途径,Caspase家族是细胞凋亡的关键执行者,Caspase-9介导线粒体凋亡途径的细胞凋亡过程,激活Caspase-3,引发Caspase级联反应,导致细胞凋亡[26]。Caspase-9蛋白的低表达与胶质瘤恶性程度相关,可作为评价胶质瘤恶性程度的生物学指标[27]。夏春义等[28]研究发现槲皮素具有上调胶质瘤大鼠脑组织Caspase-3和Caspase-9蛋白的表达的作用,对脑胶质瘤有潜在的治疗作用。本研究发现,PSD促进U251MG细胞凋亡,上调cleaved caspase-3、cleaved caspase-9蛋白水平。
c-MET也称肝细胞生长因子受体(HGFR),是一种由c-MET原癌基因编码的蛋白产物,它是一种高亲和性的受体酪氨酸激酶,是肝细胞生长因子跨膜受体,其能促进肿瘤细胞的增殖,调节肿瘤细胞的迁移,增加肿瘤细胞的侵袭能力和诱导肿瘤新生血管的生成[29]。复发性胶质瘤表达较高水平的c-MET,且c-MET过表达与胶质瘤患者中较短的存活时间相关[30]。c-MET的过度表达预示着预后不良并与胶质瘤的恶性程度相关,因此,靶向抑制c-MET表达是治疗胶质瘤的重要策略。在本研究中,观察到PSD下调胶质瘤细胞U251MG中c-MET蛋白水平,下调c-MET mRNA水平,且与c-MET抑制剂联合应用下调c-MET蛋白水平,说明PSD可作为c-MET抑制剂应用。
综上所述,PSD可能通过靶向c-MET抑制U251MG细胞细胞活力、迁移和侵袭,并诱导细胞凋亡。
| [1] |
孔冰, 左明荣, 刘艳辉. 华蟾素抗胶质瘤的作用及机制研究[J]. 四川大学学报(医学版), 2018, 49(3): 388-393. |
| [2] |
罗国强, 秦彦昌, 张百平, 等. 长链非编码RNA-ATB在胶质瘤中的表达水平和临床意义[J]. 陕西医学杂志, 2019, 48(7): 831-833, 849. DOI:10.3969/j.issn.1000-7377.2019.07.004 |
| [3] |
孙善美, 宋鲁成. 白头翁皂苷D抗肿瘤的研究进展[J]. 临床肿瘤学杂志, 2017, 22(12): 1143-1146. |
| [4] |
李博.白头翁皂苷D抑制人脑胶质母细胞瘤U87MG及U251MG生长的实验研究[D].西安: 第四军医大学, 2014.
|
| [5] |
柴茂林, 马党捐. 磁共振功能成像在脑胶质瘤诊断中的应用价值[J]. 陕西医学杂志, 2019, 48(5): 603-606. DOI:10.3969/j.issn.1000-7377.2019.05.017 |
| [6] |
冯毅, 黄琦丹, 陈家康. 抑制TC-1表达对胶质瘤细胞增殖、凋亡、迁移和侵袭的影响[J]. 医学分子生物学杂志, 2019, 16(5): 474-477. DOI:10.3870/j.issn.1672-8009.2019.05.011 |
| [7] |
Rajesh Y, Pal I, Banik P, et al. Insights into molecular therapy of glioma:current challenges and next generation blueprint[J]. Acta Pharmacol Sin, 2017, 38(5): 591-613. DOI:10.1038/aps.2016.167 |
| [8] |
赵舒杨, 雷艳杰, 马世杰, 等. 龙葵碱联合KLF16基因对胶质瘤细胞增殖、凋亡的影响及其机制研究[J]. 分子诊断与治疗杂志, 2019, 11(4): 303-309. DOI:10.3969/j.issn.1674-6929.2019.04.010 |
| [9] |
Xu YJ, Bai L, Liu YH, et al. A new triterpenoid saponin from Pulsatilla cernua[J]. Molecules, 2010, 15(3): 1891-1897. DOI:10.3390/molecules15031891 |
| [10] |
贺武斌, 苏荣健. 白头翁皂苷D联合索拉非尼对人肝癌细胞侵袭与转移的影响[J]. 山东大学学报(医学版), 2016, 54(7): 18-22. |
| [11] |
Son MK, Jung KH, Hong SW, et al. SB365, Pulsatilla saponin D suppresses the proliferation of human colon cancer cells and induces apoptosis by modulating the AKT/mTOR signalling pathway[J]. Food Chem, 2013, 136(1): 26-33. DOI:10.1016/j.foodchem.2012.07.096 |
| [12] |
Son MK, Jung KH, Lee HS, et al. SB365, Pulsatilla saponin D suppresses proliferation and induces apoptosis of pancreatic cancer cells[J]. Oncol Rep, 2013, 30(2): 801-808. DOI:10.3892/or.2013.2517 |
| [13] |
Hong SW, Jung KH, Lee HS, et al. SB365, Pulsatilla saponin D, targets c-Met and exerts antiangiogenic and antitumor activities[J]. Carcinogenesis, 2013, 34(9): 2156-2169. DOI:10.1093/carcin/bgt159 |
| [14] |
胡超, 岳文华, 彭翠平, 等. 白头翁皂苷D对乳腺癌MCF-7细胞的体内外抗肿瘤作用研究[J]. 中药新药与临床药理, 2017, 28(4): 418-423. |
| [15] |
Jang WJ, Park B, Jeong GS, et al. SB365, Pulsatilla saponin D, suppresses the growth of gefitinib-resistant NSCLC cells with Met amplification[J]. Oncol Rep, 2014, 32(6): 2612-2618. DOI:10.3892/or.2014.3528 |
| [16] |
张洪玉, 李海晶, 唐域. hsa-miR-326靶向FGF11影响神经胶质瘤细胞生长、侵袭及迁移的实验研究[J]. 医学分子生物学杂志, 2019, 16(2): 107-113. |
| [17] |
李建忠, 刘志国, 冯凯, 等. 肝素对四氧化二氮致肺损伤小鼠血清金属蛋白酶-2/9表达的影响[J]. 中国急救复苏与灾害医学杂志, 2016, 11(3): 247-249. DOI:10.3969/j.issn.1673-6966.2016.03.011 |
| [18] |
王丽, 杨帆, 孔祥顺, 等. uPA、PAI-1组织表达与新辅助化疗治疗乳腺癌疗效及预后的相关性分析[J]. 解放军医药杂志, 2016, 28(6): 33-35, 40. DOI:10.3969/j.issn.2095-140X.2016.06.008 |
| [19] |
Yamamoto M, Ueno Y, Hayashi S, et al. The role of proteolysis in tumor invasiveness in glioblastoma and metastatic brain tumors[J]. Anticancer Res, 2002, 22(6C): 4265-4268. |
| [20] |
Roy A, Coum A, Marinescu VD, et al. Glioma-derived plasminogen activator inhibitor-1(PAI-1) regulates the recruitment of LRP1 positive mast cells[J]. Oncotarget, 2015, 6(27): 23647-23661. DOI:10.18632/oncotarget.4640 |
| [21] |
刘燕青, 齐丽莎, 刘亚敏. 肿瘤血管生成的分子机制[J]. 中国急救复苏与灾害医学杂志, 2008, 3(2): 117-120. DOI:10.3969/j.issn.1673-6966.2008.02.024 |
| [22] |
Zhang FY, Hu Y, Que ZY, et al. Shikonin inhibits the migration and invasion of human glioblastoma cells by targeting phosphorylated β-catenin and phosphorylated PI3K/Akt:a potential mechanism for the anti-glioma efficacy of a traditional Chinese herbal medicine[J]. Int J Mol Sci, 2015, 16(10): 23823-23848. DOI:10.3390/ijms161023823 |
| [23] |
Ryu J, Ku BM, Lee YK, et al. Resveratrol reduces TNF-α-induced U373MG human glioma cell invasion through regulating NF-κB activation and uPA/uPAR expression[J]. Anticancer Res, 2011, 31(12): 4223-4230. |
| [24] |
Liu Y, Liu YY, Sun C, et al. Carbon ion radiation inhibits glioma and endothelial cell migration induced by secreted VEGF[J]. PLoS One, 2014, 9(6): e98448. DOI:10.1371/journal.pone.0098448 |
| [25] |
王爱红, 黄兰燕, 米志宽. 中药抑制胃癌肿瘤细胞增殖研究进展[J]. 陕西中医, 2018, 39(3): 403-405. DOI:10.3969/j.issn.1000-7369.2018.03.041 |
| [26] |
张伟, 林海, 常翔, 等. 柔筋止颤片通过抑制ROS通路减轻M PP+诱导S H-SY5Y细胞凋亡实验研究[J]. 陕西中医, 2020, 41(2): 160-163. |
| [27] |
Murray J, Renslo AR. Modulating caspase activity:beyond the active site[J]. Curr Opin Struct Biol, 2013, 23(6): 812-819. DOI:10.1016/j.sbi.2013.10.002 |
| [28] |
夏春义, 陈荣举, 梁鑫, 等. 槲皮素对脑胶质瘤大鼠Caspase-3和Caspase-9表达的影响[J]. 解剖科学进展, 2016, 22(2): 159-161. |
| [29] |
张丽娟, 张旭力, 王娟, 等. miR-199a-3p抑制卵巢癌SK0V3细胞增殖侵袭能力及其机制[J]. 临床误诊误治, 2017, 30(12): 90-93. |
| [30] |
Liu W, Fu YB, Xu SC, et al. c-Met expression is associated with time to recurrence in patients with glioblastoma multiforme[J]. J Clin Neurosci, 2011, 18(1): 119-121. |
 2020, Vol. 47
2020, Vol. 47



