扩展功能
文章信息
- 杜顺利, 王衍刚, 吴家斌, 张俊杰, 闫东明
- DU Shun-Li, WANG Yan-Gang, WU Jia-Bin, ZHANG Jun-Jie, YAN Dong-Ming
- 黏蛋白16在神经胶质瘤组织中表达及意义
- Expression and significance of mucin 16 in glioma
- 国际神经病学神经外科学杂志, 2020, 47(6): 581-586
- Journal of International Neurology and Neurosurgery, 2020, 47(6): 581-586
-
文章历史
收稿日期: 2020-10-27
修回日期: 2020-11-30
2. 郑州大学第一附属医院神经外科, 河南 郑州 450001
2. Department of Neurosurgery, First Affiliated Hospital of Zhengzhou University, Henan Zhengzhou 450001
神经胶质瘤恶性程度高、侵袭力强,尽管现有的综合治疗策略不断改善,但治疗效果依然不尽人意,治疗后复发、转移或耐药发生风险高,总体预后仍较差[1]。有研究指出[2],细胞基底膜与细胞外基质降解减少细胞间黏附,在肿瘤侵袭转移中发挥关键性作用。黏蛋白(Mucin,MUC)作为一种糖蛋白,不仅在细胞间信号传递中发挥重要作用,而且与细胞间黏附及免疫反应密切相关[3],近年来其在肿瘤中的作用越来越受到重视,不仅可通过减少肿瘤细胞间黏附力而加速细胞转移扩散[4],而且可通过调控免疫系统而使肿瘤细胞逃避免疫杀灭[5]。MUC16作为MUC家族成员,参与了胆囊癌[6]、胃癌[7]等多种恶性肿瘤发生进展,但其在神经胶质瘤中的作用鲜有报道。本研究分析了神经胶质瘤组织中MUC16蛋白表达,探讨其与临床病理指标及预后的相关性,并通过特异性沉默人胶质瘤细胞U87中MUC16基因的表达,观察其对该细胞增殖、迁移和侵袭力的影响。
1 资料与方法 1.1 资料 1.1.1 临床资料选取2013年5月—2019年5月在焦作市人民医院行手术治疗且资料完整的神经胶质瘤患者86例,术前均未行放化疗,术后病理学检查证实为神经胶质瘤。男性48例,女性38例;年龄34~75岁,平均(53.24±9.62)岁。同期,选取在我院因颅脑外伤行手术治疗的患者45例。男性27例,女性18例,年龄32~74岁,平均(54.02±10.13)岁。两组性别构成比、年龄比较,差异无统计学意义(P>0.05)。本研究通过医院医学伦理委员会批准(批准号:JZRMYY201303182263),所有患者均行知情同意。
1.1.2 主要试剂和设备免疫组织化学(简称免疫组化)试剂盒及配套试剂购自武汉博士德生物工程有限公司,兔抗人MUC16多克隆抗体购自武汉爱博泰克生物科技有限公司,U87细胞购自南京康佰生物科技有限公司,DMEM培养液、胎牛血清和胰蛋白酶购自美国Gibco公司,MUC16干扰序列及阴性对照序列由上海吉玛制药技术有限公司设计合成,MUC16和内参引物由生工生物工程(上海)股份有限公司设计合成,总RNA提取试剂和LipofectamineTM 2000转染试剂购自美国Invitrogen公司,逆转录和PCR扩增试剂盒购自北京诺博莱德科技有限公司,Transwell小室购自上海坤肯生物化工有限公司,Martrigel基质胶购自美国BD公司,实时荧光定量PCR仪购自美国ABI公司。
1.2 方法 1.2.1 免疫组化法检测神经胶质瘤和正常脑组织中MUC16蛋白表达取组织标本,多聚甲醛固定,脱水、石蜡包埋,4 μm厚切片、水化,置于枸缘酸钠缓冲液中加热行抗原修复,加入3%过氧化氢溶液中以灭活内源性过氧化物酶,磷酸盐缓冲液(PBS)冲洗3次。加入一抗兔抗人MUC16多克隆抗体(1 :1200稀释),4℃下过夜孵育,PBS冲洗3次,加入生物素标记二抗,室温反应60 min,PBS冲洗3次,加入DAB,苏木素复染,脱水、透明、封片,镜下观察。以PBS替代一抗作为阴性对照。所有切片均由病理科具有副高级职称的医师双盲法完成阅片。以细胞膜或细胞质中出现淡黄色或黄褐色染色为阳性,随机取5个高倍视野,采用半定量法[8]对结果进行评价:①染色强度:从无染色、淡黄、棕黄、黄褐色依次赋予0、1、2、3分;②阳性细胞比例:从 < 5%、5%~25%、>25%~50%、>50%~75%、>75%依次赋予0、1、2、3、4分;③将①和②相乘,0~3分为阴性(-),≥3分为阳性(+)。
1.2.2 细胞培养和分组在含5%二氧化碳CO2的37℃的恒温培养中用含10%胎牛血清的DMEM培养液对U87细胞培养,待细胞密度达70%以上时,胰酶消化,传代。取对数生长期细胞,使用LipofectamineTM 2000转染试剂进行分组转染。①MUC16干扰组,转染MUC16的干扰序列:正向5’-CACCGATGATGATGATGATGGGGG-3’,反向5’-AAACCCCCCATCATCATCATCATC-3’;②阴性对照组,转染阴性对照序列:正向5’-GAGGGCCTATTTCCCATGATTCC-3’,反向5’-GTTGGGCGGTCAGCCAGGCGGGC-3’;③空白组:不作任何处理。转染完成后继续培养48 h。
1.2.3 实时荧光定量PCR检测细胞中MUC16表达经酶处理48 h的细胞,离心取细胞沉淀,PBS冲洗3次,加入细胞裂解液,用总RNA提取试剂提取总RNA并检测其纯度。按逆转录试剂盒说明进行逆转录获得模板链cDNA,使用实时荧光定量PCR仪按照PCR扩增试剂盒说明书步骤对引物进行扩增,引物序列:MUC16,正向5’-ACATCAACTCCTGCCTTCCCAGAA-3’,反向5’-ACCAGTGGGCATTCCAGAAAGAGA-3’;β-actin,正向5’-GTCCACCGCAAATGCTTCTA-3’,反向5’-TGCTGTCACCTTCACCGTTC-3’。反应条件:94℃预变性2 min,94℃变性30 s,57℃退火30 s,74℃延伸30 s,行38个循环。每个样品设6个平行复孔。用2-△△Ct法计算细胞中MUC16 mRNA相对表达量。
1.2.4 MTT检测细胞增殖力取各组转染后细胞,胰酶消化,接种于96孔板,密度5×103/孔,每孔3板,将含10%胎牛血清的培养液100 μL加入各孔,分别于12、24、48、72和96 h时停止培养,加入MTT液20 μL,孵育4 h,弃上清,各孔加入150μL的DMSO,振荡5 min,用酶标仪检测各孔吸光度(A)值。
1.2.5 划痕实验检测细胞迁移力用Marker笔在无菌6孔板背面每间隔1 cm划横线,将经酶处理48 h的细胞接种于6孔板,继续培养至细胞融合度在90%以上,用200 μL的移液管枪头在6孔板内垂直于横线划痕,PBS冲洗3次,加入无血清培养液,继续培养。分别于0、24和48h时测量划痕两边细胞间距离,计算划痕愈合率=(0 h划痕宽度-24或48 h划痕宽度)/0 h划痕宽度×100%。
1.2.6 Transwell法检测细胞侵袭力取Transwell小室,将Matrigel基质胶用无血清培养液稀释后平铺于小室上室,过夜风干备用。经酶处理48 h的细胞,离心取细胞沉淀,用无血清培养液重悬,密度调整为2.5×105/mL,将200 μL的细胞悬液加入小室上室,下室则加入600 μL含20%胎牛血清的培养液,培养箱中培养48 h,多聚甲醛固定,结晶紫染色,并将散落细胞擦除。镜下观察,取5个视野计数穿膜细胞数,重复实验3次。
1.3 统计学方法使用SPSS 21.0软件分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析和LSD-t检验,计数资料采用例(%)表示,组间比较采用χ2检验,P < 0.05为差异有统计学意义。
2 结果 2.1 神经胶质瘤和正常脑组织中MUC16蛋白表达MUC16蛋白在神经胶质瘤患者中阳性表达率为73.26%(63/86),正常脑组织中的为26.67%(12/45),两者比较差异有统计学意义(χ2=26.200,P < 0.001)。见图 1。
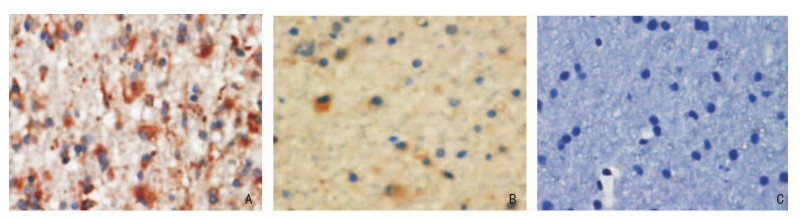
|
| A:高级别神经胶质瘤;B:低级别神经胶质瘤;C:正常脑组织 图 1 免疫组化法检测MUC16蛋白在神经胶质瘤和正常脑组织中表达(SP,×400) |
MUC16蛋白在不同年龄、性别、病理学类型、肿瘤部位和卡诺夫斯凯计分(KPS)间阳性表达率比较,差异无统计学意义(P>0.05),而在不同WHO分级间阳性表达率比较,差异有统计学意义(P < 0.05)。见表 1。
| 指标 | n | MUC16蛋白 | χ2值 | P值 | |
| + | - | ||||
| 年龄 | |||||
| < 53岁 | 41 | 31(75.61) | 10(24.39) | ||
| ≥53岁 | 45 | 32(71.11) | 13(28.89) | 0.222 | 0.638 |
| 性别 | |||||
| 男性 | 48 | 37(77.08) | 11(22.92) | ||
| 女性 | 38 | 26(68.42) | 12(31.58) | 0.812 | 0.367 |
| 病理学类型 | |||||
| 胶质母细胞瘤 | 37 | 28(75.68) | 9(24.32) | ||
| 少突胶质细胞瘤 | 31 | 23(74.19) | 8(25.81) | ||
| 星形胶质细胞瘤 | 18 | 12(66.67) | 6(33.33) | 0.523 | 0.770 |
| 肿瘤部位 | |||||
| 幕上 | 54 | 41(75.93) | 13(24.07) | ||
| 幕下 | 32 | 22(68.75) | 10(31.25) | 0.528 | 0.467 |
| WHO分级 | |||||
| Ⅰ、Ⅱ级 | 34 | 20(58.82) | 14(41.18) | ||
| Ⅲ、Ⅳ级 | 52 | 43(82.69) | 9(17.31) | 5.978 | 0.014 |
| KPS | |||||
| ≥80分 | 35 | 24(68.57) | 11(31.43) | ||
| < 80分 | 51 | 39(76.47) | 12(23.53) | 0.661 | 0.416 |
MUC16干扰组、阴性对照组和空白组细胞中MUC16 mRNA相对表达量分别为(0.28±0.08)、(0.97±0.07)和(1.01±0.10),三组比较,差异有统计学意义(F=139.504,P=0.000);阴性对照组和空白组细胞中MUC16 mRNA相对表达量比较,差异无统计学意义(P=0.407),MUC16干扰组细胞中MUC16 mRNA相对表达量低于阴性对照组和空白组(P < 0.05)。
2.4 3组细胞增殖活力3组细胞A值在24、48、72及96 h时比较,差异有统计学意义(P < 0.05)。MUC16干扰组细胞24、48、72和96 h时A值均低于阴性对照组和空白组,差异有统计学意义(P < 0.05)。见表 2。
| 组别 | 12 h | 24 h | 48 h | 72 h | 96 h |
| MUC16干扰组 | 0.16±0.04 | 0.24±0.10 | 0.34±0.08 | 0.41±0.04 | 0.56±0.08 |
| 阴性对照组 | 0.21±0.07 | 0.40±0.09* | 0.53±0.10* | 0.73±0.07* | 0.81±0.17* |
| 空白组 | 0.17±0.04 | 0.43±0.07* | 0.54±0.05* | 0.71±0.04* | 0.85±0.06* |
| F值 | 1.307 | 8.365 | 11.829 | 80.353 | 11.257 |
| P值 | 0.300 | 0.004 | 0.001 | 0.000 | 0.001 |
| 注:*与MUC16干扰组比较,P < 0.05 | |||||
3组细胞在24和48 h的划痕愈合率比较,差异有统计学意义(P < 0.05)。MUC16干扰组细胞24和48 h时划痕愈合率均低于阴性对照组和空白组(P < 0.05)。见表 3和图 2。
| 组别 | 24 h | 48 h |
| MUC16干扰组 | 11.00±2.76 | 25.17±4.54 |
| 阴性对照组 | 35.17±7.70* | 47.50±6.50* |
| 空白组 | 37.33±6.28* | 48.83±7.36* |
| F值 | 36.140 | 27.189 |
| P值 | 0.000 | 0.000 |
| 注:*与MUC16干扰组比较,P < 0.05 | ||

|
| 图 2 划痕实验检测细胞迁移情况(×200) |
MUC16干扰组、阴性对照组和空白组侵袭细胞数分别为(82.00±8.90)、(119.67±7.99)和(122.67±12.80)个,三组比较,差异有统计学意义(F=30.119,P=0.000);阴性对照组和空白组侵袭细胞数差异无统计学意义(P=0.615),MUC16干扰组侵袭细胞数低于阴性对照组和空白组(P < 0.05)。见图 3。
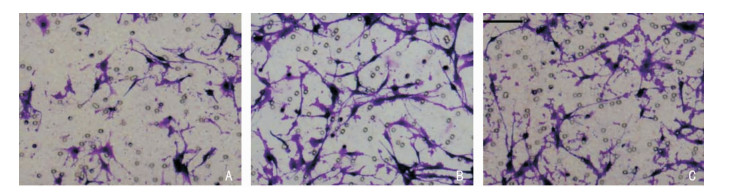
|
| A:MUC16干扰组;B:阴性对照组;C:空白组 图 3 Transwell法检测细胞侵袭能力(结晶紫,×200) |
神经胶质瘤易脱离原发灶而转移至其他脑组织,手术根除的可能性微乎其微,导致患者总体生存时间短,死亡率高[9],尽管临床上针对恶性肿瘤的综合治疗方案不断完善,但神经胶质瘤的易侵袭转移性致使这些治疗方案在改善患者预后方面疗效有限[10]。随着分子靶向治疗技术在肿瘤治疗中的成功应用[11],为神经胶质瘤的诊疗提供了新的方向,有望为神经胶质瘤诊疗打开突破口。MUC16作为一种跨膜糖蛋白,定位于人染色体19p13.2,在保护及修复上皮细胞中发挥重要作用[12],研究发现[13],MUC16蛋白在受损或癌变上皮细胞中表达异常。近年来研究发现[14],其可能在促进肿瘤细胞浸润、转移、免疫逃逸中扮演重要角色。本研究结果显示,神经胶质瘤组织中MUC16蛋白呈高表达,提示MUC16可能参与了神经胶质瘤发病过程。本研究结果显示,MUC16蛋白在WHO分级Ⅲ、Ⅳ级的神经胶质瘤组织中阳性表达率高于Ⅰ、Ⅱ级,说明其可能参与了神经胶质瘤病程进展,与其恶性程度有关。本研究对神经胶质瘤U87细胞中转染MUC16干扰序列,结果显示,MUC16干扰组细胞中MUC16 mRNA相对表达量较阴性对照组和空白组降低,提示U87细胞中MUC16基因表达被抑制。本研究结果显示,MUC16干扰组细胞24、48、72和96 h时吸光度值均低于阴性对照组和空白组,说明抑制MUC16基因表达可抑制细胞增殖活力,本研究结果显示,MUC16干扰组细胞24和48 h时划痕愈合率及侵袭细胞数均低于阴性对照组和空白组,说明抑制U87细胞中MUC16基因表达可明显抑制细胞迁移力和侵袭力。
综上所述,神经胶质瘤组织中MUC16呈高表达,且与WHO分级呈正相关,下调U87细胞中MUC16基因表达可抑制细胞增殖、迁移和侵袭能力,有望为神经胶质瘤机制研究及基因靶向治疗提供新的靶点。
| [1] |
Davis ME. Epidemiology and overview of gliomas[J]. Semin Oncol Nurs, 2018, 34(5): 420-429. DOI:10.1016/j.soncn.2018.10.001 |
| [2] |
Winer A, Adams S, Mignatti P. Matrix metalloproteinase inhibitors in cancer therapy:turning past failures into future successes[J]. Mol Cancer Ther, 2018, 17(6): 1147-1155. DOI:10.1158/1535-7163.MCT-17-0646 |
| [3] |
Niv Y, Ho SB, Fass R, et al. Mucin expression in the esophageal malignant and pre-malignant states:a systematic review and meta-analysis[J]. J Clin Gastroenterol, 2018, 52(2): 91-96. DOI:10.1097/MCG.0000000000000863 |
| [4] |
Jung YS, Wang WQ, Jun S, et al. Deregulation of CRAD-controlled cytoskeleton initiates mucinous colorectal cancer via β-catenin[J]. Nat Cell Biol, 2018, 20(11): 1303-1314. DOI:10.1038/s41556-018-0215-z |
| [5] |
曾榃伦. 乳腺癌免疫治疗研究进展[J]. 中国肿瘤生物治疗杂志, 2019, 26(1): 96-102. |
| [6] |
段海章, 陈进忠, 石岩, 等. MUC1和MUC16在胆囊癌中的表达及临床意义[J]. 现代肿瘤医学, 2018, 26(18): 2892-2896. DOI:10.3969/j.issn.1672-4992.2018.18.017 |
| [7] |
Li XC, Pasche B, Zhang W, et al. Association of MUC16 mutation with tumor mutation load and outcomes in patients with gastric cancer[J]. JAMA Oncol, 2018, 4(12): 1691-1698. DOI:10.1001/jamaoncol.2018.2805 |
| [8] |
赵学英, 樊明德, 董文艳, 等. 三结构域蛋白26在胶质瘤组织中的表达及临床意义[J]. 山东大学学报(医学版), 2019, 57(3): 63-68. |
| [9] |
Batash R, Asna N, Schaffer P, et al. Glioblastoma multiforme, diagnosis and treatment; recent literature review[J]. Curr Med Chem, 2017, 24(27): 3002-3009. |
| [10] |
Farazdaghi MK, Katowitz WR, Avery RA. Current treatment of optic nerve gliomas[J]. Curr Opin Ophthalmol, 2019, 30(5): 356-363. DOI:10.1097/ICU.0000000000000587 |
| [11] |
Guan LY, Lu Y. New developments in molecular targeted therapy of ovarian cancer[J]. Discov Med, 2018, 26(144): 219-229. |
| [12] |
刘畅, 张珉, 田兴. MUC16对胆囊癌细胞生物学行为的调控作用及机制分析[J]. 肿瘤学杂志, 2019, 25(5): 436-441. |
| [13] |
宋毓平, 张庆华, 龚丹妮, 等. MUC16突变在皮肤恶性黑色素瘤患者预后中的作用分析[J]. 重庆医学, 2019, 48(19): 3333-3336. |
| [14] |
Aithal A, Rauth S, Kshirsagar P, et al. MUC16 as a novel target for cancer therapy[J]. Expert Opin Ther Targets, 2018, 22(8): 675-686. DOI:10.1080/14728222.2018.1498845 |
 2020, Vol. 47
2020, Vol. 47




