扩展功能
文章信息
- 徐晓娅, 郭晓聪, 邱涛, 蒲荣梅, 黄琳明
- XU Xiao-Ya, GUO Xiao-Cong, QIU Tao, PU Rong-Mei, HUANG Lin-Ming
- 尿阿尔茨海默病相关神经丝蛋白联合血浆同型半胱氨酸测定在阿尔茨海默病诊断中的研究
- A study on measurement of Alzheimer-associated neuronal thread protein in urine combined with plasma homocysteine for diagnosing Alzheimer's disease
- 国际神经病学神经外科学杂志, 2020, 47(5): 498-502
- Journal of International Neurology and Neurosurgery, 2020, 47(5): 498-502
-
文章历史
收稿日期: 2020-02-27
修回日期: 2020-09-21
2. 自贡市第一人民医院检验科, 四川 自贡 643000
2. Department of Clinical Laboratory, Zigong First People's Hospital, Zigong, 643000, Sicuang, China
阿尔茨海默病(Alzheimer’s disease, AD)是最常见的认知障碍,约占70%[1]。其核心的病理特征为β-淀粉样蛋白(Aβ)的沉积和神经元纤维缠结。常见生物标记物为脑脊液中的Aβ和tau蛋白[2],但因其需要取脑脊液标本,具有创伤性,患者接受性较差,限制了临床的应用。近年来有研究表明[3],阿尔茨海默病相关神经丝蛋白(AD7c-NTP)在阿尔茨海默病患者脑脊液及尿液中均呈高表达状态,从尿液中检测AD7c-NTP,因其具有无创性,故成为理想的生物标志物。同时也有研究表明,血浆同型半胱氨酸(homocysteine, HCY)水平的增高是痴呆的危险因素[4],其可导致大鼠海马神经元的凋亡,并显著提高体内海马神经元对兴奋毒性和氧化损伤的易感性[5]。那么,尿AD7c -NTP和血浆HCY联合测定是否在AD的早期诊断中具有更高的价值呢?目前这方面的研究甚少。
本研究通过对轻度AD及中重度AD组患者及正常对照组受试者进行尿AD7c-NTP测定及血浆Hcy水平测定,以了解二者各自作为生物标志物在AD诊断中的价值,并探讨二者联合检测对AD诊断的价值,以期发现可应用于AD早期诊断的生物标志物,为AD的早期诊断提供依据。
1 对象与方法 1.1 研究对象选取我院2016年1月至2019年12月记忆门诊及神经内科住院部患者中明确诊断为轻度AD和中重度AD的患者各40例,同时选择社区及我院体检中心的40例正常人作为对照组。所有受试者符合相应的纳入标准及排除标准。本研究经自贡市第一人民医院伦理委员会批准(伦理批准号:2016-伦理审查-07);所有受试者均签署知情同意书。
AD组纳入标准:符合美国精神病学会的精神障碍诊断和统计手册修订第Ⅳ版(DSM- Ⅳ-R)中的AD诊断标准及美国国立神经病学、语言障碍和卒中-老年性痴呆和相关疾病学会工作小组(NINCDS-ADRDA)中很可能AD的诊断标准[6]:①临床检查存在痴呆,并由神经心理检查确定;②有两项或两项以上的认知功能缺损;③进行性恶化;④意识状态无改变;⑤40~90岁之间起病,常在60岁以后;⑥排除其他系统性疾病和其他器质性脑病所致的记忆或认知障碍。神经心理学量表测评:MMSE量表:文盲≤17分;小学≤20分;中学及其以上≤24分。临床痴呆评定量表(Clinical Dementia Rating,CDR)评分≥1分,其中轻度AD组CDR=1分,中重度AD组CDR≥2分。
对照组纳入标准:①本人或陪护者确认无认知障碍症状及严重躯体疾病;②年龄≥40岁;③MMSE:26~30分;④HIS≤4分;⑤CDR:0分;⑥ADL:20分。排除标准:①其他能导致认知功能进行性减退的中枢神经系统疾病:如心脑血管疾病、帕金森病、亨廷顿病、硬膜下血肿、正常颅压脑积水、脑瘤等;②已知能导致痴呆的系统性疾病:如甲状腺功能减退、维生素或叶酸缺乏、烟酸缺乏、低钙血症、神经梅毒、HIV感染;③外源性物质(包括药物)所致的痴呆;④谵妄状态;⑤其他精神障碍所致(抑郁、精神分裂症)。
1.2 尿AD7c-NTP的测定各组受试者均于清晨留取中段尿10 mL,采用深圳市安群生物工程有限公司提供的尿液AD7c-NTP检测试剂盒,严格按照说明书操作。
1.3 血浆Hcy的测定清晨空腹抽取受试者静脉血5 mL,使用威尚生物技术有限公司提供的Hcy检测试剂盒(所用仪器为日立公司008AS全自动生化分析仪),严格按照说明书操作。
1.4 统计学方法应用SPSS 19.0统计软件进行统计学分析。正态分布的计量资料以均数±标准差(x±s)表示,采用方差分析分析组间差异。分别对各组患者尿液AD7c-NTP值及血浆HCY值绘制受试者特征(receiver operating characteristic, ROC)曲线,各参数的诊断效能用曲线下面积(area under the curve, AUC)来衡量,并分析这两个参数诊断AD的敏感度及特异度,通过约登指数确定最佳阈值。联合尿液AD7c-NTP值及血浆HCY值,采用二分类logistic回归方法构建回归模型,采用AUC评价这两个指标的联合诊断效能。P < 0.05为差异有统计学意义。
2 结果 2.1 3组一般资料的比较3组受试者在性别、年龄、受教育年限方面比较,差异无统计学意义(P>0.05)。
2.2 3组MMSE及MoCA评分的比较3组受试者MMSE及MoCA评分比较,差异均有统计学意义(P < 0.01)。与正常对照组比较,轻度与中重度AD组患者MMSE及MoCA评分降低,差异有统计学意义(P < 0.01);与轻度AD组比较,中重度AD组患者MMSE及MoCA评分降低,差异具有统计学意义(P < 0.01)。见表 1。
| 组别 | 例数 | MMSE/分 | MoCA/分 |
| 对照组 | 40 | 27.68±2.51 | 24.92±4.76 |
| 轻度AD组 | 40 | 16.38±3.41a | 11.90±7.19a |
| 中重度AD组 | 40 | 8.45±7.74ab | 4.19±5.37ab |
| F 值 | 931.15 | 866.91 | |
| P 值 | 0.00 | 0.00 | |
| 注:a为与正常对照组比较,P < 0.01;b为与轻度AD组比较,P < 0.01 | |||
3组受试者尿AD7c-NTP含量比较,差异均有统计学意义(P < 0.01)。与正常对照组比较,轻度与中重度AD组患者尿AD7c-NTP含量增加,差异有统计学意义(P < 0.01);与轻度AD组比较,中重度AD组患者尿AD7c-NTP含量增加,差异具有统计学意义(P < 0.05)。见表 2。
| 组别 | 例数 | 尿AD7c-NTP含量/(ng/mL) |
| 对照组 | 40 | 0.88±0.69 |
| 轻度AD组 | 40 | 2.11±1.98a |
| 中重度AD组 | 40 | 2.94±1.54ab |
| F 值 | 31.85 | |
| P 值 | 0.00 | |
| 注:a为与正常对照组比较,P < 0.01;b与轻度AD组比较,P < 0.05 | ||
3组受试者血浆Hcy含量比较,差异均有统计学意义(P < 0.01)。与正常对照组比较,轻度与中重度AD组患者血浆Hcy含量增加,差异有统计学意义(P < 0.01);与轻度AD组比较,中重度AD组患者血浆Hcy含量增加,差异具有统计学意义(P < 0.01)。见表 3。
| 组别 | 例数 | Hcy含量/(μmol/L) | |
| 对照组 | 40 | 11.12±8.65 | |
| 轻度AD组 | 40 | 18.55±8.78a | |
| 中重度AD组 | 40 | 27.31±8.75ab | |
| F 值 | 0.00 | 25.94 P 值 | |
| 注:a为与正常对照组比较,P < 0.01;b为与轻度AD组比较,P < 0.01 | |||
将轻度及中重度AD患者归为AD组,对正常对照组及AD组行ROC曲线分析示,尿液AD7c-NTP含量及血浆HCY含量诊断AD的AUC分别为0.830(95%可信区间为0.756~0.905)、0.755(95%可信区间为0.650~0.860)。尿液AD7c-NTP含量以1.745 ng/mL为最佳阈值,其诊断AD的敏感度为70%,特异度为87.5%。血浆HCY含量以15.05 μmol/L为最佳阈值,其诊断AD的敏感度为72.5%,特异度为70%。采用二分类logistic回归法,联合尿液AD7c-NTP含量及血液HCY含量构建回归模型,其诊断AD的ROC曲线下面积为0.891(95%可信区间为0.829~0.953),大于单一指标诊断AD的AUC。见图 1。
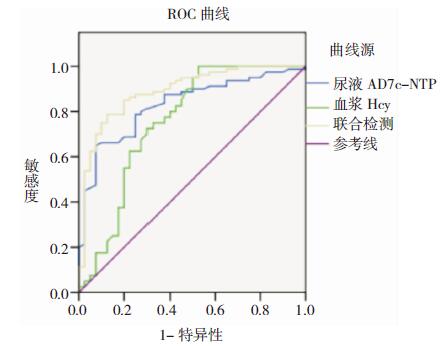
|
| 图 1 尿液AD7c-NTP含量、血浆HCY含量单独检测及联合检测诊断AD的ROC曲线分析 |
新的AD诊断标准中,生物标记物的检测具有重要的意义[7]。目前公认的AD的生物标记物为脑脊液中的Aβ和tau蛋白[2],但因其需要取脑脊液标本,具有创伤性,患者接受性较差,很大程度的限制了临床的应用。
AD7c-NTP是一种分子量为41 kD的跨膜磷蛋白,主要在神经元中表达,定位于神经细胞的轴突,并且在AD患者脑内选择性增高[8]。Goodman等[9]通过对AD患者和非AD患者尿样中AD7c-NTP的含量进行对比研究发现,AD组患者尿AD7c-NTP的含量显著高于非AD痴呆组及正常对照组。国内也有相关研究发现[3],AD患者的脑组织、脑脊液和尿液中AD7c-NTP含量均有增加,其对AD早期诊断具有较高的敏感性和特异性;且含量与AD的严重程度相关[10]。有研究通过ELISA方法发现[11],当取1.5 ng/mL作为cut-off值时,其敏感性和特异性分别为89.3%、84.7%。有学者通过对22例轻中度AD和8例MCI患者进行MMSE、NPI测评,并进行Pib-PET检查及尿AD7c-NTP测定后研究认为,尿AD7c-NTP在预测阿尔茨海默病患者脑内Pib沉积方面具有高的特异性和中等的敏感性,且尿AD7c-NTP的含量和患者的激越具有较强的相关性[2]。AD7c-NTP在AD中的具体作用机制尚需不明确。有研究表明,AD患者AD7c-NTP表达水平的增加可能与其介导AD神经退行性变化中细胞凋亡级联反应有关,脑组织中AD7c-NTP的免疫反应主要发生在退行性神经元、营养不良的轴突和神经纤维网等磷酸tau蛋白呈阳性的区域,其可能参与了tau蛋白的累积过程,进而产生神经元纤维缠结[12],而与Aβ的沉积无关。本研究通过对正常对照组、轻度AD及中重度AD组受试者进行尿AD7c-NTP含量检测,结果各组间差异有统计学意义。对正常对照组及AD组行ROC曲线分析示,尿液AD7c-NTP值诊断AD的AUC为0.830(95%可信区间为0.756~0.905)。提示尿液中AD7c-NTP可作为AD辅助诊断的一个有价值的生物标志物。
HCY是一种含硫氨基酸,参与体内多种能量代谢及甲基化反应[13]。近年来有研究表明,高HCY血症是AD的一个重要的独立危险因素,并且血浆HCY水平与疾病严重程度呈正相关[14]。一项荟萃分析显示[15],血液中HCY浓度越高,患AD的风险越高;血液中HCY每增加5 μmol/L,患AD相对风险增加15%,呈线性关系。本研究通过对上述3组受试者进行血浆HCY含量检测,结果提示各组差异均具有统计学意义。血浆HCY值诊断AD的AUC为0.755(95%可信区间为0.650~0.860),提示血浆Hcy可作为AD辅助诊断的生物标志物。
本研究进一步对受试者进行尿AD7c-NTP及血浆HCY的联合检测,研究显示:采用二分类logistic回归法,联合尿液AD7c-NTP值及血液HCY值构建回归模型,其诊断AD的ROC曲线下面积为0.891(95%可信区间为0.829~0.953),大于单一指标诊断AD的AUC。故二者联合作为诊断AD的生物标志物,具有更为重要的价值。
本研究选择的两个标志物均较为被患者接受,利于临床开展;但因本研究纳入的样本量偏小,且没有进一步深入研究两个指标在AD的发生发展中的具体机制,故尚需我们进一步进行大样本、更为深入的研究以进一步明确其在AD诊断中的价值。
| [1] |
Prince M, Comas-Herrera A, Knapp M, et al. World Alzheimer report 2016: improving healthcare for people living with dementia: coverage, quality and costs now and in the future[EB/OL].[访问日期]. https://www.alz.co.uk/research/WorldAlzheimerReport2016.pdf.
|
| [2] |
刘东明, 易芳, 许宏伟, 等. 低密度脂蛋白受体相关蛋白1基因多态性与中国人阿尔茨海默病发病风险的meta分析[J]. 国际神经病学神经外科学杂志, 2019, 46(5): 509-514. |
| [3] |
Ma L, Wang R, Han Y, et al. Development of a novel urine Alzheimer-associated neuronal thread protein ELISA kit and its potential use in the diagnosis of Alzheimer's disease[J]. J Clin Lab Anal, 2016, 30(4): 308-314. DOI:10.1002/jcla.21856 |
| [4] |
Lin L, Du H. An anthraquinone compound and its protective effects against homocysteine-induced cytotoxicity and oxidative stress[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2018, 202: 314-318. DOI:10.1016/j.saa.2018.05.058 |
| [5] |
Negahdar H, Hosseini SR, Parsian H, et al. Homocysteine, trace elements and oxidant/antioxidant status in mild cognitively impaired elderly persons:a cross-sectional study[J]. Rom J Intern Med, 2015, 53(4): 336-342. |
| [6] |
McKhann G, Drachman D, Folstein M, et al. Clinical diagnosis of Alzheimer's disease:report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's disease[J]. Neurology, 1984, 34(7): 939-944. DOI:10.1212/WNL.34.7.939 |
| [7] |
Dubois B, Feldman HH, Jacova C, et al. Advancing research diagnostic criteria for Alzheimer's disease:the IWG-2 criteria[J]. Lancet Neurol, 2014, 13(6): 614-629. DOI:10.1016/S1474-4422(14)70090-0 |
| [8] |
Munzar M, Levy S, Rush R, et al. Clinical study of a urinary competitve ELISA for neural thread protein in Alzheimer disease[J]. Neurol Clin Neurophysiol, 2002, 2002(1): 2-8. |
| [9] |
Goodman I, Golden G, Flitman S, et al. A multi-center blinded prospective study of urine neural thread protein measurements in patients with suspected Alzheimer's disease[J]. J Am Med Dir Assoc, 2007, 8(1): 21-30. DOI:10.1016/j.jamda.2006.07.002 |
| [10] |
王蓉, 姬志娟, 盛树力, 等. 阿尔茨海默病尿神经丝蛋白检测方法的建立及其临床意义[J]. 中华检验医学杂志, 2010, 33(1): 46-50. |
| [11] |
Ma L, Wang R, Han Y, et al. Development of a novel urine Alzheimer-Associated neuronal thread protein ELISA kit and its potential use in the diagnosis of Alzheimer's disease[J]. J Clin Lab Anal, 2016, 30(4): 308-314. DOI:10.1002/jcla.21856 |
| [12] |
方堃, 张玉蓉, 王芳, 等. 尿AD7c-NTP联合尿甲醛、血清S100B在AD早期诊断中的价值及与认知水平的相关性[J]. 实用医学杂志, 2019, 35(1): 113-116, 121. |
| [13] |
Tian S, Han J, Huang R, et al. Increased plasma homocysteine level is associated with executive dysfunction in type 2 diabetic patients with mild cognitive impairment[J]. J Alzheimers Dis, 2017, 58(4): 1163-1173. DOI:10.3233/JAD-170162 |
| [14] |
Li JG, Barrero C, Gupta S, et al. Homocysteine modulates 5-lipoxygenase expression level via DNA methylation[J]. Aging Cell, 2017, 16(2): 273-280. DOI:10.1111/acel.12550 |
| [15] |
Zhou F, Chen S. Hyperhomocysteinemia and risk of incident cognitive outcomes:an updated dose-response meta-analysis of prospective cohort studies[J]. Ageing Res Rev, 2019, 51: 55-66. DOI:10.1016/j.arr.2019.02.006 |
 2020, Vol. 47
2020, Vol. 47




