扩展功能
文章信息
- 王小林, 邵宏敏
- WANG Xiao-Lin, SHAO Hong-Min
- miR-124在血管性痴呆患者血清中表达差异及其意义
- Difference in serum expression of miRNA-124 in patients with vascular dementia and its significance
- 国际神经病学神经外科学杂志, 2020, 47(5): 489-493
- Journal of International Neurology and Neurosurgery, 2020, 47(5): 489-493
-
文章历史
收稿日期: 2020-01-10
修回日期: 2020-09-18
血管性痴呆(vascular dementia, VD)常常会演变成阿尔茨海默病,因此,对VD的早期诊断及预防具有重要意义[1]。VD根据病理及病因可分为大面积脑梗死痴呆、多发性腔隙性脑梗死痴呆、多梗死痴呆等[2]。VD的诊断要结合患者的体征和影像学检查等,还需排除其他的可能病因[3]。VD与变性病痴呆不同,前者发病较为突然,且会伴随脑血管事件的发生,而后者发病则较为缓慢[4]。
microRNA(miRNA)是一类非编码RNA,由20~25个核苷酸组成[5]。近年来有研究显示[6],miRNA参与多种脑血管疾病的调控,包括血管血栓的形成、动脉粥样硬化、脑缺血再灌注等,而上述脑血管疾病则是VD的主要病因,所以miRNA与VD也具有相关性。研究指出[7],miRNA与VD有关,miRNA通过刺激神经元及炎症的发生,导致细胞的凋亡及氧化应激,从而影响生物体的记忆。脑缺血缺氧时,大脑中有多种miRNA的表达产生改变,其中以miR-124的表达量最高。本文拟探讨血管性痴呆患者外周血miRNA的表达水平及其意义。
1 对象与方法 1.1 研究对象选取2018年1月至2019年5月我院收治的血管性痴呆患者68例纳为观察组,再选择体检结果显示健康的患者50例纳为对照组。
纳入标准[8]:①符合血管性痴呆的诊断:认知功能(如言语、注意力、记忆力等)明显下降;②证实患者脑血管疾病发生3个月之内出现认知障碍;③简易智力状态检查量表(Mini-mental State Examination, MMSE)评分 < 27分;(4) Hachinski缺血指数量表(Hachinski Ischemic Scale, HIS)评分>7分。
排除标准[9]:①确诊为其他原因的痴呆、抑郁症患者或精神障碍患者;②患有严重的颅脑损伤;③患有癫痫、帕金森等疾病的患者;④患有严重的心、肝、肾等脏器疾病的患者;⑤患有恶性肿瘤、甲状腺功能异常或严重贫血的患者。
该实验已通过本院医学伦理委员会批准(批准号:HBTSFR20170218)。患者及家属均签署相关知情同意书。
1.2 主要试剂与仪器Trizol试剂盒、反转录试剂盒(PrimeSeriptTM RT reagent Kit)、SYBR Green实时荧光定量PCR试剂盒(2×SYBR Premix Ex TaqTM II)为日本Takara公司产品。氯仿、异丙醇及75%乙醇等均为国产分析纯试剂。氯化三苯基四氮唑(TTC)购自美国Amresco公司。琼脂糖购自上海增健生物科技有限公司。梯度PCR仪(Bio.tad公司,美国)。实时定量(Real time)PCR仪(ABI 7500,美国)。超低温冰箱(Thermo公司,美国)。低温高速离心机(Heraeus,德国)。
1.3 研究方法 1.3.1 治疗方法参照2016年修订的《中国脑血管病防治指南》对患者进行相关的治疗[10]:①采用个体化的方法对患者进行治疗,并将患者的血压调整至正常范围内;②为防止血小板凝集,患者口服阿司匹林(0.1 g/d);③使患者口服胞二磷胆碱以营养神经;④给予患者康复治疗及认知训练;⑤给予患者营养支持;⑥对患者进行对症治疗并防治并发症。
1.3.2 抽血及miRNA的提取[11-12]治疗前,对每一位研究对象抽取3 mL外周血;治疗后3个月,对观察组抽取3 mL外周血。取0.3 mL,3000 r/min离心分离血浆。采用TRlzol法,利用mirVanaPARISmiRNA提取试剂盒进行miRNA提取,进行反转录则使用TaqManmiRNA反转录试剂盒进行,最后使用TaqManmiRNA检测试剂盒,采用RT-PCR检测miR-124的表达。以U6为内参,miR-124正向引物为5'-GCTAAG-GCACGCGGTG-3',反向引物为设计引物5'-GTGCAGGTC-CGAGGT-3';以内参U6,正向引物为5'-CTCGCTTCGGCAGCACA-3',反向引物为5'-AACGCTTCACGAATTTGCGT-3'。通过计算-ΔCt以获得miRNA的相对表达,ΔCt=CtmiRNA-Ctu6。
1.4 观察指标治疗前,miR-124的相对表达水平与对照组进行对比;治疗后3个月,miR-124的相对表达水平与治疗前进行对比。治疗3个月后,患者症状明显好转且无不良事件出现,即为治疗效果良好,纳入良好组;患者症状无明显好转或出现不良事件,即为治疗效果不良,纳入不良组。
1.5 统计学方法采用SPSS 21.0统计学软件处理研究数据。计数资料用例(%)表示,组间比较采用χ2检验;计量资料用均数±标准差(x±s)表示,组间比较采用成组t检验或配对t检验。通过绘制ROC曲线来评价miR-124的诊断效能。当P < 0.05,表示差异具有统计学意义。
2 结果 2.1 一般资料比较观察组与对照组在性别、年龄及受教育年限上差异无统计学意义(P>0.05)。见表 1。
| 项目 | 观察组(n=68) | 对照组(n=50) | t/χ2 值 | P 值 |
| 性别(男/女) | 36/32 | 26/24 | 0.010 | 0.919 |
| 年龄/岁 | 68.19±9.32 | 68.56±10.23 | 0.451 | 0.763 |
| 受教育年限/年 | 8.62±1.03 | 8.73±0.45 | 0.423 | 0.789 |
治疗前miR-124的相对表达水平观察组高于对照组,差异有统计学意义(P < 0.005)。观察组治疗3个月后患者的miR-124的相对表达水平较治疗前低,差异有统计学意义(P < 0.015)。见表 2。
| 组别 | 例数 | 治疗前 | 治疗3个月后 | t 值 | P 值 |
| 观察组 | 68 | 2.56±0.23 | 1.56±0.09 | 2.553 | 0.015 |
| 对照组 | 50 | 1.03±0.31 | |||
| t 值 | 2.903 | ||||
| P 值 | 0.005 |
良好组和不良组在年龄、性别、体重上差异无统计学意义(P>0.05);而在高血压、高血脂及miR-124上差异有统计学意义(P < 0.05)。见表 3。
| 项目 | 良好组(n=57) | 不良组(n=11) | t/χ2 | P 值 |
| 年龄/岁 | 60.13±6.59 | 61.78±6.23 | 0.139 | 1.208 |
| 性别 | ||||
| 男 | 29(50.88) | 7(63.64) | 0.603 | 0.438 |
| 女 | 28(49.12) | 4(36.36) | ||
| 体重指数 | ||||
| < 25 kg/m2 | 45(78.95) | 6(54.55) | 2.928 | 0.087 |
| ≥25 kg/m2 | 12(21.05) | 5(45.45) | ||
| 高血压 | ||||
| 有 | 22(38.60) | 8(72.73) | 4.357 | 0.037 |
| 无 | 35(61.40) | 3(27.27) | ||
| 高血脂 | ||||
| 有 | 24(42.11) | 9(72.73) | 5.822 | 0.016 |
| 无 | 33(57.89) | 2(27.27) | ||
| 治疗前miR-124 | 2.55±0.21 | 2.57±0.27 | 0.478 | 0.632 |
| 治疗后miR-124 | 1.47±0.56 | 2.49±0.13 | 3.564 | 0.015 |
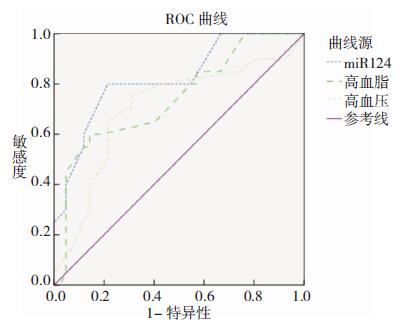
根据2.3的结果,做高血脂、高血压及血清miR-124相对表达水平在预测血管性痴呆患者治疗后预后的ROC曲线分析,高血脂在预测血管性痴呆患者治疗后预后的AUC曲线面积为0.742,高血压在预测血管性痴呆患者治疗后预后的AUC曲线面积为0.705,血清miR-124相对表达水平在预测血管性痴呆患者治疗后预后的AUC曲线面积为0.821(图 1)。以最大约登指数计算得出最大AUC面积相应参数截止值,高血脂为5.220(敏感度=60.00%,特异性=85.70%);高血压为1.965(敏感度=75.00%,特异性=69.00%);血清miR-124相对表达水平为4.225(敏感度=80.00%,特异性=78.60%)。
|
| 图 1 血管性痴呆患者治疗后预后ROC曲线 |
| 因素 | AUC | 临界值 | 灵敏度/% | 特异度/% | 95%CI | P 值 |
| 高血脂 | 0.742 | 5.220 | 60.00 | 85.70 | 0.606~0.877 | 0.002 |
| 高血压 | 0.705 | 1.965 | 75.00 | 69.00 | 0.557~0.854 | 0.009 |
| miR-124相对表达水平 | 0.821 | 4.225 | 80.00 | 78.60 | 0.706~0.936 | 0.000 |
痴呆主要特征表现为智能的缓慢减退,虽然无意识障碍,但可能伴有不同程度的人格改变[13]。引起痴呆的原因有中枢系统疾病、肝脏疾病、肾脏疾病、脑血管疾病等,而VD属于脑血管疾病引发的痴呆,表现为认知功能的损伤,并且伴有局灶性神经系统损伤[14-15]。近年来,VD患者数量不断上升,其发病机制尚无确切共识,这是治疗VD的障碍之一[16]。VD目前只能够用药物进行控制,而在进行治疗时,也会有一些因素影响疗效[17]。有研究显示[18],miRNAs与脑神经的发育、脑细胞的发育及突触的功能有极大的关系,miRNAs的变化可能会造成脑缺血或者缺氧。miR-124作为脑部特异性的miRNA,在脑部的发育及神经的调控中发挥着重要作用,miR-124的相对表达水平可能与VD治疗的疗效有关[19]。
本研究中,治疗前miR-124的相对表达水平观察组高于对照组,治疗3个月后观察组的miR-124的相对表达水平较治疗前低。由此可见,血管性痴呆的发生与患者外周血miR-124的相对表达水平升高有关。将治疗3个月后的患者按恢复程度分为良好组和不良组,良好组和不良组在高血压、高血脂及miR-124上差异有统计学意义,提示不良组的高血压、高血脂比例更高,miR-124水平更高。ROC曲线分析发现,在预测血管性痴呆患者治疗后预后时,高血脂敏感度为60.00%,特异性为85.70%;高血压敏感度为75.00%,特异性为69.00%;血清miR-124相对表达水平敏感度为80.00%,特异性为78.60%。
由此可见,对患者进行治疗后,患者miR-124相对表达水平虽然有所下降,但却还是未能达到正常水平,可能与VD这一疾病的不可治愈性有关,故miR-124的表达水平显著高于正常人,故即使接受治疗后,VD患者的miR-124的表达水平仍高于正常。
有研究显示[20],miR-124大量表达时,可以通过减少相关炎症因子的表达、对脑细胞的凋亡进行抑制等途径对脑神经与脑细胞进行保护。因此,我们可以猜测,当患者出现VD时,miR-124表达水平的升高,可认为是机体对于大脑的一种保护。而文中又发现高血压及高血脂也是影响VD预后的重要预测指标,对此,在治疗的过程中,可根据VD患者miR-124表达水平的测定结果,及时更改治疗方式,及时控制患者治疗过程不良因素的发生,提高其治疗效果。
综上所述,miR-124表达水平可作为VD患者预后不良的一个重要指标,对监测VD患者的治疗效果具有重要意义,但因患者个体原因及患者例数等因素的影响,此研究还需要进一步进行完善。
| [1] |
马宗艳, 蔡宏斌, 裴丽娟, 等. 血清晚期糖基化终末产物和可溶性晚期糖基化终末产物受体与阿尔茨海默病及血管性痴呆关系的研究[J]. 国际神经病学神经外科学杂志, 2019, 46(1): 55-59. |
| [2] |
Wolters FJ, Ikram MA. Epidemiology of vascular dementia[J]. Arterioscler Thromb Vasc Biol, 2019, 39(8): 1542-1549. DOI:10.1161/ATVBAHA.119.311908 |
| [3] |
Strandberg TE, Tienari PJ. Contributions of vascular and Alzheimer's disease pathology to dementia[J]. Alzheimers Dement, 2019, 15(7): 1004-1005. DOI:10.1016/j.jalz.2019.04.004 |
| [4] |
Yao P, Li Y, Yang Y, et al. Triptolide improves cognitive dysfunction in rats with vascular dementia by activating the SIRT1/PGC-1α signaling pathway[J]. Neurochem Res, 2019, 44(8): 1977-1985. DOI:10.1007/s11064-019-02831-3 |
| [5] |
Andrade GM, Bomfim MM, Del Collado M, et al. Oxygen tension modulates extracellular vesicles and its miRNA contents in bovine embryo culture medium[J]. Mol Reprod Dev, 2019, 86(8): 1067-1080. DOI:10.1002/mrd.23223 |
| [6] |
Swarbrick S, Wragg N, Ghosh S, et al. Systematic review of miRNA as biomarkers in Alzheimer's disease[J]. Mol Neurobiol, 2019, 56(9): 6156-6167. DOI:10.1007/s12035-019-1500-y |
| [7] |
詹莹, 安红伟. miRNA与血管性痴呆的研究进展[J]. 东南大学学报(医学版), 2019, 38(2): 376-379. DOI:10.3969/j.issn.1671-6264.2019.02.033 |
| [8] |
陈粤瑛, 宋晓楠, 杨树龙. 炎症相关因子在血管性痴呆发病机制中的作用[J]. 中国生物化学与分子生物学报, 2019, 35(7): 693-699. |
| [9] |
拜承萍, 铁婷婷. HMGB1、MIF和TNF-α在血管性痴呆患者血清中的表达及价值分析[J]. 国际检验医学杂志, 2019, 40(13): 1615-1618. |
| [10] |
张艳军, 吴大伟. 血管性痴呆危险因素的研究进展[J]. 中国城乡企业卫生, 2018, 33(6): 43-45. |
| [11] |
陈南耀, 余丹. 联合检测血清miR-124与miR-182的表达水平对急性脑梗死诊断与预后评估的价值[J]. 中国动脉硬化杂志, 2019, 27(6): 502-506. DOI:10.3969/j.issn.1005-8982.2020.02.005 |
| [12] |
谢尊椿, 刘彬, 周美鸿, 等. 急性缺血性脑卒中患者血浆miR-124表达变化及其意义[J]. 实用医学杂志, 2019, 35(3): 343-345. DOI:10.3969/j.issn.1006-5725.2019.03.002 |
| [13] |
Turana Y, Tengkawan J, Chia YC, et al. Hypertension and dementia:a comprehensive review from the HOPE Asia Network[J]. J Clin Hypertens (Greenwich), 2019, 21(8): 1091-1098. DOI:10.1111/jch.13558 |
| [14] |
常光明, 陈潇, 耿鑫. 高迁移率族蛋白B1在血管性痴呆中的炎性作用机制及研究进展[J]. 国际检验医学杂志, 2019, 40(15): 1893-1896. |
| [15] |
Lim KB, Kim J, Lee HJ, et al. COWAT performance of persons with Alzheimer dementia, vascular dementia, and Parkinson disease dementia according to stage of cognitive impairment[J]. PMR, 2019, 11(7): 737-744. |
| [16] |
廖张元. 血管性痴呆的研究进展[J]. 中国实用神经疾病杂志, 2019, 22(2): 224-227. |
| [17] |
Scheepers LEJM, Jacobsson LTH, Kern S, et al. Urate and risk of Alzheimer's disease and vascular dementia:a population-based study[J]. Alzheimers Dement, 2019, 15(6): 754-763. DOI:10.1016/j.jalz.2019.01.014 |
| [18] |
王雪清, 李文新. miRNA在乳腺癌中的研究进展[J]. 疾病监测与控制, 2019, 13(4): 301-304, 316. |
| [19] |
Zhao B, Lu Y, Cao X, et al. MiRNA-124 inhibits the proliferation, migration and invasion of cancer cell in hepatocellular carcinoma by downregulating lncRNA-UCA1[J]. Onco Targets Ther, 2019, 12: 4509-4516. DOI:10.2147/OTT.S205169 |
| [20] |
谢民, 李社芳, 邢海燕, 等. miR-124靶向调控STAT3调节动脉粥样硬化中血管内皮细胞的生物学特性[J]. 中国老年学杂志, 2019, 39(1): 161-165. |
 2020, Vol. 47
2020, Vol. 47




