扩展功能
文章信息
- 赵宗清, 赵志明, 陈海欣, 冯帆, 衡雪源
- ZHAO Zong-Qing, ZHAO Zhi-Ming, CHEN Hai-Xin, FENG Fan, HENG Xue-Yuan
- CUX-1和XRCC3在胶质瘤中的表达及其与预后的关系
- Expression of homeobox protein cut-like 1 and X-ray repair cross-complementing group 3 in glioma and its association with prognosis
- 国际神经病学神经外科学杂志, 2020, 47(5): 463-468
- Journal of International Neurology and Neurosurgery, 2020, 47(5): 463-468
-
文章历史
收稿日期: 2020-07-10
修回日期: 2020-08-25
2. 临沂市人民医院神经外科, 山东 临沂 276000
2. Department of Neurosurgery, Linyi People's Hospital, Linyi, Shandong 276000, China
胶质瘤是常见的颅内原发恶性肿瘤之一,约占成人颅内肿瘤的46.6%,且具有高侵袭特性[1-2]。胶质瘤患者尤其是胶质母细胞瘤(GBM,按WHO中胶质瘤的分级标准Ⅳ级)患者的中位生存期仅为14.6个月[3-4]。转录调节因子CUX-1为同源异型盒(homeobox)家族成员之一[5-6]。已有文献证明CUX-1通过调节纺锤体装配检测点在DNA复制过程中发挥了重要的调控作用,同时其还参与了细胞在应激条件下发生的DNA损伤修复过程[7]。XRCC3作为同源重组修复基因RAD51类似物,已有体内实验证明其介导的同源重组修复(HHR)过程在修复放疗诱导的肿瘤细胞DNA双链损伤(DSBs)中至关重要[8-9]。然而,目前关于CUX-1与XRCC3在胶质瘤增殖方面的作用并无相关报道,鉴于CUX-1与XRCC3所介导相似的DNA损伤修复功能,笔者推测两者在胶质瘤的发生及增殖方面发挥了协同作用。故本研究检测不同级别胶质瘤标本中CUX-1与XRCC3的表达情况及其与患者病理指标及预后的关系。
1 资料和方法 1.1 一般资料随机收取2014年6月—2016年12月临沂市人民医院神经外科接受外科手术切除的66例脑胶质瘤组织标本(病理检查确诊)为实验组。10例正常脑组织标本由颅脑外伤患者额叶减压手术中获取的,设为对照组。纳入的样本随访资料完整。标本切片由2名病理诊断师按照《中国中枢神经系统胶质瘤诊断与治疗指南2015版》[10]标准进行再次确诊。研究获得患者与其家属知情同意,已签署知情同意书。本研究得到了我院医学伦理委员会的批准。
1.2 Western-blotting检测CUX-1和XRCC3含量取实验组及对照组组织匀浆后提取总蛋白,使用二喹啉甲酸(BCA)法测定其蛋白浓度。常规电泳,转膜,封闭后加入CUX-1一抗抗体(1 :2000;武汉三鹰公司)。4℃静置过夜。洗膜,辣根酶标二抗(1 :2500;美国Cell signaling公司)置室温1 h,PBST洗膜3次,吸取等量ECL超灵敏型检测试剂盒A液、B液,均匀滴于PVDF膜上进行化学发光显影,用Quantity One (version 4.6)分析软件计算CUX-1蛋白的表达水平。XRCC3实验步骤同CUX-1,XRCC3一抗抗体(1 :2000;武汉三鹰公司)。分别以CUX-1/XRCC3与GAPDH的比值作为该标本的相对表达量。
1.3 免疫组织化学(以下简称免疫组化)检测CUX-1、XRCC3、P53、Ki67的相对表达量我们对实验组及对照组标本分别进行CUX-1、XRCC3、P53、Ki67免疫组化染色。将实验组及对照组组织石蜡包埋,切片(4 μm),70℃烘干45m in,常规水化后,进行抗原修复。滴加过氧化物酶阻断剂(中国中杉金桥公司),PBS冲洗,5%正常山羊血清静置10 min,一抗(CUX-1,1 :400,美国Abcam公司;XRCC3,1 :400,美国Cellsignaling公司;P53、Ki67,1 :500,中国中杉金桥公司),4℃孵育过夜后PBS冲洗,滴二抗(1 :2500,美国Affinity公司)1 h。加入新鲜配制DAB进行显色。苏木素染色20 s,盐酸分化后冲洗,氨水返蓝,依次使用酒精梯度脱水,透明标本后进行封片处理。设立阴性对照组,使用同等剂量的PBS替代一抗进行实验,实验步骤同上。免疫组化分析和评分由2名病理诊断师独立完成,以细胞质和/或细胞核中呈现棕黄色颗粒物作为诊断标准。最终分数由染色强度(+~+++)及阳性细胞数(0%~100%)综合评定。结合国际期刊相关文献引用的评分方法[5],综合评分标准如下:评分0分(阴性);评分2分(++,< 10%);评分3分(+,>50);评分4分(++,< 50%);评分5分(++,>50%);评分6分(++++,100%)。我们将评分≤4分定义为低CUX-1/XRCC3表达组,而评分>4分作为高CUX-1/XRCC表达组。
1.4 随访采用电话及门诊复查等方式进行随访,随访截止时间2019年6月30日。总生存期(overall survival,OS)为手术时间至最后随访日或死亡时间,以月份为单位计算。
1.5 统计学方法数据采用SPSS 19.0及GraphPad Prism 7软件分析。计量资料采用均数±标准差(x±s)表示,比较采用t检验;计数资料采用例(%)表示,比较采用χ2检验或秩和检验;采用Kaplan-Meier法评估生存率,组间生存率曲线分布检验采用Log-Rank法。相关性检验采用Spearman等级进行相关分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 CUX-1与XRCC3在胶质瘤组织中的表达情况分析免疫组织化学染色结果,发现CUX1及XRCC3在实验组标本表达存在差异,在高级别胶质瘤(WHO Ⅲ、Ⅳ)组中的表达高于低级别胶质瘤(WHOⅠ、Ⅱ)组,且在对照组中CUX-1及XRCC3阳性细胞数最少(图 1A、B)。Western-blotting检测结果,进一步验证了免疫组化结果(图 1C、D)。CUX-1高表达占正常脑组织样本的10.0%,XRCC3高表达占20.0%;CUX-1高表达占低级别胶质瘤组(WHOⅠ、Ⅱ)样本的33.3%,XRCC3高表达占27.2%;而CUX-1高表达占高级别胶质瘤组(WHO Ⅲ、Ⅳ)样本的63.6%,XRCC3高表达占75.8%。高级别胶质瘤组中CUX-1与XRCC3的表达高于低级别胶质瘤组及正常脑组织,差异有统计学意义(P < 0.05)。见表 1。
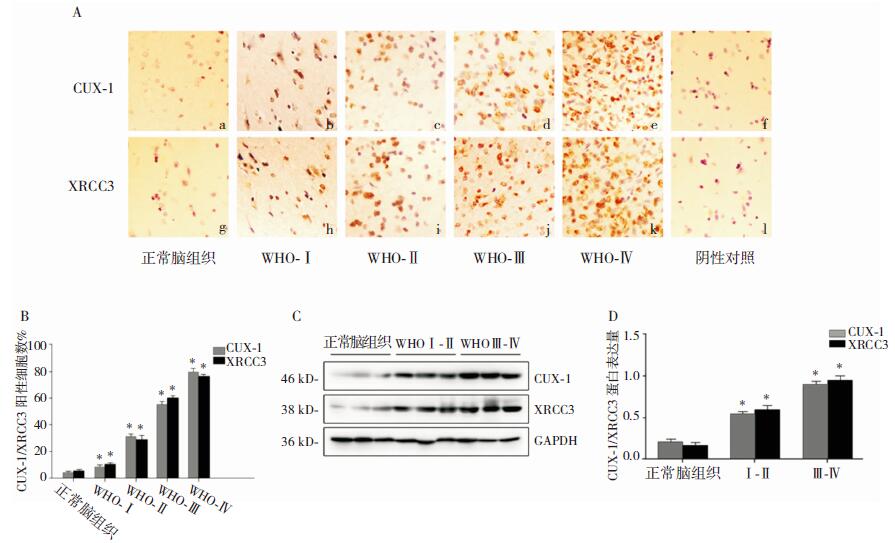
|
| A:CUX-1与XRCC3表达情况(免疫组化,×200);B:CUX-1与XRCC3阳性细胞数量化图;C、D:WHO I~IV级胶质瘤及非肿瘤标本中CUX-1与XRCC3的Western-blotting检测结果。*表示与正常脑组织比较,P < 0.05。 图 1 CUX-1与XRCC3在不同级别胶质瘤组织中的表达情况 |
| 组别 | 例数 | CUX1表达 | Z/P值 | XRCC3表达 | Z/P值 | ||||
| 阴性 | 低表达 | 高表达 | 阴性 | 低表达 | 高表达 | ||||
| 对照组 | 10 | 4 | 5 | 1 | 30.814/0.001 | 3 | 5 | 2 | 34.894/0.001 |
| 低级别胶质瘤组 (Grade Ⅰ、Ⅱ) |
33 | 5 | 17 | 11 | 5 | 19 | 9 | ||
| 高级别胶质瘤组 (Grade Ⅲ、Ⅳ) |
33 | 6 | 6 | 21 | 2 | 6 | 25 | ||
高表达的CUX-1及XRCC3均与胶质瘤WHO分级、肿瘤增殖指标Ki67及P53mut相关(P < 0.01),而与患者年龄、性别、肿瘤大小、肿瘤位置及KPS评分之间均无相关(P>0.05)。见表 2,图 2。
| 临床病理指标 | CUX1表达 | XRCC3表达 | |||||||
| 例数 | 低表达 | 高表达 | χ2/P值 | 例数 | 低表达 | 高表达 | χ2/P值 | ||
| 性别 | 1.460/0.227 | 0.095/0.758 | |||||||
| 男 | 34 | 22 | 12 | 35 | 16 | 19 | |||
| 女 | 32 | 16 | 16 | 31 | 13 | 18 | |||
| 年龄 | 0.203/0.652 | 0.790/0.374 | |||||||
| < 44岁 | 35 | 20 | 15 | 30 | 17 | 13 | |||
| ≥44岁 | 31 | 16 | 15 | 33 | 15 | 18 | |||
| 肿瘤直径 | 0.088/0.767 | 0.335/0.563 | |||||||
| < 4 cm | 16 | 9 | 7 | 19 | 11 | 8 | |||
| ≥4 cm | 50 | 26 | 24 | 47 | 21 | 26 | |||
| 肿瘤位置 | 0.708/0.702 | 0.076/0.963 | |||||||
| 额叶 | 30 | 19 | 11 | 31 | 15 | 16 | |||
| 颞叶 | 22 | 11 | 11 | 28 | 13 | 15 | |||
| 其他 | 14 | 5 | 9 | 7 | 3 | 4 | |||
| KPS | 2.184/0.139 | 3.229/0.072 | |||||||
| < 80分 | 33 | 13 | 20 | 30 | 12 | 18 | |||
| ≥80分 | 33 | 19 | 14 | 36 | 23 | 13 | |||
| WHO分级 | 7.279/0.007 | 12.737/0.001 | |||||||
| WHOⅠ、Ⅱ | 33 | 20 | 13 | 28 | 22 | 6 | |||
| WHOⅢ、Ⅳ | 33 | 11 | 22 | 38 | 13 | 25 | |||
| Ki67 | 11.438/0.001 | 8.629/0.003 | |||||||
| 低表达 | 25 | 18 | 7 | 27 | 15 | 12 | |||
| 高表达 | 41 | 12 | 29 | 39 | 8 | 31 | |||
| P53 mut | 12.649/0.001 | 6.873/0.009 | |||||||
| 高表达 | 41 | 23 | 18 | 36 | 27 | 9 | |||
| 低表达 | 25 | 3 | 22 | 30 | 13 | 17 | |||
| KPS:功能状态评分,Ki67/P53mut:胶质瘤增殖指标 | |||||||||
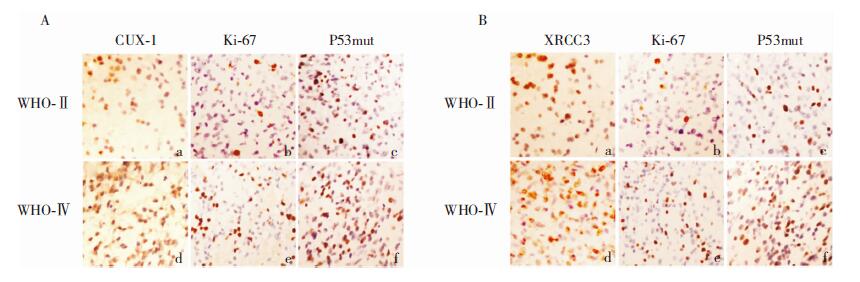
|
| A:CUX-1和增殖指标Ki67、P53mut在低级别胶质瘤(a~c)及高级别胶质瘤中(d~f)的表达(×200);B:XRCC3、增殖指标Ki67、P53mut在低级别胶质瘤(a~c)及高级别胶质瘤中(d~f)的表达(×200)。 图 2 CUX-1、XRCC3与增殖指标Ki67、P53mut的表达 |
胶质瘤组织中CUX-1与XRCC3蛋白表达呈正相关(rs=0.773,P=0.002)。见图 3。
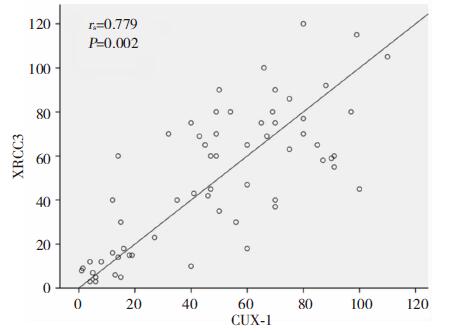
|
| 图 3 XRCC3与CUX-1的相关性 |
XRCC3高表达组患者生存时间短于低表达组(Log Rank χ2=7.005,P=0.008);CUX-1高表达组患者生存时间短于低表达组(Log Rank χ2=4.981,P=0.026)。见图 4。
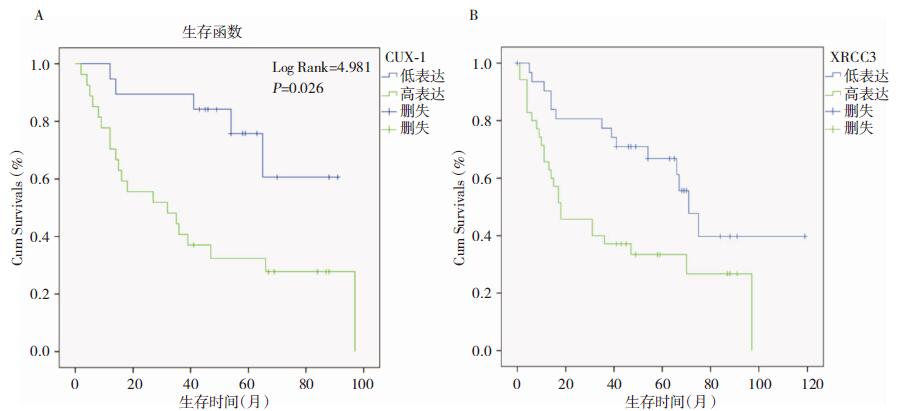
|
| A CUX-1;B XRCC3。 图 4 Kaplan-Meier生存曲线分析 |
胶质瘤是神经系统内最常见的恶性肿瘤,手术后的替莫唑胺(TMZ)辅助化疗已成为胶质母细胞瘤的标准治疗方案,但新确诊的GBM患者中位生存期仅14.6个月[11]。如何鉴别高级别胶质瘤对不同化疗药物的反应性已成为胶质瘤治疗的研究热点。更加完善的分子标志物诊断标准对个体化治疗的选择及患者临床预后的判断具有重要价值[10]。CUX1属于同源域转录因子家族。CUX1位于7q22区域,主要在成人的中枢神经系统(CNS)中表达[12-13],研究表明,高表达的CUX-1通过直接刺激OGG1 DNA糖基化酶的活性增加了DNA损伤修复能力,并且在氧化应激条件下仍然可以促进RAS转化细胞的增殖[14]。另外,CUX-1可在RNA、蛋白质和启动子水平上转录上调WNT5A,后者增强了胰腺癌细胞增殖和迁移的能力[15]。笔者推测CUX1在胶质瘤中的高表达,提示其可能在胶质瘤细胞增殖过程中发挥重要的作用。另一方面,目前关于XRCC3的研究主要集中在其DNA损伤修复功能方面,Loignon等的研究表明在乳腺癌MCF7细胞系中,XRCC3敲低可积累DNA损伤,最终发生P53依赖的细胞死亡,同时其团队也发现XRCC3与MCF7乳腺癌细胞的增殖密切相关[16]。因此,笔者推测CUX-1与XRCC3可通过DNA损伤修复途径参与胶质瘤的发生与发展。
已有文献证明CUX-1在多种肿瘤中可作为侵袭、增殖的生物标志物,如导管型胰腺癌、乳腺癌、黑色素瘤、直肠及结肠肿瘤等[17-18]。另外,关于XRCC3单核苷酸多态性Meta分析也表明XRCC3高表达可上调甲状腺癌、大肠癌的发病风险[19-20]。XRCC3基因的多态性可能与急性淋巴系白血病发病密切相关[21]。目前CUX-1与XRCC3在胶质瘤增殖方面暂无相关报道。本研究发现CUX-1与XRCC3胶质瘤中的表达上调,且CUX-1与XRCC3表达均随WHO分级升高而上调。CUX-1与XRCC3均与增殖性病理指标Ki67、P53mut相关(P < 0.01),表明其可能参与了胶质瘤细胞的增殖。此外,还发现CUX-1与XRCC3在胶质瘤中的表达存在正相关,表明两者在胶质瘤增殖过程中可能存在直接或间接的协同作用。最后,Kaplan-Meier生存曲线表明CUX-1高表达组及XRCC3高表达组的患者生存时间缩短。
因此,笔者认为CUX-1与XRCC3在胶质瘤中的表达与患者预后呈负相关,且在胶质瘤增殖过程中可能存在协同作用,CUX-1与XRCC3之间具体的调节机制有待于在下一步体内实验中进一步验证。CUX-1及XRCC3可作为潜在的胶质瘤预后标志物。
| [1] |
Ostrom QT, Gittleman H, Xu J, et al. CBTRUS statistical report:primary brain and other central nervous system tumors diagnosed in the United States in 2009-2013[J]. Neuro Oncol, 2016, 18(suppl_5): v1-v75. DOI:10.1093/neuonc/now207 |
| [2] |
Xu K, Pei H, Zhang Z, et al. FoxO3a mediates glioma cell invasion by regulating MMP9 expression[J]. Oncol Rep, 2016, 36(5): 3044-3050. DOI:10.3892/or.2016.5087 |
| [3] |
杨学军, 江涛. 解读《世界卫生组织中枢神经系统肿瘤分类(2016年)》[J]. 中国神经精神疾病杂志, 2016, 42(6): 321-329. |
| [4] |
Su C, Li H, Gao W. GLUT5 increases fructose utilization and promotes tumor progression in glioma[J]. Biochem Biophys Res Commun, 2018, 500(2): 462-469. |
| [5] |
Kaur S, Ramdzan ZM, Guiot MC, et al. CUX1 stimulates APE1 enzymatic activity and increases the resistance of glioblastoma cells to the mono-alkylating agent temozolomide[J]. Neuro Oncol, 2018, 20(4): 484-493. DOI:10.1093/neuonc/nox178 |
| [6] |
Sansregret L, Vadnais C, Livingstone J, et al. Cut homeobox 1 causes chromosomal instability by promoting bipolar division after cytokinesis failure[J]. Proc Natl Acad Sci U S A, 2011, 108(5): 1949-1954. DOI:10.1073/pnas.1008403108 |
| [7] |
Ramdzan ZM, Vadnais C, Pal R, et al. RAS transformation requires CUX1-dependent repair of oxidative DNA damage[J]. PLoS Biol, 2014, 12(3): e1001807. DOI:10.1371/journal.pbio.1001807 |
| [8] |
Takata M, Sasaki MS, Tachiiri S, et al. Chromosome instability and defective recombinational repair in knockout mutants of the five Rad51 paralogs[J]. Mol Cell Biol, 2001, 21(8): 2858-2866. DOI:10.1128/MCB.21.8.2858-2866.2001 |
| [9] |
Pierce AJ, Johnson RD, Thompson LH, et al. XRCC3 promotes homology-directed repair of DNA damage in mammalian cells[J]. Genes Dev, 1999, 13(20): 2633-2638. DOI:10.1101/gad.13.20.2633 |
| [10] |
《中国中枢神经系统胶质瘤诊断和治疗指南》编写组. 中国中枢神经系统胶质瘤诊断与治疗指南(2015)[J]. 中华医学杂志, 2016, 96(7): 485-509. |
| [11] |
Hao Z, Hu S, Liu Z, et al. Circular RNAs:functions and prospects in glioma[J]. J Mol Neurosci, 2019, 67(1): 72-81. DOI:10.1007/s12031-018-1211-2 |
| [12] |
Diodato A, Ruinart de Brimont M, Yim YS, et al. Molecular signatures of neural connectivity in the olfactory cortex[J]. Nat Commun, 2016, 7: 12238. DOI:10.1038/ncomms12238 |
| [13] |
Xu J, Li P. Expression of EAP1 and CUX1 in the hypothalamus of female rats and relationship with KISS1 and GnRH[J]. Endocr J, 2016, 63(8): 681-690. DOI:10.1507/endocrj.EJ16-0123 |
| [14] |
Ramdzan ZM, Pal R, Kaur S, et al. The function of CUX1 in oxidative DNA damage repair is needed to prevent premature senescence of mouse embryo fibroblasts[J]. Oncotarget, 2015, 6(6): 3613-3626. DOI:10.18632/oncotarget.2919 |
| [15] |
Ripka S, Riedel J, Neesse A, et al. Glutamate receptor GRIA3-target of CUX1 and mediator of tumor progression in pancreatic cancer[J]. Neoplasia, 2010, 12(8): 659-667. DOI:10.1593/neo.10486 |
| [16] |
Loignon M, Amrein L, Dunn M, et al. XRCC3 depletion induces spontaneous DNA breaks and p53-dependent cell death[J]. Cell Cycle, 2007, 6(5): 606-611. DOI:10.4161/cc.6.5.3923 |
| [17] |
Dianov GL, Hübscher U. Mammalian base excision repair:the forgotten archangel[J]. Nucleic Acids Res, 2013, 41(6): 3483-3490. DOI:10.1093/nar/gkt076 |
| [18] |
Cancer Genome Atlas Network, et al. Comprehensive molecular characterization of human colon and rectal cancer[J]. Nature, 2012, 487(7407): 330-337. DOI:10.1038/nature11252 |
| [19] |
Lu W, Wu G, Zhang B. Association between X-Ray cross-complementing group 3(XRCC3) Thr241Met polymorphism and risk of thyroid cancer:a meta-analysis[J]. Med Sci Monit, 2015, 21: 3978-3985. DOI:10.12659/MSM.895165 |
| [20] |
Namazi A, Abedinzadeh M, Nourbaksh P, et al. Association between the XRCC3 Thr241Met polymorphism and risk of colorectal cancer:a meta analysis of 5, 193 cases and 6, 645 controls[J]. Asian Pac J Cancer Prev, 2015, 16(6): 2263-2268. DOI:10.7314/APJCP.2015.16.6.2263 |
| [21] |
Pei JS, Chang WS, Hsu PC, et al. The contribution of XRCC3 genotypes to childhood acute lymphoblastic leukemia[J]. Cancer Manag Res, 2018, 10: 5677-5684. DOI:10.2147/CMAR.S178411 |
 2020, Vol. 47
2020, Vol. 47




