扩展功能
文章信息
- 邵雪非, 王其福, 刘佳强, 陈三送, 沈军, 袁权, 江晓春
- SHAO Xue-Fei, WANG Qi-Fu, LIU Jia-Qiang, CHEN San-Song, SHEN Jun, YUAN Quan, JIANG Xiao-Chun
- 创伤后重型急性弥漫性脑肿胀临床治疗策略
- Clinical treatment of severe post-traumatic acute diffuse brain swelling
- 国际神经病学神经外科学杂志, 2020, 47(4): 404-408
- Journal of International Neurology and Neurosurgery, 2020, 47(4): 404-408
-
文章历史
收稿日期: 2020-05-20
修回日期: 2020-08-02
2. 皖南医学院弋矶山医院影像科, 安徽 芜湖 241001
2. Department of Medical Image, Yijishan Hospital of Wannan Medical College, Wuhu, Anhui 241001, China
近年来,创伤性脑损伤(traumatic brain injury,TBI)的就诊率、住院率和死亡率仍有所增加,我国2019年TBI发生率为313/10万人,比往年增加了33.1%[1]。创伤后急性弥漫性脑肿胀(post traumatic acute diffuse brain swelling,PADBS)是一种特殊类型的颅脑损伤,伤后出现弥漫性脑组织肿胀,病情严重,发病率为10.5%~29.0%,其特征是创伤后脑组织肿胀导致恶性颅内压增高,病死率约80%,其病理机制尚不清楚[2]。由于针对PADBS的治疗方案存在争议,现回顾分析皖南医学院弋矶山医院收治的PADBS患者,探讨保守治疗与手术治疗对重型PADBS的疗效。现报告如下。
1 资料与方法 1.1 一般资料收集2016年1月—2019年12月该院收治的重型PADBS患者44例,按手术与否分为手术组和保守治疗组。手术组30例。其中,男23例,女7例;年龄(48.60±12.70)岁;致伤原因:交通伤22例,高处坠落伤6例,跌伤2例。保守治疗组14例。其中,男9例,女5例;年龄(42.64±17.01)岁;致伤原因:交通伤9例,高处坠落伤4例,跌伤1例。纳入标准:①有明确头部外伤史;②伤后即刻出现昏迷或进行性意识障碍加重,伤后意识障碍时间 > 6 h,神经系统定位体征不明显;③CT影像表现符合PADBS诊断标准:单侧或双侧大脑半球弥漫性肿胀,脑池、脑室不同程度受压变小,灰白质分界不清,可合并有薄层硬膜下血肿、硬膜外血肿及脑挫裂伤等,中线无或稍有移位;④格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分3~8分;⑤既往无神经系统病史,无酒精成瘾史,无特殊药物如镇静药物、毒品等长期服用史;⑥未行颅内压监测。排除标准:①非外伤原因所致的弥漫性脑肿胀;②伴有严重的合并伤、休克以及多器官功能衰竭者;③排除与此次外伤无关的其他可能导致患者意识障碍的疾病;④因瞳孔变化和GCS评分下降而行手术;⑤资料不全或随访丢失的患者。
1.2 影像学资料所有患者在就诊时行头颅CT扫描,伤后6 h内扫描的患者,根据病情24 h内再次扫描。见图 1、2。

|
| 图 1 患者1头颅影像学检查情况 |

|
| 图 2 患者2头颅影像学检查情况 |
典型病例1:车祸致伤3 h入院,入院GCS评分5分;入院时头颅CT示大脑半球弥漫性脑肿胀,环池欠清,双侧脑室受压,伴有多处灶性挫伤出血(图 1A~1D);24 h时头颅CT复查示环池和脑室受压较前稍有改善(图 1E~1H);7 d时头颅CT示脑肿胀较前明显好转,挫伤灶无明显增大但水肿较前明显(图 1I~1L);1个月时头颅MRI平扫示脑干形态规则,脑内结构基本正常(图 1M~1P)。
典型病例2:车祸致伤4 h入院,入院GCS评分6分;入院时头颅CT示右颞部急性硬膜外出血,脑肿胀,环池欠清伴积血,三脑室和双侧侧脑室明显受压变小(图 1A~1D);24 h时头颅CT示脑肿胀仍较明显,蛛网膜下腔出血较前有所吸收(图 1E~1H);12 d时头颅CT示脑肿胀较前好转,环池、侧脑室和三脑室清晰可见,右侧额颞硬膜下积液(图 1I~1L);1头颅MRI平扫示脑干形态规则,脑内结构基本正常(图 1M~1P);图 2Q示颅底广泛骨折并延伸至鞍区;1个月时DSA显示右侧颈内动脉颈段—海绵窦段夹层,颈内动脉海绵窦瘘(图 2R), 左侧颈外动脉—颌内动脉供血假性动脉瘤(图 2S), 左侧颈内动脉海绵窦瘘(图 2T)。
1.3 治疗方法入院后行常规生命体征监护,保持患者呼吸道通畅,积极纠正低血氧状态,必要时行气管插管或气管切开术,常规使用甘露醇、白蛋白等脱水药物降低颅内压,防治多系统并发症,加强早期肠内外营养支持。保守治疗组除上述常规治疗外加用琥珀酸氢化可的松200 mg次/8 h,3 d后200 mg次/12 h,2 d后200 mg次/d,共使用7 d。手术组参照文献[3]中外伤大骨瓣手术去除单侧或双侧骨瓣方法予手术治疗。
1.4 观察指标① 入院GCS评分;②格拉斯哥预后量表(Glasgow outcome scale,GOS)评分:伤后6个月后采用GOS评分对患者进行预后评估:5分为恢复良好,恢复正常生活,有轻度缺陷;4分为轻度残疾,但可独立生活,能在保护下工作;3分为重度残疾,清醒,日常生活需要照料;2分为植物生存;1分为死亡;③住院时间。
1.5 统计学方法应用SPSS 18.0统计软件对数据进行分析。计量资料以均数±标准差(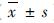
两组患者入院时年龄、性别及GCS评分比较,差异无统计学意义(P>0.05)。见表 1。
| 组别 | n | 年龄 | 性别(男/女) | GCS评分 |
| 手术组 | 30 | 48.60±12.70 | 23/7 | 6.23±1.76 |
| 保守治疗组 | 14 | 42.64±17.01 | 9/5 | 6.50±1.34 |
| t/χ2值 | - | 1.298 | 0.246 | 0.503 |
| P值 | - | 0.201 | 0.620 | 0.618 |
两组患者伤后6个月GOS评分差异无统计学意义(P > 0.05),但手术组住院时间长于保守治疗组,差异有统计学意义(P < 0.05)。见表 2。
| 组别 | n | 伤后6个月GOS评分 | 住院时间 |
| 手术组 | 30 | 4.10±1.40 | 48.50(33.50~71.50) |
| 保守治疗组 | 14 | 4.57±1.16 | 30.50(25.00~46.50) |
| t/Z值 | - | 1.096 | 2.067 |
| P值 | - | 0.279 | 0.039 |
PADBS是一种特殊类型的TBI,有着较高的致死致残率,治疗方法以降颅压为主综合手段的保守治疗和以去骨瓣减压为主的手术治疗。保守治疗者认为手术治疗对于PADBS并无益处,主张手术者认为合理选择手术方式和时机,能有效缓解PADBS的恶性高颅压,积极手术能提高PADBS患者救治率。为此,有必要入研判和理解PADBS病理机制,旨为PADBS患者提供更好的治疗方法。
目前PADBS病理生理机制虽尚不清楚,目前研究认为其与脑血流动力学改变有关。PADBS大多是严重的弥漫性脑损伤所致,该损伤间接或直接损伤丘脑、中脑网状结构和桥脑蓝斑处血管舒缩中心引发血管舒缩功能障碍,导致脑血流量和容量突然增加,致使颅内压恶性升高,脑灌注压力降低以及静脉回流受阻,脑组织急剧弥漫性肿胀。Vladimir等对30例PADBS患者尸体脑组织学检查证实脑血管充血并伴有血管周围出血,脑体积增加[4]。
去骨瓣减压术是目前手术治疗PADBS患者主要而有效的手段,研究表明,去骨瓣减压可以降低恶性颅内压,并且使患者获得了良好的功能恢复。更有人主张双侧去骨瓣减压术治疗PADBS,虽能降低PADBS患者病死率,但术中行也增加了不良事件的发生率,且幸存者有着严重残疾[5-6]。本研究手术组中低血压6例,虽术中阶段性减压,仍有5例脑膨出,术中低血压可在术前准备和术中有所避免,但术中急性脑膨出的发生与去骨瓣后突发性颅内压下降有关,也是导致术中低血压和术后迟发性血肿的主要原因,而对于PADBS患者更易发生,有报道显示通过脑室外引流、阶梯减压等方法虽有改善但收效甚微。笔者前期利用改良大骨瓣减压术治疗特重型创伤后急性PADBS,虽取得了一定疗效,但手术中急性脑膨出和低血压时有发生,该术式虽然对PADBS致死率有所降低但生命质量仍堪忧[7]。
Szczygielski等对不同损伤程度TBI动物模型行去骨瓣治疗,其结果不尽相同,并认为手术减压可促进脑水肿的形成和加重原挫伤灶,术后神经功能恶化[8]。本研究为回顾性分析,所选取手术组病例皆为无因瞳孔变化和GCS评分下降而选择手术治疗的患者,手术指征仅为PADBS患者影像学所示,结果显示手术组与保守治疗组患者GOS评分有差异,手术治疗组住院时间长于保守治疗组,而患者所承受的创伤和后期颅骨修补费用不言而喻。虽然去骨瓣减压在挽救TBI患者生命和改善神经功能结局方面发挥着重要作用,但积极手术减压是否适用于所有PADBS患者值得商榷。
本研究中保守治疗组所采用的常规TBI治疗措施中须强调有:①改善气道,纠正低氧血症。PADBS引发脑血管舒缩功能障碍所引起的一系列病理生理变化如脑血流急剧增加、脑灌注压力降低、脑组织急性弥漫性肿胀、脑组织缺血缺氧加重脑肿胀的恶性循环,打破此恶性循环的关键因素是纠正低氧血。图 2显示该患者CT显示PADBS改变,入院时见大量口鼻腔血性分泌物,经气管插管改善低氧血症后,3 d时头颅CT显示环池清晰可见,后期DSA显示因颅底骨折所致椎动脉夹层动脉瘤,如早期采用手术治疗,术中出血将是灾难性的。②氢化可的松的使用。以往研究显示糖皮质激素被认为有改善血管通透性,减少脑脊液的产生和清除自由基等作用被广泛应用于TBI中,但进一步研究表明激素对降低病死率和提高患者生存质量均无益处[9],因此不再推荐。本研究保守治疗组中除常规治疗措施外均规则使用了小剂量琥珀酸氢化考的松。其出发点鉴于尽管在mTBI中神经内分泌异常很少见,但在严重的TBI后垂体功能低下的患病率为50%~80%[10-11]。后下丘脑-垂体-肾上腺轴(HPA)抑制,HPA功能异常会严重损害损伤后的机体恢复并降低生活质量。Chen和Tapp研究表明TBI后下丘脑和垂体受损会导致HPA抑制,导致皮质醇水平下降[12-13]。同样Bouras研究后认为TBI后出现HPA抑制且血液中糖皮质激素减少,建议TBI后用使用皮质类固醇可预防HPA抑制[14]。PADBS多伴有颅底广泛骨折,虽然下丘脑和垂体位置较深但仍易受损,并且为脑组织广泛受损、移位,导致垂体柄牵拉受损也是多伴有HPA受损主要原因[15]。TBI患者常规使用异丙酚和戊巴比妥也会抑制类固醇的生成[16]。Roquilly研究证实低剂量的氢化可的松不仅可以预防HPA抑制而且其抗炎特性可抑制TBI后机体额外应激反应[17]。如可提高中性粒细胞的吞噬能力和树突状细胞免疫细胞功能限制创伤后医院获得性肺炎[18]。用应激剂量的氢化可的松治疗TBI后与危重病相关的皮质类固醇激素不足,可能会改善神经系统结局和死亡率。氢化可的松的盐皮质激素性质可降低低钠血症和脑肿胀的速度。其作用是甲基强的松龙所不及。糖皮质激素主要作用在于HPA,提高肾上腺皮质功能,升高血浆皮质醇水平, 从而维持机体应激反应和体内激素稳定和通过包括调节血管内皮生长因子、多种水通道途径以及通过MMP/TIMP机制等减轻脑水肿[19-20]。
综上所述,PADBS在无瞳孔变化及GCS评分下降的情况下,可选择保守治疗。本研究不足在于病例数较少,分组细化不够,今后对此将近一步研究探讨,并加强PADBS机制研究。
| [1] |
Jiang JY, Gao GY, Feng JF, et a1. Traumatic brain injury in China[J]. Lancet Neurol, 2019, 18(3): 286-295. |
| [2] |
Jiang YZ, Lan Q, Wang QH, et al. Gradual and controlled decompression for brain swelling due to severe head injury[J]. Cell Biochem Biophys, 2014, 69(3): 461-466. |
| [3] |
刘佰运, 江基尧, 张赛. 外伤大骨瓣手术方法介绍[J]. 中华神经外科杂志, 2008, 24(2): 153-154. |
| [4] |
ŽivkoviV, CvetkovićD, ObradovićD, 等. Mechanism of brain swelling in cases of brain evisceration due to catastrophic craniocerebral injury-an autopsy study[J]. Forensic Sci Med Pathol, 2020, 16(1): 107-112. |
| [5] |
Plesnila N. Decompression craniectomy after traumatic brain injury: recent experimental results[J]. Prog Brain Res, 2007, 161: 393-400. DOI:10.1016/S0079-6123(06)61028-5 |
| [6] |
Kolias AG, Kirkpatrick PJ, Hutchinson PJ. Decompressive craniectomy: past, present and future[J]. Nat Rev Neurol, 2013, 9(7): 405-415. DOI:10.1038/nrneurol.2013.106 |
| [7] |
邵雪非, 武银刚, 沈军, 等. 改良大骨瓣减压术治疗特重型创伤后急性弥漫性脑肿胀[J]. 中华创伤杂志, 2014, 30(6): 495-499. |
| [8] |
Szczygielski J, Mautes AE, Müller A, et al. Decompressive craniectomy increases brain lesion volume and exacerbates functional impairment in closed head injury in mice[J]. J Neurotrauma, 2016, 33(1): 122-131. DOI:10.1089/neu.2014.3835 |
| [9] |
Alderson P, Roberts I. Corticosteroids for acute traumatic brain injury[J]. Cochrane Database Syst Rev, 2005, 25(1): CD000196. |
| [10] |
Capizzi A, Woo J, Verduzco-Gutierrez M. Traumatic brain injury: an overview of epidemiology, pathophysiology, and medical management[J]. Med Clin North Am, 2020, 104(2): 213-238. DOI:10.1016/j.mcna.2019.11.001 |
| [11] |
Klose M, Feldt-Rasmussen U. Chronic endocrine consequences of traumatic brain injury—What is the evidence[J]. Nat Rev Endocrinol, 2017, 14: 57-62. |
| [12] |
Chen X, Chai Y, Wang SB, et al. Risk factors for corticosteroid insufficiency during the sub-acute phase of acute traumatic brain injury[J]. Neural Regen Res, 2020, 15(7): 1259-1265. DOI:10.4103/1673-5374.272611 |
| [13] |
Tapp ZM, Godbout JP, Kokiko-Cochran ON. A tilted axis: maladaptive inflammation and HPA axis dysfunction contribute to consequences of TBI[J]. Front Neurol, 2019, 10: 345. DOI:10.3389/fneur.2019.00345 |
| [14] |
Bouras M, Roquilly A, Mahé PJ, et al. Cortisol total/CRP ratio for the prediction of hospital-acquired pneumonia and initiation of corticosteroid therapy in traumatic brain-injured patients[J]. Crit Care, 2019, 23(1): 394. DOI:10.1186/s13054-019-2680-6 |
| [15] |
Bensalah M, Donaldson M, Aribi Y, et al. Cortisol evaluation during the acute phase of traumatic brain injury-A prospective study[J]. Clin Endocrinol (Oxf), 2018, 88(5): 627-636. DOI:10.1111/cen.13562 |
| [16] |
Llompart-Pou JA, Raurich JM, Pérez-Bárcena J, et al. Acute hypothalamic-pituitary-adrenal response in traumatic brain injury with and without extracerebral trauma[J]. Neurocrit Care, 2008, 9(2): 230-236. DOI:10.1007/s12028-008-9115-6 |
| [17] |
Roquilly A, Vourc'h M, Cinotti R, et al. A new way of thinking: hydrocortisone in traumatic brain-injured patients[J]. Crit Care, 2013, 17(6): 1016. DOI:10.1186/cc13138 |
| [18] |
Bouras M, Asehnoune K, Roquilly A. Contribution of dendritic cell responses to sepsis-induced immunosuppression and to susceptibility to secondary pneumonia[J]. Front Immunol, 2018, 9: 2590. DOI:10.3389/fimmu.2018.02590 |
| [19] |
Jiang YZ, Lan Q, Wang QH, et al. Gradual and controlled decompression for brain swelling due to severe head injury[J]. Cell Biochem Biophys, 2014, 69(3): 461-466. |
| [20] |
Barnes PJ. Molecular mechanisms and cellular effects of glucocorticosteroids[J]. Immunol Allergy Clin North Am, 2005, 25(3): 451-468. DOI:10.1016/j.iac.2005.05.003 |
 2020, Vol. 47
2020, Vol. 47




