扩展功能
文章信息
- 方婷, 朱爱华, 黄守玉, 李文达, 张少婷
- FANG Ting, ZHU Ai-Hua, HUANG Shou-Yu, LI Wen-Da, ZHANG Shao-Ting
- 他汀类药物联合常规药物治疗阿尔茨海默病有效性与安全性的meta分析
- Efficacy and safety of statins combined with conventional therapy in the treatment of Alzheimer's disease: A meta-analysis
- 国际神经病学神经外科学杂志, 2020, 47(4): 366-371
- Journal of International Neurology and Neurosurgery, 2020, 47(4): 366-371
-
文章历史
收稿日期: 2020-02-24
修回日期: 2020-07-13
2. 中国中医科学院望京医院, 北京 100102
2. Wangjing Hospital of China Academy of Chinese Medical Sciences, Beijing 100102, China
阿尔茨海默病(Alzheimer’s disease, AD)是一种缓慢进展性加重的中枢神经系统退行性疾病。其主要特征为认知损害,初期可表现为近期记忆障碍,随着病程发展逐渐可出现语言定向功能受损、精神行为异常等[1],严重可致生活不能自理。目前我国多采用乙酰胆碱酯酶抑制剂(如盐酸多奈哌齐)、NMDA受体拮抗剂(如盐酸美金刚)和抗氧化剂(如银杏叶提取物)等[2]药物以改善AD患者认知功能和精神行为症状,但上述药物对部分患者疗效不明确,或只能短期改善症状,不能从根本上控制病情发展[3]。与此同时,胆固醇代谢紊乱与AD发病的相关性逐渐为大众接受,因此,作为传统降脂药物的他汀类药物能否对AD起到防治作用已是许多科研人员的研究重点。
一项回归分析显示,他汀类药物与AD的发生呈负相关[4],其主要作用机制是通过降低外周胆固醇及脑内24S-羟基胆固醇以减少Aβ合成、抑制载脂蛋白E的表达防止tau蛋白的过度磷酸化、通过非降脂机制减少Aβ形成、调节血管内皮功能改善脑血管功能、调节神经受体的作用及调节氧化应激作用以保护神经细胞等[5-6],其治疗AD在理论上具有可行性,部分临床试验也证实如此。然而,刘汉兴等[7]的meta分析显示,他汀类药物治疗AD效果与安慰剂相当,并没有显著改善患者认知功能及生活能力。李红燕[8]则表示他汀类药物仅对伴有高胆固醇血症的AD患者有效。现为进一步明确他汀类药物对AD患者有无疗效,本研究对近10年来国内外有关联用他汀类药物类药物治疗AD的临床随机对照试验进行了收纳和整理,采用meta分析的方法,系统评价他汀类药物辅助治疗AD的有效性及安全性,为临床联用他汀类药物治疗AD提供参考依据。
1 资料与方法 1.1 纳入与排除标准 1.1.1 纳入标准① 随机对照试验(randomized controlled trial,RCT)。②纳入符合AD诊断标准的患者,年龄、性别、病程或病情程度不限。③对照组采用AD常规治疗,试验组在对照组基础上加用他汀类药物类药物。两组剂量不限,疗程大于3个月。④主要指标:简易智力状态检查量表(mini-mental state examination,MMSE);日常生活能力量表(activities of daily living, ADL)。⑤次要指标:不良反应发生例数。
1.1.2 排除标准① 单独使用他汀类药物类药物治疗AD。②纳入研究的终点观察指标不是本次系统评价需要的结局指标。③基本信息不全。
1.2 文献检索策略计算机检索CNKI、万方数据库、维普数据库、中国生物医学文献数据库(CBM)、PubMed、SCI等数据库,搜集公开发表的有关他汀类药物联合常规用药治疗AD的随机对照试验,检索时间为各数据库自收录开始至2020年2月。中文检索词:#1:“阿尔茨海默病”;#2:“他汀类药物”或“羟甲基戊二酰辅酶A”;#3:#1 AND #2;英文检索词:#1:“Alzheimer disease”;#2:“statin”OR“Hydroxy-methlglutaryl-CoA Inhibitors”;#3:#1 AND #2。
1.3 文献筛选及数据提取参考Cochrane手册制定的“文献信息提取表”,由2位研究者独立筛选文献、提取资料并交叉核对,如遇分歧,则咨询第三方协助判断。文献筛选时,首先通过阅读题目和摘要,在排除明显不相干的文献后,进一步阅读全文,最终确定是否纳入。资料提取的内容主要包括:①纳入研究的基本信息,包括研究题目、第一作者、发表时间等;②研究对象的基线特征,包括年龄、MMSE评分等;③干预措施的具体实施方法及疗程;④偏倚风险评价的关键要素;⑤所需要的结局指标及结果测量数据。
1.4 纳入研究的偏倚风险评价由2名研究人员参照Cochrane手册指定的“偏倚风险标准”,对纳入文献的以下方法学指标进行评价:①随机方法是否明确;②分配方案隐藏情况;③是否实施盲法;④结果数据是否完整;⑤是否有选择性研究报告;⑥其他偏倚来源。如遇分歧,则由第三方协助解决。
1.5 统计学方法采用RevMan 5.3软件进行meta分析。计量资料如MMSE、ADL分数采用均数±标准差(
初检出相关文献共计1 743篇,其中CNKI 79篇,万方185篇,维普114篇,CBM 140篇,PubMed 844篇,SCI 381篇,去掉重复文献及与题目明显不相干文献,最终纳入8个RCT,共607例患者。文献筛选流程及结果见图 1。
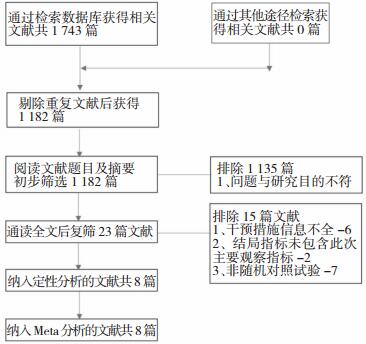
|
| 图 1 文献筛选流程及结果 |
纳入研究的基本特征见表 1。纳入研究的偏倚风险评价结果见图 2。
| 序号 | 纳入研究 | 样本量(n) | 干预措施 | 平均年龄(岁) | 基线MMSE(分) | 疗程 | 结局指标 | |||||||
| T | C | T | C | T | C | T | C | |||||||
| 1 | 吴娟 2013[9] |
37 | 37 | C+阿托伐他 汀钙20 mg qn |
盐酸多奈哌 齐片5 mg qn |
76.5±1.9 | 75.4±2.1 | 20.97±2.17 | 21.53±1.82 | 1年 | MMSE、 ADL、CDR、 不良反应 |
|||
| 2 | 段海平 2014[10] |
44 | 44 | C+阿托伐他 汀20 mg qn |
盐酸美金刚片 5 mg qn逐步加 量至10 mg bid |
71 3±3.5 | 71.2±3.7 | 11.63±3.87 | 11.61± 3.79 | 24周 | MMSE、 ADL、GDS |
|||
| 3 | 赵晓玲 2010[11] |
26 | 26 | C+阿托伐他 汀片20 mg qn |
盐酸美金刚片 5 mg qn逐步加 量至10 mg bid |
74.21±13.7 | 72.52±14.2 | 11.63±3.50 | 11.35±3.02 | 24周 | MMSE、 ADL、GDS、 不良反应 |
|||
| 4 | 赵晓玲 2011[12] |
22 | 22 | C+阿托伐他 汀片20 mg qn |
盐酸多奈哌齐片 5 mg qn逐步加 量至10 mg qn |
72.64±13.5 | 72.52±14.2 | 11.79±3.53 | 11.56±3.05 | 24周 | MMSE、 ADL、GDS、 不良反应 |
|||
| 5 | 黄爱明 2010[13] |
56 | 57 | C+氟伐他 汀40 mg qn |
石杉碱甲片0.1 mg bid/茴拉西坦胶 囊0.2 g tid |
66.5±7.5 | 65.3±6.3 | 17.8±2.3 | 17.6±2.5 | 12周 | MMSE、ADL、 CDR、不良反 应、QOL |
|||
| 6 | 邬思繁 2018[14] |
48 | 48 | C+瑞舒伐他 汀钙片5 mg bin |
盐酸多奈哌齐 片5 mg bin |
73.34±3.67 | 74.12±3.52 | 14.18±4.33 | 14.23±4.34 | 1年 | MMSE、 ADL、SCr、 不良反应 |
|||
| 7 | 何群 2017[15] |
31 | 31 | C+瑞舒伐他 汀钙片5 mg qn |
盐酸多奈哌齐 片5 mg qn |
73.8±1.8 | 72.6±2.2 | 18.15±5.80 | 18.0±4.18 | 6个月 | MMSE、不 良反应 |
|||
| 8 | 梁永梅 2017[16] |
40 | 40 | C+阿托伐他 汀20 mg qn |
茴拉西坦胶 囊0.2 g tid |
75.28±1.94 | 75.32±1.86 | 18.1±5.23 | 18.1±4.92 | 3个月 | MMSE、不 良反应 |
|||
| 注:T=试验组;C=对照组;CDR=临床痴呆分级量表(Clinical Dementia Rating);GDS=老年抑郁量表(Geriatric Depression Scale);SCr=血清肌酐(serum creamtinine) | ||||||||||||||
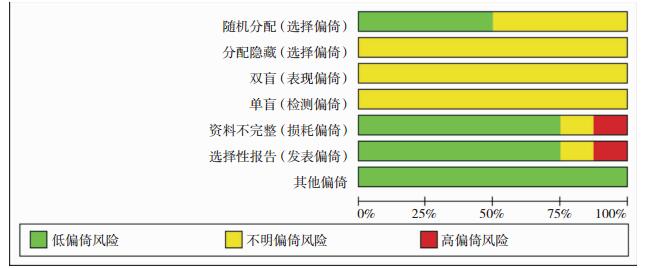
|
| 图 2 纳入研究的质量评价 |
共有8个研究[9-16]以MMSE为结局指标,包括609例患者。异质性检验结果显示组间存在高度异质性(I2=75%, P < 0.001)。为分析异质性来源,我们采取逐一剔去文献后继续异质性检验的方法,发现剔去黄爱明等[13]的研究后组间异质性降低(I2=0%),使用固定效应模型对其余文献进行合并。meta分析结果显示,他汀类药物联合常规药物治疗组MMSE评分高于对照组,且差异具有统计学意义(MD=1.30, 95%CI: 0.70~1.90, P < 0.001)。由于图中仅显示吴娟[9]、邬思繁[14]等的研究证实他汀类药物联合常规药物治疗组MMSE评分高于对照组,其他五个研究[10-13, 15-16]则显示联用他汀类药物对MMSE评分没有影响。为分析具体原因,我们根据干预时长进行亚组分析,其结果显示联合他汀类药物在干预3个月、6个月时均未表现出明显优势,但在干预1年后试验组MMSE评分高于对照组,且差异有统计学意义(MD=1.75, 95%CI: 0.86~2.63, P < 0.001]。见图 3。
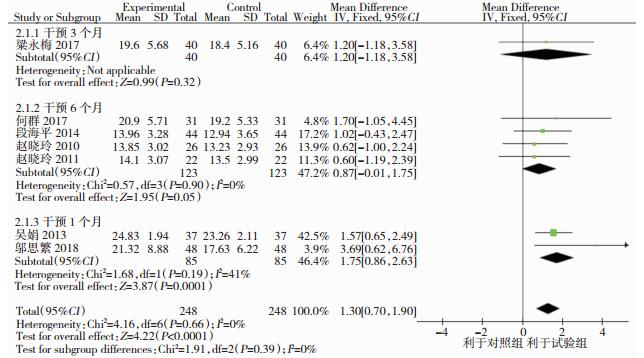
|
| 图 3 常规治疗和他汀类药物联合常规治疗对MMSE改善效果的meta分析(亚组分析) |
共有6个研究[9-14]的认知终点包含了ADL评分,其中邬思繁[14]的ADL评分方式与其他研究不同,故剔去。其余5个研究共371例患者,因其较高的异质性(I2=69%, P=0.01)进行随机效应模型meta分析的亚组分析,结果显示,他汀类药物联合常规药物治疗组降低ADL评分优于对照组,差异具有统计学意义(MD=-5.28, 95%CI: -7.61~-2.96, P < 0.001);干预3个月时ADL评分降低最多(MD=-7.80, 95%CI: -10.14~-5.46, P < 0.001);其次是干预6个月(MD=-5.35, 95%CI: -7.78~-2.91, P < 0.001);干预1年时则显示联用他汀类药物对ADL评分没有影响。见图 4。
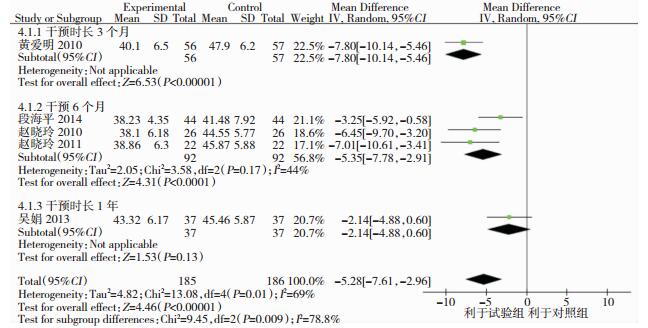
|
| 图 4 常规治疗和他汀类药物联合常规治疗对ADL改善效果的meta分析(亚组分析) |
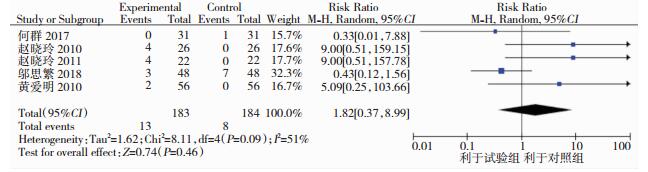
共有7个研究[9, 11-16]报道不良反应发生情况,2个研究[9, 16]显示治疗组与对照组均无不良反应,其余5个研究报道了不良反应例数,常见不良反应包括转氨酶升高、呕吐、睡眠障碍、头晕、腹痛、腹胀、恶心、反酸,少见不良反应为腹泻和肌肉酸痛。随机效应模型meta分析结果显示,两组的不良反应发生率比较,差异无统计学意义(RR=1.82, 95%CI: 0.37~8.99, P=0.46)。见图 5。
|
| 图 5 常规治疗和他汀类药物联合常规治疗发生不良反应例数的meta分析 |
本次纳入的研究均以“治疗AD”为主题,meta分析结果显示,他汀类药物联合常规药物治疗组改善MMSE评分及降低ADL评分的效果优于对照组,其中MMSE评分平均可增加1.3分,ADL评分平均可降低5.28分,且没有增加不良反应发生风险,提示具有较好的有效性与安全性。略有不同的是,相较于干预3个月及6个月,MMSE评分在干预1年时显著增高,可增长1.75分;ADL评分则显示在干预3个月时效果最好,可降低7.8分,但随着干预时间增长ADL降低的分值逐渐减小,并在干预1年时显示两组之间没有差异。但MMSE评分是否只有在他汀类药物干预1年时才有显著效果?又是否存在随治疗时间逐步扩大的增益?ADL评分是否仅在初步治疗时疗效最明显?随干预时间延长则疗效降低甚则无明显疗效?其次,这种程度的改善是否具有临床意义?[17]能否延缓AD病程?这都需要后续的高质量研究来验证。
与其他meta分析相比,本meta分析优势在于:①相较于其他meta分析4篇的研究数目,本研究纳入文献8篇,对结果的分析可能更具全面性。②在文献的选取上,本次纳入文献的干预时间为3~12个月不等,而其它两篇均为6个月,从亚组分析也能看出在改善患者认知功能上,干预时长起着重要的作用,这可能是导致最终结果不同的重要原因。③纳入研究使用了统一的评价工具,并纳入了新研究文献,可能使结论不同。但由于安慰剂对照的临床试验才是治疗药物有效或无效最强有力的证据,故本次结论可能具有较低的信度。
本研究的不足之处有以下几个方面:①此次研究纳入文献质量较低,纳入研究多为小样本研究,故得出的结论应结合临床实际来解释,同时也需要更多更高质量的随机对照试验来验证。②本次纳入研究数目较少,缺乏进行多个因素的亚组分析的基础,故得出的结论相应存在可信度较低、结论或有偏颇的情况。③终末结局指标没有采用更具可靠性的ADAS-cog,而以MMSE评分为主要研究目标,但其只能粗略描述症状改善情况,并不是最佳的疗效监测工具。④部分研究随机方法不明确,纳入研究均未描述分配隐藏及使用盲法情况,可能有偏倚风险。⑤此次研究的结局指标受较多因素影响,可能会导致归因偏差。
综上,常规治疗联合他汀类药物较常规治疗更能改善AD患者认知功能,显著提高患者生活能力,且没有增加不良反应发生率。他汀类药物或可作为AD的补充治疗手段。受纳入研究的质量及数量限制,此次研究没有进行基于他汀类药物的药物种类及AD病情程度方面的亚组分析,因此,他汀类药物联合常规药物治疗AD的临床疗效还需进一步开展严格设计的随机双盲对照试验,特别是大样本多中心的随机双盲对照试验来加以证明。
| [1] |
王琼, 王国平. 阿尔茨海默病的诊断与治疗[J]. 中华全科医学, 2019, 17(8): 1255-1256. |
| [2] |
田金洲. 中国痴呆诊疗指南(2017年版). 北京: 人民卫生出版社, 2018.
|
| [3] |
王晓珍, 王蓉. 阿尔茨海默病的药物治疗及研发进展[J]. 中国新药杂志, 2019, 28(24): 2960-2964. |
| [4] |
韩瑞, 高明燕, 顾平. 他汀类药物防治阿尔茨海默病的意义[J]. 临床误诊误治, 2015, 28(2): 109-112. |
| [5] |
李扬娜, 马丽娜, 王思翔, 等. 他汀类药物治疗阿尔茨海默病的作用机制研究进展[J]. 实用临床医学, 2016, 17(11): 103-106. |
| [6] |
付婕琴, 刘海洋, 胡昌华. 他汀类药物治疗阿尔茨海默病的非降脂作用新机制[J]. 中国药学杂志, 2010, 45(11): 804-807. |
| [7] |
刘汉兴, 章军建. 他汀类药物治疗阿尔茨海默病的Meta分析[J]. 神经损伤与功能重建, 2012, 7(6): 415-418. |
| [8] |
李洪燕.他汀类药物对轻中度阿尔茨海默病治疗影响的Meta分析[D].济南: 山东大学, 2013.
|
| [9] |
吴娟, 付朝晖, 陈永. 阿托伐他汀物钙联合盐酸多奈哌齐治疗阿尔茨海默病的临床观察[J]. 中国药房, 2013, 24(20): 1855-1857. |
| [10] |
段海平. 阿托伐他汀联合美金刚治疗中重度阿尔茨海默病的疗效分析[J]. 中国医药指南, 2014, 12(11): 244-245. |
| [11] |
赵晓玲, 刘艳, 张仲, 等. 阿托伐他汀联合美金刚治疗中重度阿尔茨海默病的疗效和安全性[J]. 中国实用神经疾病杂志, 2010, 13(21): 9-11. |
| [12] |
赵晓玲, 刘艳. 多奈哌齐联合阿托伐他汀治疗中重度阿尔茨海默病的疗效和安全性[J]. 实用医院临床杂志, 2011, 8(3): 52-54. |
| [13] |
黄爱明, 谢林珠, 秦素萍. 氟伐他汀治疗轻、中度阿尔茨海默病的临床对照观察[J]. 实用老年医学, 2010, 24(1): 48-50. |
| [14] |
邬思繁, 胡洁云, 楼晓霞, 等. 瑞舒伐他汀联合盐酸多奈哌齐对阿尔茨海默病患者认知功能的改善效果观察[J]. 中国医师杂志, 2018, 20(8): 1199-1201. |
| [15] |
何群. 瑞舒伐他汀联合盐酸多奈哌齐治疗阿尔茨海默病疗效观察[J]. 中国实用神经疾病杂志, 2017, 20(8): 107-108. |
| [16] |
梁永梅. 阿托伐他汀治疗阿尔茨海默病疗效观察[J]. 中西医结合心血管病电子杂志, 2017, 5(13): 68-69. |
| [17] |
Howard R, Phillips P, Johnson T, et al. Determining the minimum clinically important differences for outcomes in the DOMINO trial[J]. Int J Geriatr Psychiatry, 2011, 26(8): 812-817. DOI:10.1002/gps.2607 |
 2020, Vol. 47
2020, Vol. 47




