扩展功能
文章信息
- 张秋池, 常诚, 顾锡镇
- ZHANG Qiu-Chi, CHANG Cheng, GU Xi-Zhen
- 细胞因子白细胞介素-4对认知功能改善的研究进展
- Research progress in the interleukin-4 for improving cognitive function
- 国际神经病学神经外科学杂志, 2020, 47(3): 330-333
- Journal of International Neurology and Neurosurgery, 2020, 47(3): 330-333
-
文章历史
收稿日期: 2020-01-10
修回日期: 2020-04-10
2. 南京中医药大学, 江苏 南京 210000
2. Nanjing University of Chinese Medicine, Nanjing 210000, Jiangsu, China
目前,在针对认知障碍的机制研究上,越来越多的科研工作者将目光投向了脑白质的作用,脑白质约占人脑总量的60%,其主要由轴突和神经胶质细胞组成,其中的神经胶质细胞除了基本的支持作用、隔离与绝缘作用外,还有着非常重要的参与神经免疫调节作用,他们有产生细胞因子和补体等免疫分子的作用、起抗原提呈作用及吞噬作用。而其中细胞因子白细胞介素4(interleukin-4, IL-4)的作用尤为特别,在脑组织中,诸多研究发现IL-4可在炎症中保护认知功能。因此笔者将近年来有IL-4改善认知功能的研究进行了检索和分析,并综述如下。以期明确IL-4在中枢神经中的作用,并在以后的实验研究中尝试将其作为认知功能变化的特异性分子标志物,进行更深层的探索。
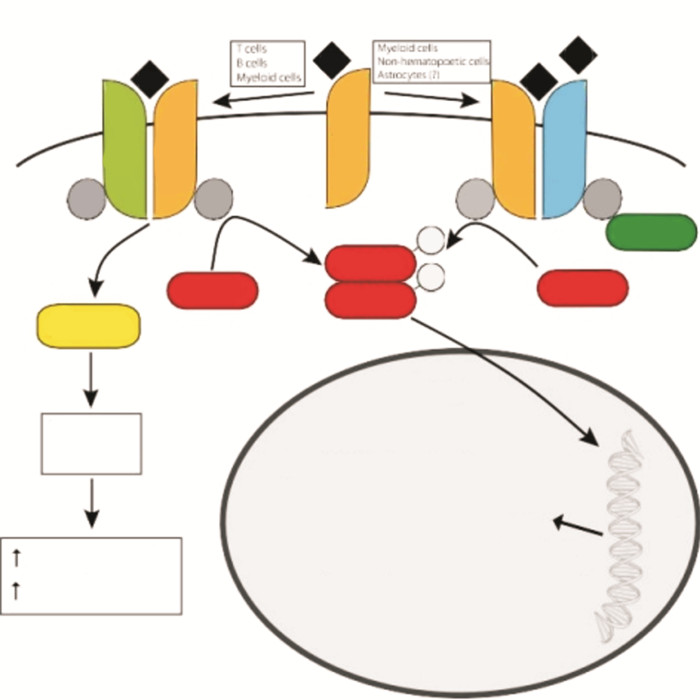
1 白细胞介素-4及其信号通路二十世纪八十年代是B细胞和T细胞研究的开创性年份。1982年,人们发现了重要的细胞因子——IL-4[1]。从此,LI-4在免疫中的重要作用也日趋凸显。目前,对IL-4比较普遍的认知为:IL-4是T辅助2(T helper 2, Th2)介导的免疫反应的基本免疫调节细胞因子,具有复杂的信号系统和多效功能;IL-4是Th2细胞分化的关键调节因子和B细胞同型转换的关键因素。随着对细胞因子研究的深入,人们已经清晰地认识到IL-4发挥着远超出所谓“经典” Th2免疫力的作用,它在新陈代谢、组织再生、重塑、癌症以及学习和记忆等广泛的领域中发挥着重要作用[2]。见IL-4的信号通路图。
曾经认为大脑是被免疫细胞屏蔽的,然而,近期诸多研究已经发现,免疫细胞在维持大脑完整性方面占据着极其重要的地位,其中发挥主要作用的是T细胞。其中,与认知能力下降、衰老及神经退行性疾病有关的炎症状态倾向于Th1型,尤其是在海马中,可见IL-6、IL-1b和IL-18的表达增加[4]。与Th1不同的是,Th2倾向的炎症对认知功能的影响多是保护性的。使用Morris水迷宫(Morris water maze, MWM)测试中的视觉空间学习和记忆任务后,脑膜Th2细胞数量增加[5]。在脑膜间隙中存在IL-4可以维持促炎性和抗炎性骨髓细胞表型的微妙平衡[6]。
3 IL-4保护认知功能的机制有研究发现,缺乏T淋巴细胞的小鼠在MWM的学习任务中表现出认知障碍。通过转移接受野生型T细胞,或是将野生型小鼠骨髓移植给免疫缺陷的小鼠,那么免疫缺陷小鼠的MWM表现也能恢复至与野生型小鼠同一水平[7-9]。亦有实验已进一步确定CD4+T细胞主要负责成人神经发生和认知功能[8]。然而由于血脑屏障的受限,IL-4发挥的作用的机制尚不十分明确。但是,实验研究亦发现,野生型小鼠的星形胶质细胞对IL-4信号有反应,可能作为免疫效应细胞及神经应答之间的中介。对IL-4基因敲除小鼠进行MWM的训练后,星形胶质细胞产生的是脑源性神经营养因子(BDNF)[10]。
另一个可能的机制是IL-4可能通过脑膜巨噬细胞的抗炎M2偏斜(替代激活)发挥其作用,给予免疫缺陷的动物脑室内注射或静脉注射M2偏斜巨噬细胞,可以提高免疫缺陷动物的MWM表现[8]。
T细胞通过星形胶质细胞或通过M2巨噬细胞对这些认知过程产生的作用是分开的还是彼此联系的,尚待研究,但无论哪种情况,它们都为发生神经免疫交流提供了途径。
4 IL-4与阿尔茨海默病阿尔茨海默病(Alzheimer’s disease, AD)是神经退行性疾病。数年来,针对AD的研究很多,其中,对炎症在病理过程中发挥的作用,一直为许多研究的核心。IL-4在阿尔茨海默病的炎症病理过程中发挥着保护神经元、改善认知的作用。M1偏向的小胶质细胞活化可导致神经炎症,通常与特定脑区神经元的丧失有关,这是由于其产生的活性氧及其中间体引起的[11-14]。替代性的M2小胶质细胞可激活抗炎细胞因子,即IL-4(对于M2a小胶质细胞激活重要)和IL-10(对M2c重要)的释放[15]。
在研究中使用从人脐带间充质干细胞中分化出来的神经元样细胞(HUMSC-NCs)移植到AβPP/PS1小鼠中可改善小鼠的认知功能。在移植HUMSC-NCs的小鼠中,M2类小胶质细胞的激活显著增加,并且与M2类小胶质细胞相关的抗炎细胞因子IL-4的表达也增加了,而促炎细胞因子的表达与经典小胶质细胞(M1样小胶质细胞)相关,包括白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)明显降低。此外,Aβ降解因子,胰岛素降解酶(IDE)和中性溶酶(NEP)也有表达[16]。若将IL-4和IL-13利用脑内显微注射技术注入4.5或9个月大的APP23小鼠颅内,发现小鼠的Aβ水平降低,Morris水迷宫表现及学习记忆障碍均有改善。进行免疫组化分析发现,注射细胞因子后第2天,细胞因子可将非斑块形式的神经内和神经外Aβ肽降解和清除[17]。IL-4基因向APP的传递PS1小鼠抑制了胶质积累于海马,直接增强了神经发生,恢复了受损的空间学习,并减少了Aβ沉积[18]。IL-4或IL-10基因传递也可以逆转LPS诱导的大鼠海马LTP缺陷[18-19]。
除了致病机制方面的研究,IL-4亦是药物改善AD的一个重要因素,将Xanthoceraside给予脑室内注射Aβ小鼠口服,发现小鼠的认知行为功能有明显改善,反复用Xanthoceraside处理可显著抑制Aβ诱导的海马的炎症反应,这与IL-4 mRNA的表达增强有关[20]。二十碳五烯酸和γ-亚麻酸会增加海马中IL-4和IL-10的浓度,并消除脂多糖诱导的长期增强作用[21]。
5 IL-4与缺血性脑血管病在急性缺血性大脑中IL-4和IL-4受体(IL-4Rα)的表达增加[22],其机制可能是,在中风发生后,IL-4从受损神经元和周围免疫细胞中释放出来[23]。IL-4缺乏会在短暂的大脑中动脉闭塞(MCAO)后的急性期内加剧脑损伤和神经功能缺损[24],这也许意味着IL-4是中风后早期的内源性保护机制。还有报道发现IL-4的缺乏将严重损害缺血性损伤后的长期感觉运动和认知功能,而补充IL-4可以改善两种卒中模型的功能结局[25]。尽管IL-4缺乏增加了卒中急性期神经元组织的损失,但它并没有影响后期神经元组织的损失[26]。这些结果表明,IL-4对中风后神经功能的长期有益作用可能归因于其对非神经元细胞(如白细胞)的保护物质成分。
然而,IL-4对缺血性中风后白质完整性的潜在影响仍然不确定。但在目前已经发表的研究中可见,IL-4对于中风后白质修复至关重要。在卒中小鼠模型中将IL-4纳米粒子通过鼻腔内给药,极大地促进了少突胶质生成,增强了白质完整性并改善了长期功能恢复,经过IL-4处理的小鼠在Morris水迷宫测试中表现出长期的认知功能改善。其机制可能是IL-4对由PPARγ轴介导的少突胶质细胞分化直接有益的作用[25]。
慢性的脑灌注不足亦可导致认知功能的减退,将成年小鼠右侧单侧颈动脉闭塞,可观察到慢性脑灌注不足及脑白质缺血性改变,小鼠认知功能明显减退,脑内促炎性细胞因子(如IL-1β和IL-6)的水平明显增加,而抗炎性细胞因子(如IL-4和IL-10)水平则明显降低[26]。
6 IL-4与手术后认知功能障碍1955年,Bedford最初描述了术后认知功能下降[27],然而,至今该临床现象的定义和诊断标准尚未达成共识[28-29]。该疾病在老年人中以及在长时间的外科手术后最常见。有临床研究发现,冠脉搭桥术后7 d,患者认知功能明显下降,同时发现脑脊液中促炎性细胞因子IL-6水平明显升高,而术后6个月,患者认知功能渐趋好转,脑脊液中抗炎性细胞因子IL-4浓度显著增高[30]。对老年大鼠进行剖腹手术以模仿人类腹部手术。手术后,大鼠记忆和学习功能受损,海马组织中促炎性细胞因子(包括TNF-α、IL-1β,IL-4和IL-6)明显上调。然而,术中颅内注射TNF-α受体拮抗剂R-7050可减轻这些认知功能缺陷,并抑制海马组织中促炎性细胞因子的产生[31]。成年Sprague-Dawley雄性大鼠接受部分肝切除术,同时给予IL-4治疗,可发现IL-4的治疗下调了促炎细胞因子(例如IL-1β和IL-6)的表达,增加了脑中BDNF和突触素的水平,并改善了大鼠的认知行为表现[32]。
7 小结IL-4作为抗炎性细胞因子,在各类疾病中对认知功能的保护作用不容小觑。其保护作用发挥的通路及机制尚未完全阐述清晰,仍有许多疑问需要进一步探索。同时,作为一项认知功能修复的指征,脑内IL-4的高表达及其表达通路,可能可以作为改善认知功能的通路,成为药物治疗的靶点。
| [1] |
Howard M, Farrar J, Hilfiker M, et al. Identification of a T cell-derived b cell growth factor distinct from interleukin 2[J]. J Exp Med, 1982, 155(3): 914-923. DOI:10.1084/jem.155.3.914 |
| [2] |
Paul WE. History of interleukin-4[J]. Cytokine, 2015, 75(1): 3-7. |
| [3] |
Gadani SP, Cronk JC, Norris GT, et al. IL-4 in the brain:a cytokine to remember[J]. J Immunol, 2012, 189(9): 4213-4219. DOI:10.4049/jimmunol.1202246 |
| [4] |
Nelms K, Keegan AD, Zamorano J, et al. The IL-4 receptor:signaling mechanisms and biologic functions[J]. Annu Rev Immunol, 1999, 17: 701-738. DOI:10.1146/annurev.immunol.17.1.701 |
| [5] |
Lynch MA. Age-related neuroinflammatory changes negatively impact on neuronal function[J]. Front Aging Neurosci, 2010, 1: 6. |
| [6] |
Derecki NC, Cardani AN, Yang CH, et al. Regulation of learning and memory by meningeal immunity:a key role for IL-4[J]. J Exp Med, 2010, 207(5): 1067-1080. DOI:10.1084/jem.20091419 |
| [7] |
Ziv Y, Ron N, Butovsky O, et al. Immune cells contribute to the maintenance of neurogenesis and spatial learning abilities in adulthood[J]. Nat Neurosci, 2006, 9(2): 268-275. |
| [8] |
Wolf SA, Steiner B, Akpinarli A, et al. CD4-positive T lymphocytes provide a neuroimmunological link in the control of adult hippocampal neurogenesis[J]. J Immunol, 2009, 182: 3979-3984. DOI:10.4049/jimmunol.0801218 |
| [9] |
Morris R. Developments of a water-maze procedure for studying spatial learning in the rat[J]. J Neurosci Methods, 1984, 11: 47-60. DOI:10.1016/0165-0270(84)90007-4 |
| [10] |
Derecki NC, Cardani AN, Yang CH, et al. Regulation of learning and memory by meningeal immunity:a key role for IL-4[J]. J Exp Med, 2010, 207: 1067-1080. DOI:10.1084/jem.20091419 |
| [11] |
Gutteridge JM, Halliwell B. Iron toxicity and oxygen radicals[J]. Baillieres Clinl Haematol, 1989, 2(2): 195-256. DOI:10.1016/S0950-3536(89)80017-4 |
| [12] |
Domenico P, Syun S. Lipid peroxidation and oxidative imbalance:early functional events in Alzheimer's disease[J]. J Alzheimers Dis, 2004, 6(2): 171-175. DOI:10.3233/JAD-2004-6209 |
| [13] |
Praticò D, Uryu K, Leight S, et al. Increased lipid peroxidation precedes amyloid plaque formation in an animal model of Alzheimer amyloidosis[J]. J Neurosci, 2001, 21(12): 4183-4187. DOI:10.1523/JNEUROSCI.21-12-04183.2001 |
| [14] |
Varnum MM, Ikezu T. The classification of microglial activation phenotypes on neurodegeneration and regeneration in Alzheimer's disease brain[J]. Arch Immunol Ther Exp (Warsz), 2012, 60(4): 251-266. DOI:10.1007/s00005-012-0181-2 |
| [15] |
Yang H, Xie Z, Wei L, et al. Human umbilical cord mesenchymal stem cell-derived neuron-like cells rescue memory deficits and reduce amyloid-beta deposition in an AβPP/PS1 transgenic mouse model[J]. Stem Cell Res Ther, 2013, 4(4): 76. |
| [16] |
Kawahara K, Suenobu M, Yoshida A, et al. Intracerebral microinjection of interleukin-4/interleukin-13 reduces β-amyloid accumulation in the ipsilateral side and improves cognitive deficits in young amyloid precursor protein 23 mice[J]. Neuroscience, 2012, 207: 243-260. DOI:10.1016/j.neuroscience.2012.01.049 |
| [17] |
Kiyota T, Okuyama S, Swan RJ, et al. CNS expression of anti-inflammatory cytokine interleukin-4 attenuates Alzheimer's disease-like pathogenesis in APP+PS1 bigenic mice[J]. FASEB J, 2010, 24(8): 3093-3102. DOI:10.1096/fj.10-155317 |
| [18] |
Lynch AM, Walsh C, Delaney A, et al. Lipopolysaccharide-induced increase in signalling in hippocampus is abrogated by IL-10——a role for IL-1 beta[J]. J Neurochem, 2004, 88(3): 635-646. DOI:10.1046/j.1471-4159.2003.02157.x |
| [19] |
Nolan Y, Maher FO, Martin DS, et al. Role of interleukin-4 in regulation of age-related inflammatory changes in the hippocampus[J]. J Biol Chem, 2005, 280(10): 9354-9362. DOI:10.1074/jbc.M412170200 |
| [20] |
Lu P, Mamiya T, Lu L, et al. Xanthoceraside attenuates amyloid β peptide25-35-induced learning and memory impairments in mice[J]. Psychopharmacology (Berl), 2012, 219(1): 181-190. |
| [21] |
Kavanagh T, Lonergan PE, Lynch MA. Eicosapentaenoic acid and gamma-linolenic acid increase hippocampal concentrations of IL-4 and IL-10 and abrogate lipopolysaccharide-induced inhibition of long-term potentiation[J]. Prostaglandins Leukot Essent Fatty Acids, 2004, 70(4): 391-397. DOI:10.1016/j.plefa.2003.12.014 |
| [22] |
Liu X, Liu J, Zhao S, et al. Interleukin-4 Is Essential for Microglia/Macrophage M2 Polarization and Long-Term Recovery After Cerebral Ischemia[J]. Stroke, 2016, 47(2): 498-504. |
| [23] |
Zhao X, Wang H, Sun G, et al. Neuronal Interleukin-4 as a Modulator of Microglial Pathways and Ischemic Brain Damage[J]. J Neurosci, 2015, 35(32): 11281-11291. DOI:10.1523/JNEUROSCI.1685-15.2015 |
| [24] |
Xiong X, Barreto GE, Xu L, et al. Increased brain injury and worsened neurological outcome in interleukin-4 knockout mice after transient focal cerebral ischemia[J]. Stroke, 2011, 42(7): 2026-2032. DOI:10.1161/STROKEAHA.110.593772 |
| [25] |
Zhang Q, Zhu W, Xu F, et al. The interleukin-4/PPARγ signaling axis promotes oligodendrocyte differentiation and remyelination after brain injury[J]. PLoS Biol, 2019, 17(6): e3000330. DOI:10.1371/journal.pbio.3000330 |
| [26] |
Chui HC. Subcortical ischemic vascular dementia[J]. Neurol Clin, 2007, 25(3): 717-740. |
| [27] |
Bedford PD. Adverse cerebral effects of anaesthesia on old people[J]. Lancet, 1955, 269(6884): 259-263. |
| [28] |
Crosby G, Culley DJ. Surgery and anesthesia:healing the body but harming the brain[J]. Anesth Analg, 2011, 112(5): 999-1001. DOI:10.1213/ANE.0b013e3182160431 |
| [29] |
Evered L, Scott DA, Silbert B, et al. Postoperative cognitive dysfunction is independent of type of surgery and anesthetic[J]. Anesth Analg, 2011, 112(5): 1179-1185. DOI:10.1213/ANE.0b013e318215217e |
| [30] |
Kálmán J, Juhász A, Bogáts G, et al. Elevated levels of inflammatory biomarkers in the cerebrospinal fluid after coronary artery bypass surgery are predictors of cognitive decline[J]. Neurochem Int, 2006, 48(3): 177-180. DOI:10.1016/j.neuint.2005.10.007 |
| [31] |
Ma Y, Cheng Q, Wang E, et al. Inhibiting tumor necrosis factor-α signaling attenuates postoperative cognitive dysfunction in aged rats[J]. Mol Med Rep, 2015, 12(2): 3095-3100. |
| [32] |
Li Z, Liu F, Ma H, et al. Age exacerbates surgery-induced cognitive impairment and neuroinflammation in Sprague-Dawley rats:the role of IL-4[J]. Brain Res, 2017, 1665: 65-73. DOI:10.1016/j.brainres.2017.04.004 |
 2020, Vol. 47
2020, Vol. 47