扩展功能
文章信息
- 袁姣, 廖巧, 卢可, 曾倩倩, 周瑾瑕, 毕方方
- YUAN Jiao, LIAO Qiao, LU Ke, ZENG Qian-Qian, ZHOU Jin-Xia, BI Fang-Fang
- 电子转移黄素蛋白脱氢酶基因突变所致的核黄素反应性脂质沉积性肌病的临床、病理和基因特征分析
- Clinical, pathological, and genetic features of riboflavin responsive multiple acyl-CoA dehydrogenation deficiency caused by electron transfer flavoprotein dehydrogenase mutation
- 国际神经病学神经外科学杂志, 2020, 47(3): 310-314
- Journal of International Neurology and Neurosurgery, 2020, 47(3): 310-314
-
文章历史
收稿日期: 2020-03-07
修回日期: 2020-06-13
多种酰基辅酶A脱氢缺陷(multiple acyl CoA dehydrogenation deficiency, MADD),是一种罕见的肌肉疾病,往往由电子转移黄素蛋白(electron transfer flavin protein, ETF)或电子转移黄素蛋白脱氢酶(electron transfer flavin protein dehydrogenation, ETFDH)基因突变引起,主要表现为脂肪酸氧化和氨基酸代谢障碍,又称戊二酸尿症Ⅱ型(glutaric aciduria type 2, GAII)[1]。MADD具有临床异质性,依发病时间不同可分为新生儿先天性伴或不伴异常和晚发型两大类[2]。后者对核黄素治疗效果较好,故也称之为核黄素反应性脂质沉积性肌病(riboflavin responsive-multiple acyl-CoA dehydrogenation deficiency, RR-MADD)。RR-MADD的主要临床症状包括波动性肌无力、肌肉疼痛、低血糖、代谢性酸中毒和肝肿大,少数患者偶可累及心脏和胃肠道,出现相应的临床表现[3]。到目前为止,全世界约有700例RR-MADD患者,基因检测结果显示其中523例由ETFDH基因突变所导致[1]。在我国,RR-MADD有较高的发病率[4-5]。在此,本研究对2009年至2019年在我院就诊经肌肉活检和基因检测确诊为ETFDH突变的15例RR-MADD患者,其临床表现、肌电图、肌肉病理和血尿质谱筛查、基因测序结果总结如下。旨在提高临床医生对RR-MADD的认识,及早做出诊断并早期治疗,从而改善预后。
1 研究对象的临床资料 1.1 一般资料15例患者中男性8例,女性7例,男女发病比例相当,约为1.14 :1;发病年龄14~52岁,平均年龄(28.27±13.52)岁;病程2月~18年,平均病程44.7月。所有患者均无特殊家族史可询。见表 1。
| 编 号 |
性 别 |
起病年 龄(岁) |
病 程 |
首发症状及体征 | 辅助检查 | ||||||
| 首发症状 | 肌力 | CK(U/L) | LDH(U/L) | 肌电图 | 血尿质谱筛查 | 基因筛查 | |||||
| 1 | 女 | 34 | 6月 | 双下肢无力 | 4级 | 244.6 | 220.3 | 肌源性损害 | 血多种中长链酰基肉碱↑,尿有机酸无异常 | 纯合突变 | |
| 2 | 女 | 15 | 7年 | 运动后四肢乏力 | 4级 | 297.7 | 690 | 肌源性损害 | 血游离肉碱↓,伴多种长链酰基肉碱↑,尿有机酸无异常 | 纯合突变 | |
| 3 | 男 | 25 | 1年 | 四肢乏力 | 4级 | 180.1 | 314 | 肌源性损害 | 血多种氨基酸↑,尿有机酸无异常 | 纯合突变 | |
| 4 | 男 | 41 | 1年 | 四肢乏力 | 5-级 | 542.5 | 383.3 | 肌源性损害 | 血多种中长链酰基肉碱↑,尿乳酸及丙酮酸↑ | 单一杂合突变 | |
| 5 | 男 | 51 | 6月 | 四肢乏力、抬头无力伴咀嚼乏力乏力 | 4级 | 219.7 | 232.4 | 肌源性损害 | 血多种酰基肉碱↑,尿有机酸无异常 | 单一杂合突变 | |
| 6 | 男 | 45 | 5年 | 四肢无力 | 5-级 | 607.2 | 561 | 正常 | 未查 | 单一杂合突变 | |
| 7 | 男 | 30 | 17年 | 反复双下肢水肿、无力 | 5级 | 4 854.2 | 1 657.3 | 肌源性损害 | 血丙氨酸↑,尿乳酸及丙酮酸↑ | 单一杂合突变 | |
| 8 | 男 | 32 | 9月 | 四肢乏力、肌痛 | 5-级 | 272.7 | 452 | 肌源性损害 | 未查 | 单一杂合突变 | |
| 9 | 男 | 51 | 6月 | 双下肢无力,腰腹部束带感 | 4级 | 487.9 | 374 | 肌源性+神经源性损害 | 血多种酰基肉碱↑,尿乙基丙二酸、3- 羟基戊二酸及庚二酸↑ |
单一杂合突变 | |
| 10 | 女 | 14 | 1年 | 双下肢乏力 | 5-级 | 3 144.2 | 1 101 | 肌源性损害 | 血多种酰基肉碱增高,尿乙基丙二酸、3- 羟基戊二酸及庚二酸↑,复查后均↓ |
复合杂合突变 | |
| 11 | 女 | 17 | 18年 | 反复四肢无力、疼痛 | 5-级 | 752.9 | 493.3 | 肌源性+神经源性损害 | 未查 | 复合杂合突变 | |
| 12 | 男 | 15 | 2年 | 反复四肢乏力 | 4级 | 230.4 | 555 | 肌源性损害 | 未查 | 复合杂合突变 | |
| 13 | 女 | 14 | 2月 | 双下肢肌肉酸痛、乏力 | 4级 | 1 558 | 1 178 | 肌源性损害 | 未查 | 复合杂合突变 | |
| 14 | 女 | 20 | 10月 | 双小腿胀痛 | 5-级 | 2 307.7 | 2 312.1 | 肌源性损害 | 未查 | 复合杂合突变 | |
| 15 | 男 | 20 | 8月 | 双下肢乏力 | 4级 | 2 551 | 1 404.4 | 肌源性损害 | 游离肉碱↓,尿有机酸无异常 | 复合杂合突变 | |
| 注:↑表示升高,↓表示降低 | |||||||||||
14例患者(93.3%)为亚急性起病,病程3月~18年,症状呈波动性;有1例患者(6.7%)为急性起病,病程2月。15例患者首发症状均为肢体无力,其中四肢起病者8例(53.3%),双下肢起病者7例(46.7%),1例合并抬头无力和咀嚼肌乏力,1例合并双下肢反复水肿,1例合并腰腹部束带感,3例合并双下肢酸痛。查体发现患者肌力下降并不明显,8例肌力在4级及以下,7例肌力均接近正常。见表 1。
1.3 实验室及肌电图检查15例患者均存在心肌酶学异常,其中CK波动在219.7~4 854.2 U/L之间,平均(1 290.76±1 419.01)U/L,LDH波动在314~2 312.1 U/L之间,平均(882.72±610.12)u/L。
电生理检查发现80%呈肌源性损害,13.3%为肌源性合并神经源性损害,6.7%结果正常。见表 1。
1.4 尿有机酸及血清酰基肉碱测定9例患者完善尿有机酸筛查,其中2例提示尿乙基丙二酸、3-羟基戊二酸及庚二酸增高,2例尿乳酸及丙酮酸增高,其余5例结果无异常。该9例患者同时完善了血清酰基肉碱测定,其中5例提示血清多种酰基肉碱增高(55.6%),2例血清中氨基酸增高(22.2%),1例血清游离肉碱降低(11.1%),1例血清多种酰基肉碱增高合并游离肉碱降低(11.1%)。见表 1。
1.5 基因检测结果15例患者均存在ETFDH基因不同位点的突变,其中3例为纯合突变,6例为复合杂合突变,6例为单一杂合突变。共检出17种突变,包括12种错义突变,2种无义突变,2种剪切突变,1种重复突变,位于外显子2、3、7、8、10、11、12、13(表 2)。最常见的突变为c.A1193G(4/15,26.7%),导致相应位点氨基酸发生变化:p.K398R。该位点已有文献报道[4],与RR-MADD相关但致病性不明确。基因检测为纯合突变的患者(编号1~3)其CK平均值为240.8 U/L,LDH平均值为408.1 U/L;相比单一杂合突变患者(编号4~9)CK平均值为1164 U/L,LDH平均值为610 U/L;复合杂合突变患者(编号10~15)CK平均值为1575.3 U/L,LDH平均值为1173.9 U/L。见表 1、表 2。
| 编号 | 突变类型 | 外显子 | 突变位点1 | 氨基酸变化1 | 外显子 | 突变位点2 | 氨基酸变化2 |
| 1 | 纯合突变 | 3 | c.250G>A | p.A84T | 3 | c.250G>A | p.A84T |
| 2 | 纯合突变 | 10 | c.A1193G | p.K398R | 10 | c.A1193G | p.K398R |
| 3 | 纯合突变 | 10 | c.A1193G | p.K398R | 10 | c.A1193G | p.K398R |
| 4 | 单一杂合突变 | 10 | c.A1193G | p.K398R | / | / | / |
| 5 | 单一杂合突变 | 11 | c.1395T>G | p.Y465X | / | / | / |
| 6 | 单一杂合突变 | 12 | c.1550-3C>G | splicing | / | / | / |
| 7 | 单一杂合突变 | 3 | c.360dupT | p.D120fs | / | / | / |
| 8 | 单一杂合突变 | 8 | c.1010A>G | p.K337R | / | / | / |
| 9 | 单一杂合突变 | 11 | c.1436G>C | p.R479T | / | / | / |
| 10 | 复合杂合突变 | 3 | c.G353T | p.C118F | 8 | c.C920G | p.S307C |
| 11 | 复合杂合突变 | 3 | c.389A>T | p.D130V | 11 | c.1399G>C | p.G467R |
| 12 | 复合杂合突变 | 7 | c.770A>G | p.Y257C | 13 | c.1691-3C>G | splicing |
| 13 | 复合杂合突变 | 10 | c.1174A>G | p.M392V | 10 | c.1193A>G | p.K398R |
| 14 | 复合杂合突变 | 2 | c.152G>A | p.R51Q | 11 | c.1450T>C | p.W484R |
| 15 | 复合杂合突变 | 10 | c.1227A>C | p.L409F | 11 | c.1399G>C | p.G467R |
15例患者均行肌肉活检,活检部位为肱二头肌。光镜下可见肌纤维大小基本一致,未见明显变性、坏死和再生肌纤维,HE染色下可见肌纤维内许多圆形或类圆形空泡,ORO染色见部分肌纤维内脂滴不同程度增多,Gomori染色未见破碎红纤维,COX染色未见酶活性缺失,PAS染色均无异常,SDH染色14例正常(93.3%),1例异常(6.7%)。ATP染色11例表现为两型肌纤维正常分布(73.3%),3例萎缩肌纤维多为Ⅰ型(20%),1例为Ⅰ型纤维优势(6.7%)。病理图片详见图 1~图 4(来自2号患者)。
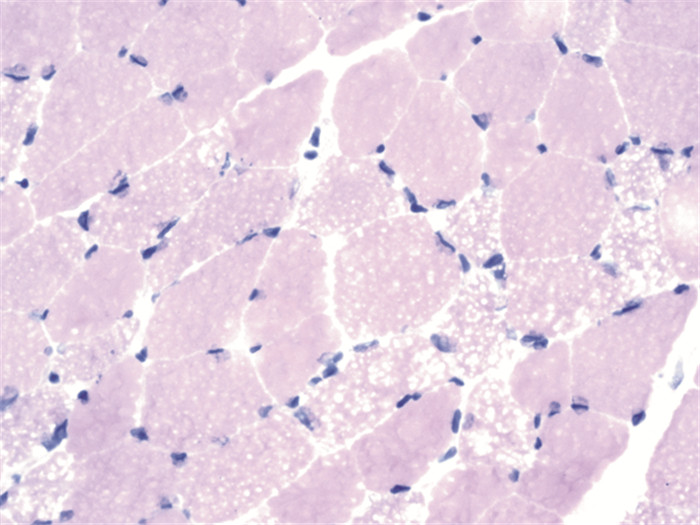
|
| 图 1 可见肌纤维内许多圆形或类圆形空泡(×400,HE染色) |
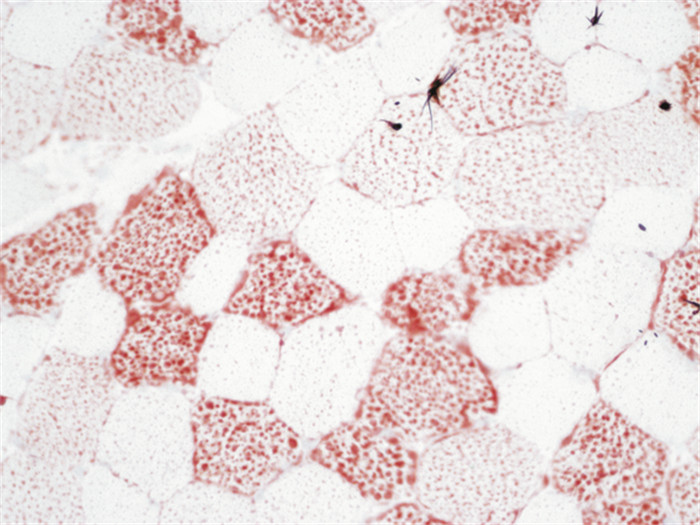
|
| 图 2 可见空泡肌纤维内脂滴积聚(×400,ORO染色) |
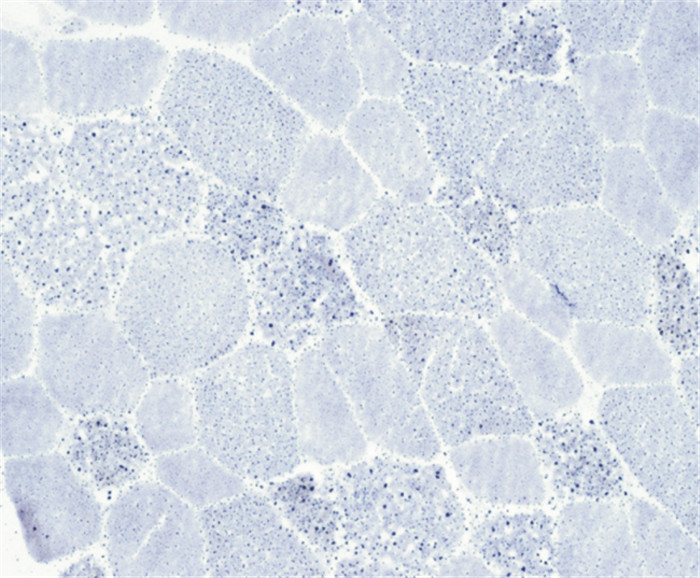
|
| 图 3 未见酶活性缺失,但部分肌纤维内可见深染颗粒(×400,COX染色) |
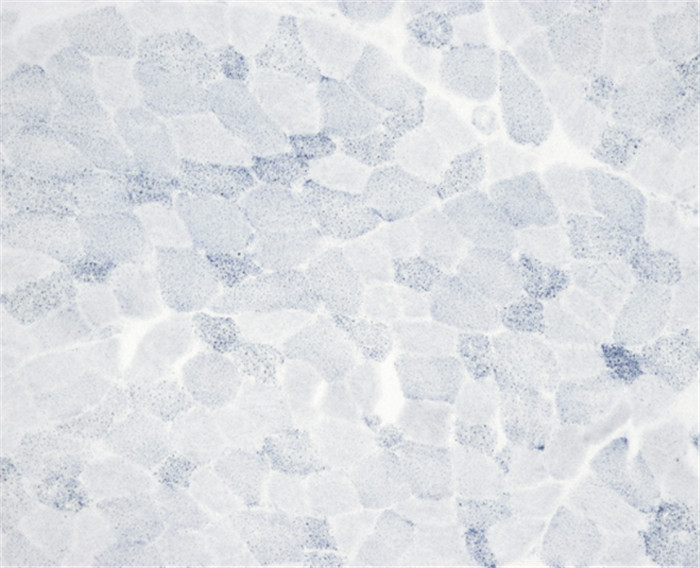
|
| 图 4 未见酶活性缺失(×200,SDH染色) |
绝大部分RR-MADD患者对维生素B2治疗有明显的效果[6-7],本研究的15例患者中有14例对核黄素反应敏感。其中2例在发作期加用小剂量激素,治疗效果良好。对患者进行随访发现,患者联合服用维生素B2、左卡尼汀、艾地苯醌、甲钴胺和胞磷胆碱钠疗效较好,症状完全缓解未再有发作。
2 讨论RR-MADD患者肌活检表现为典型的脂质沉积样病理改变,HE染色可见肌纤维内有许多大小不等的空泡,油红染色证实为空泡为脂滴积聚[8]。本组患者中,脂滴轻-中度增多者共7例,中-重度增多者8例。这两个亚组中患者的CK水平既有显著上升者,也有接近正常者,提示此类患者的肌肉病变严重程度与CK值的多少无明显相关性,国内一项研究也得出了类似结论[9]。例7、10、13、14、15这几位患者的CK及LDH水平显著升高,但活检时却没有见到明显坏死和变性的肌纤维,说明RR-MADD患者肌酶明显增加的原因可能在于代谢异常引起细胞渗透性改变,肌酶漏出至肌纤维外,而并非均为肌纤维坏死所致[10]。
本组患者主要临床表现为反复肢体无力,肌酶水平升高和肌电图异常提示存在肌肉损害,肌活检证实为LSM,进一步完善基因检测明确其亚型为RR-MADD。尽管其中有6例患者为ETFDH基因单一杂合突变,但其血清中多种酰基肉碱增高,并且这些患者对核黄素治疗效果好,亦符合RR-MADD的诊断。分析这15例患者基因检测结果及实验室化验指标,发现杂合突变患者的肌酶水平较纯合突变患者明显升高,并且大多数复合杂合突变患者其CK、LDH水平比单一杂合突变患者更高(此处除外单一杂合突变患者例7,其病程长达17年,CK、LDH显著上升)。其他有关RR-MADD患者的研究[9]也发现,杂合突变患者的CK水平明显高于正常上限。有学者提出,ETFDH基因突变类型往往影响临床症状的严重程度,发生无义突变、框移突变和剪切突变时临床表现更重,而发生错义突变、插入突变以及小片段缺失突变时则临床表现较轻[11-12]。那么,基因突变类型与肌酶水平之间是否也存在类似关联呢?本组中复合杂合突变患者的突变类型多为错义突变,但其肌酶损害却较为明显。可见,RR-MADD患者肌酶水平与其基因突变类型不一定相关。当然,还需更多的样本量来加以验证。
液相色谱-串联质谱技术(liquid chromatography-tandem mass spectrometry, LC-MS/MS)是近几年兴起的新技术之一,多用于遗传代谢疾病的筛查与诊断,具有经济、迅速、准确、检测种类多等优点[12]。本研究通过LC-MS/MS技术对其中9例RR-MADD患者进行血、尿质谱分析,发现4例患者尿有机酸成分异常,7例患者血清酰基肉碱水平异常,后者的阳性检出率高于前者。而国内关于新生儿遗传代谢病的大型研究[13]则发现,血液串联质谱检测和尿有机酸分析的阳性率基本一致。导致这一差异的原因可能在于:一、样本量小带来的误差,本研究仅9例患者完善血尿质谱筛查;二、此技术易受多种因素(如药物、饮食以及是否处于发作急性期等)的干扰,出现假阳性或假阴性结果,从而影响判断[14]。因此,血、尿质谱筛查结果可用于疾病的辅助诊断,但还需结合临床表现和基因检测等进一步鉴别。
总之,对于脂质沉积性肌病患者,肌肉活检的病理改变是诊断基础,基因检测可在分子水平对其进行遗传学归类,血尿质谱筛查则明确其生化分型,从而做出精确且具体的诊断。这对RR-MADD患者尤为重要,因为此类患者对核黄素治疗十分敏感,正确的诊断和及时的治疗可使其明显获益。
| [1] |
Vasiljevski ER, Summers MA, Little DG, et al. Lipid storage myopathies:current treatments and future directions[J]. Prog Lipid Res, 2018, 72: 1-17. DOI:10.1016/j.plipres.2018.08.001 |
| [2] |
Chokchaiwong S, Kuo YT, Hsu SP, et al. ETF-QO Mutants Uncoupled Fatty Acid β-Oxidation and Mitochondrial Bioenergetics Leading to Lipid Pathology[J]. Cells, 2019, 8(2): 106. DOI:10.3390/cells8020106 |
| [3] |
Fan X, Xie B, Zou J, et al. Novel ETFDH mutations in four cases of riboflavin responsive multiple acyl-CoA dehydrogenase deficiency[J]. Mol Genet Metabol Rep, 2018, 16: 15-19. DOI:10.1016/j.ymgmr.2018.05.007 |
| [4] |
Xi J, Wen B, Lin J, et al. Clinical features and ETFDH mutation spectrum in a cohort of 90 Chinese patients with late-onset multiple acyl-CoA dehydrogenase deficiency[J]. J Inherit Metabol Dis, 2014, 37(3): 399-404. DOI:10.1007/s10545-013-9671-6 |
| [5] |
Wang ZQ, Chen XJ, Murong SX, et al. Molecular analysis of 51 unrelated pedigrees with late-onset multiple acyl-CoA dehydrogenation deficiency (MADD) in southern China confirmed the most common ETFDH mutation and high carrier frequency of c. 250G>[J]. J Mol Med, 2011, 89(6): 569-576. DOI:10.1007/s00109-011-0725-7 |
| [6] |
Liu XY, Wang ZQ, Wang DN, et al. A Historical Cohort Study on the Efficacy of Glucocorticoids and Riboflavin Among Patients with Late-onset Multiple Acyl-CoA Dehydrogenase Deficiency[J]. Chin Med J (Engl), 2016, 129(2): 142-146. DOI:10.4103/0366-6999.173438 |
| [7] |
中华医学会神经病学分会, 中华医学会神经病学分会神经肌肉病学组, 中华医学会神经病学分会肌电图及临床神经生理学组. 中国脂质沉积性肌病诊治专家共识[J]. 中华神经科杂志, 2015, 48(11): 941-945. DOI:10.3760/cma.j.issn.1006-7876.2015.11.003 |
| [8] |
焉传祝, 温冰. 脂肪沉积性肌病[J]. 中华神经科杂志, 2019, 52(2): 127-132. DOI:10.3760/cma.j.issn.1006-7876.2019.02.009 |
| [9] |
朱敏, 洪道俊, 万慧.江西地区核黄素反应性脂质沉积性肌病的临床和电子转移黄素蛋白脱氢酶基因突变特点[C].江西省中西医结合学会神经科专业委员会.江西省第六次中西医结合神经科学术交流会论文集.江西省中西医结合学会神经科专业委员会: 江西省中西医结合学会, 2013, 121-122.
|
| [10] |
刘明生, 崔丽英, 徐丹, 等. 脂质沉积性肌病患者肌电图与肌力和肌酸磷酸激酶的相关性[J]. 中华神经科杂志, 2014, 47(6): 392-395. DOI:10.3760/cma.j.issn.1006-7876.2014.06.008 |
| [11] |
王伟青, 李文杰. 多种酰基辅酶A脱氢酶缺乏症发病机制与诊疗研究进展[J]. 中国优生与遗传杂志, 2019, 27(3): 257-260. |
| [12] |
戚莉君, 张金, 郭军红. 多种酯酰辅酶A脱氢酶缺乏症基因型与表现型关系研究进展[J]. 中华临床医师杂志(电子版), 2016, 10(19): 2921-2924. DOI:10.3877/cma.j.issn.1674-0785.2016.19.019 |
| [13] |
卢东裕, 计娓娓, 常海涛, 等. 6137例临床患儿遗传代谢病串联质谱及气相色谱质谱数据分析[J]. 中国优生与遗传杂志, 2017, 25(9): 18-21. |
| [14] |
吴鼎文, 芦斌, 杨建滨, 等. 3-羟基异戊酰基肉碱代谢异常新生儿遗传学分析[J]. 浙江大学学报(医学版), 2019, 48(4): 390-396. |
 2020, Vol. 47
2020, Vol. 47




