扩展功能
文章信息
- 马肃, 李涵, 王文宗
- MA Su, LI Han, WANG Wen-Zong
- 结合珠蛋白作为急性脑梗死患者预后标志物的研究
- Haptoglobin level as a prognostic marker for patients with acute cerebral infarction
- 国际神经病学神经外科学杂志, 2020, 47(3): 268-271
- Journal of International Neurology and Neurosurgery, 2020, 47(3): 268-271
-
文章历史
收稿日期: 2019-09-16
修回日期: 2020-05-22
急性脑梗死是一种由粥样硬化性狭窄、血栓形成、栓塞性梗阻引起的神经系统疾病[1]。该病症状、病情程度和预后取决于梗死灶的位置、数目和大小[2]。据统计,约三分之一的急性脑梗死患者会因病死亡[3]。大量研究表明炎症在该病的发生和发展中起着至关重要的作用[4]。结合珠蛋白(haptoglobin, Hp)是一种急性时相反应蛋白,具有Hp1-1、Hp2-1、Hp2-2 3种表型,在炎症状态下血浆水平显著升高[5]。有研究证实,高血浆Hp水平提示非小细胞肺癌、卵巢癌、结直肠癌等恶性肿瘤患者的不良预后[6-7]。此外,血浆Hp还与心肌梗死、中风和充血性心力衰竭等疾病的发生密切相关[8]。然而,血浆Hp水平是否可作为急性脑梗死患者预后的标志物,目前尚缺乏相关研究报道。本研究收集100例急性脑梗死患者的临床资料,以探讨血浆Hp水平与急性脑梗死患者预后的关系,为急性脑梗死患者预后评估提供依据。
1 对象与方法 1.1 研究对象选择2013年1月至2014年12月来我院接受治疗的急性脑梗死患者100例(病例组)和100例健康体检者(对照组)。病例组男75例,女25例;年龄55~70岁,平均年龄为(62.52±7.26)岁;体重指数(body mass index, BMI) 23~29 kg/m2,平均值为(26.12±2.16)kg/m2。对照组男70例,女30例;年龄55~71岁,平均年龄为(63.03±7.05)岁;BMI 24~29 kg/m2,平均值为(26.33±2.09)kg/m2。两组患者在性别、年龄、BMI方面比较,差异无统计学意义(P>0.05),研究对象具有可比性。
本研究获得我院医学伦理委员会批准(审批号:YL-2017-028),且所有研究对象均知情同意。
1.2 纳入和排除标准纳入标准:①急性脑梗死患者符合2015年中华医学会神经病学分会制定的《中国脑血管病一级预防指南》诊治标准[9],经头部CT或磁共振成像证实;②颈动脉超声检查发现由动脉粥样硬化所致的相关血管狭窄(>50%)或闭塞;③发病至入院时间 < 36 h;④既往无脑梗死史;⑤无其他脏器严重疾病;⑥由患者或直系亲属知情同意并签署知情同意书,提供患者的详细资料。
排除标准:①出血性卒中;②硬脑膜下血肿;③恶性肿瘤;④颅内感染或急慢性感染;⑤既往有手术治疗史;⑥其他中枢神经系统疾病、自身免疫系统疾病、凝血功能障碍、代谢性疾病;⑦听力及语言障碍;⑧治疗或住院期间死亡。
1.3 研究方法收集并记录入组者的性别、年龄、身高、体重、吸烟史、嗜酒史、糖尿病、高血压、高脂血症、心绞痛、心肌梗死等临床资料。BMI=体重(kg)÷身高(m)2。吸烟史定义为吸烟≥1支/d,持续时间≥1年。嗜酒史定义为饮入酒精含量≥50 g/d,持续时间≥1年。
采集患者入院后第2天清晨空腹静脉血5~10 mL,3 000转/min离心20 min后分离血清、血浆,-80℃冰箱中保存待测。应用美国Beckman公司生产Hp试剂盒,采用双光路免疫浊度分析仪检测血浆Hp水平。Hp表型检测方法:收集的患者血清和50%的血红蛋白按照19 :1比例混合,加入其1/2体积的蔗糖溶液待检;采用Chelex-100法提取DNA;凝胶制备,电泳分离,电泳结束后将凝胶放入联苯胺染色液中,加入30%过氧化氢显谱10 min,谱带清晰后判断Hp表型。
采用电话或患者入院就诊的方式每半年随访1次。定义患者确诊时间为研究起始点,最后一次随访记录作为研究终点,随访至2018年8月31日。
1.4 统计学分析应用SPSS 22.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用t检验;计数资料以例(%)表示,组间比较采用χ2检验。采用受试者工作特征(ROC)曲线筛选切点,计算曲线下面积评估参数预测效力。采用Kaplan-Meier法绘制生存曲线,利用Log-Rank法进行差异性检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 病例组和对照组临床资料比较病例组和对照组在性别、年龄、BMI、嗜酒史、高脂血症、心肌梗死、血红蛋白、Hp表型方面比较,差异无统计学意义(P>0.05)。病例组中吸烟史、糖尿病、高血压、心绞痛、血浆Hp水平高于对照组,差异有统计学意义(P < 0.05)。病例组患者3年总死亡率59%(59/100)。见表 1。
| 指标 | 病例组(n=100) | 对照组(n=100) | t/χ2值 | P值 |
| 性别(男/女) | 75/25 | 70/30 | 0.63 | 0.43 |
| 年龄(岁) | 62.52±7.26 | 63.03±7.05 | 0.50 | 0.61 |
| BMI(kg/m2) | 26.12±2.16 | 26.33±2.09 | 0.70 | 0.49 |
| 吸烟史 | 32(32) | 10(10) | 14.59 | < 0.01 |
| 嗜酒史 | 20(20) | 16(16) | 0.54 | 0.46 |
| 糖尿病 | 28(28) | 13(13) | 6.90 | 0.01 |
| 高血压 | 40(40) | 21(21) | 8.52 | < 0.01 |
| 高脂血症 | 38(38) | 34(34) | 0.35 | 0.56 |
| 心绞痛 | 20(20) | 8(8) | 5.98 | 0.01 |
| 心肌梗死 | 8(8) | 6(6) | 0.31 | 0.58 |
| 血红蛋白(g/L) | 141.23±15.33 | 142.06±15.67 | 0.38 | 0.71 |
| Hp表型 | ||||
| Hp1-1 | 7(7) | 8(8) | 0.07 | 0.79 |
| Hp2-1 | 40(40) | 36(36) | 0.34 | 0.56 |
| Hp2-2 | 53(53) | 56(56) | 0.18 | 0.67 |
| 血浆Hp(μg/L) | 325.65±74.03 | 170.45±38.56 | -18.59 | < 0.01 |
ROC曲线结果显示,血浆Hp预测急性脑梗死患者3年死亡事件发生的最佳截断值为275.25 μg/L。对应的曲线下面积为0.821(0.802~0.854),敏感度为61.55%,特异度为80.05%(P < 0.05)。见图 1。
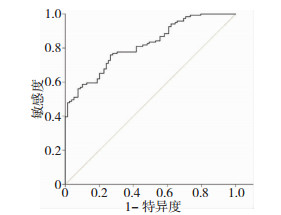
|
| 图 1 血浆Hp预测急性脑梗死患者3年死亡事件发生的ROC曲线 |
血浆Hp≥275.25 μg/L组与血浆Hp < 275.25 μg/L组患者在性别、年龄、BMI、吸烟史、嗜酒史、糖尿病、高脂血症、心绞痛、血红蛋白、Hp2-2表型数比较,差异无统计学意义(P>0.05)。血浆Hp≥275.25 μg/L组中高血压、心肌梗死、Hp2-1表型数、血浆Hp水平、3年总死亡率高于血浆Hp < 275.25 μg/L组,差异有统计学意义(P < 0.05);而Hp1-1表型数低于血浆Hp < 275.25 μg/L组,差异有统计学意义(P < 0.05)。见表 2。
| 指标 | 血浆Hp≥275.25μg/L组(n=60) | 血浆Hp < 275.25μg/L组(n=40) | t/χ2值 | P值 |
| 性别(男/女) | 47/13 | 28/12 | 0.89 | 0.35 |
| 年龄(岁) | 62.33±7.15 | 62.61±7.51 | 0.19 | 0.85 |
| BMI(kg/m2) | 26.22±2.03 | 26.01±2.19 | -0.48 | 0.63 |
| 吸烟史 | 20(33.3) | 12(30) | 0.12 | 0.73 |
| 嗜酒史 | 14(23.3) | 6(15) | 1.04 | 0.31 |
| 糖尿病 | 16(26.7) | 12(30) | 0.13 | 0.72 |
| 高血压 | 32(53.3) | 8(20) | 11.11 | < 0.01 |
| 高脂血症 | 22(36.7) | 16(40) | 0.11 | 0.74 |
| 心绞痛 | 12(20) | 8(20) | 0 | 1 |
| 心肌梗死 | 8(13.3) | 0(0) | 5.80 | 0.02 |
| 血红蛋白(g/L) | 140.55±14.93 | 142.06±15.29 | 0.49 | 0.63 |
| Hp表型 | ||||
| Hp1-1 | 1(1.67) | 6(15) | 6.56 | 0.02 |
| Hp2-1 | 32(53.3) | 8(20) | 11.11 | < 0.01 |
| Hp2-2 | 30(50) | 23(57.5) | 0.54 | 0.46 |
| 血浆Hp(μg/L) | 360.25±81.44 | 226.98±43.58 | -10.62 | < 0.01 |
| 3年总死亡 | 48(80) | 11(27.5) | 27.35 | < 0.01 |
Kaplan-Meier法生存曲线结果显示,血浆Hp≥275.25 μg/L组患者3年总死亡率显著高于血浆Hp < 275.25 μg/L组,差异有统计学意义(P < 0.05)。见图 2。
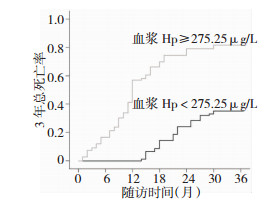
|
| 图 2 不同血浆Hp浓度组别患者3年总死亡率比较 |
急性脑梗死若在发病早期或发病入院后进行针对性治疗,可有效缓解病情进展[10]。在临床研究中生物学标志物是指能够反映疾病状态和严重程度、可客观检测的某些特征性指标。特异性生物标志物对急性脑梗死的病情诊断、疗效评估及预后判断具有重要作用。近年来,关于急性脑梗死患者预后生物标志物的研究也成为了临床研究热点。
Hp是一种急性时相反应蛋白,在感染、组织损伤、肿瘤等多种炎症过程中表达水平升高[5-9]。该蛋白的主要功能是结合从红细胞中释放的游离血红蛋白,减弱其在人体内的氧化活性及对肾脏的损伤;直接抑制低密度脂蛋白的氧化过程[12]。既往关于血浆Hp与脑血管病的研究主要集中在Hp表型与脑血管病患者预后之间的关系[11],而血浆Hp水平对这些患者预后的影响尚不清楚。
本研究发现,急性脑梗死患者血浆Hp水平高于对照组。ROC曲线分析显示这些患者的血浆Hp水平与3年总死亡事件发生相关,并且血浆Hp水平的最佳截断值为275.25 μg/L。根据血浆Hp水平分组发现,血浆Hp≥275.25 μg/L组患者3年总死亡率高于血浆Hp < 275.25 μg/L组。此外,Kaplan-Meier生存分析还发现,高Hp水平的患者3年总死亡率与低Hp水平的患者相比较高。因此,血浆Hp水平有可能作为预测急性脑梗死患者预后的重要生物标志物。
既往研究表明,脑损伤后Hp升高的主要合成器官是肝脏[12]。虽然Hp可以不可逆地结合血液中的游离血红蛋白,但血浆Hp水平的升高并不意味着溶血或出血的开始。先天性免疫系统激活在脑缺血再灌注损伤中起着重要作用,因此免疫系统激活前减少炎症分子已成为治疗靶点。据报道,Hp可以激活先天性免疫系统,并促进病情进展[13]。Hp可预测预后的原因也许与先天性免疫系统的激活有关。Zhang等[11]的研究指出,血浆Hp水平与急性脑梗死患者预后密切相关,而不同Hp表型患者的预后差别不大,并指出血浆Hp预测急性脑梗死患者3年死亡事件发生的最佳截断值为281.54 μg/L。此外,在心血管疾病方面,血浆Hp水平也可预测患者预后。Chiang等[14]的研究指出,急性心肌梗死患者血浆Hp水平升高与总生存率独立相关,不同Hp表型组患者的总生存率没有差异,急性期血浆Hp水平可能反映炎症过程中氧化应激的严重程度。在其他疾病方面,Lml等[15]的研究指出,血浆Hp可能是多囊卵巢综合征及其并发症发生的潜在生物标志物。
本研究有以下不足:样本量较少,为单中心研究,这对本研究结论的准确性有一定影响;纳入的患者可能未排除其他未知影响因素,对结论也会造成一定影响;缺乏预测急性脑梗死患者预后的其他标志物研究,容易造成研究结论片面;本研究未纳入陈旧性脑梗死患者数据,这可能会影响结果。
总之,血浆Hp水平偏高提示急性脑梗死患者预后不良,血浆Hp水平有可能作为预测急性脑梗死患者预后的重要生物标志物。
| [1] |
Liu XW, Zhang JT, Tian CL, et al. The relationship of leukoaraiosis, haemorrhagic transformation and prognosis at 3 months after intravenous thrombolysis in elderly patients aged ≥ 60 years with acute cerebral infarction[J]. Neurol Sci, 2020. doi: 10.1007/s10072-020-04398-2.Onlineaheadofprint.
|
| [2] |
Lv G, Wang GQ, Xia ZX, et al. Influences of blood lipids on the occurrence and prognosis of hemorrhagic transformation after acute cerebral infarction:a case-control study of 732 patients[J]. Mil Med Res, 2019, 6(1): 2. |
| [3] |
张作念, 王志晔, 顾伟, 等. 急性脑梗死患者血清炎症因子与颈动脉粥样硬化斑块性质关系的临床研究[J]. 重庆医学, 2016, 45(10): 1375-1377. DOI:10.3969/j.issn.1671-8348.2016.10.025 |
| [4] |
丁妹, 曹志勇, 李胜利, 等. 不同炎症反应在脑梗死与短暂性脑缺血发作患者中表达及意义研究[J]. 国际神经病学神经外科学杂志, 2017, 44(3): 280-284. |
| [5] |
Roddrigues KF, Pietrani NT, Carvalho LML, et al. Haptoglobin levels are influenced by Hp1-Hp2 polymorphism, obesity, inflammation, and hypertension in type 2 diabetes mellitus[J]. Endocrinol Diabetes Nutr, 2019, 66: 99-107. DOI:10.1016/j.endinu.2018.07.008 |
| [6] |
彭文杰. AFP、CCL2和HP在结直肠癌肝转移诊断中的临床应用研究[J]. 国际生物医学工程杂志, 2019, 5: 414-418. DOI:10.3760/cma.j.issn.1673-4181.2019.05.010 |
| [7] |
Sun L, Hu S, Yu L, et al. Serum haptoglobin as a novel molecular biomarker predicting colorectal cancer hepatic metastasis[J]. Int J Cancer, 2016, 138(11): 2724-2731. DOI:10.1002/ijc.29993 |
| [8] |
Petra I, Melkas S, Saksi J, et al. Haptoglobin Hp2 variant promotes premature cardiovascular death in stroke survivors[J]. Stroke, 2017, 48(6): 1463-1469. |
| [9] |
中华医学会神经病学分会. 中国脑血管病一级预防指南2015[J]. 中华神经科杂志, 2015, 48(8): 629-643. DOI:10.3760/cma.j.issn.1006-7876.2015.08.003 |
| [10] |
耿玉荣, 柳英杰, 张云霞, 等. 伴未破裂颅内动脉瘤的急性脑梗死患者静脉溶栓治疗安全性评价研究[J]. 中国全科医学, 2017, 20(1): 56-61. DOI:10.3969/j.issn.1007-9572.2017.01.012 |
| [11] |
Zhang T, Xiang L. Elevated Plasma Haptoglobin Level as a Potential Marker for Poor Prognosis in Acute Cerebral Infarction[J]. Eur Neurol, 2018, 79(3-4): 154-160. DOI:10.1159/000487648 |
| [12] |
Peta V, Zhu JH, Lubman DM, et al. Input of serum haptoglobin fucosylation profile in the diagnosis of hepatocellular carcinoma in patients with non-cirrhotic liver disease[J]. Clin Res Hepatol Gastroenterol, 2020, S2210-7401(19): 30272-30274. |
| [13] |
Leclerc JL, Li C, Jean S, et al. Temporal and age-dependent effects of haptoglobin deletion on intracerebral hemorrhage-induced brain damage and neurobehavioral outcomes[J]. Exp Neurol, 2019, 317: 22-33. DOI:10.1016/j.expneurol.2019.01.011 |
| [14] |
Chiang KH, Kao YT, Leu HB, et al. Higher post-acute myocardial infarction plasma haptoglobin level is associated with poor long-term overall survival[J]. Int J Cardiol, 2016, 229(1): 102-107. |
| [15] |
Lml C, Ferreira CN, Dkd DO, et al. Haptoglobin levels, but not Hp1-Hp2 polymorphism, are associated with polycystic ovary syndrome[J]. J Assist Reprod Genet, 2017, 34(10): 1691-1698. |
 2020, Vol. 47
2020, Vol. 47




