扩展功能
文章信息
- 王松, 张卫民, 薛振生, 刘艳红, 张伟
- WANG Song, ZHANG Wei-Min, XUE Zhen-Sheng, LIU Yan-Hong, ZHANG Wei
- 血清CXCL12水平在预测颅脑损伤预后不良患者中的价值
- Significance of serum CXCL12 level in predicting poor prognosis of patients with craniocerebral injury
- 国际神经病学神经外科学杂志, 2020, 47(3): 259-262
- Journal of International Neurology and Neurosurgery, 2020, 47(3): 259-262
-
文章历史
收稿日期: 2020-04-10
修回日期: 2020-06-18
颅脑损伤是临床常见的外伤类型,在全身创伤患者中的占比约为15%~20%,仅次于四肢创伤[1]。据调查[2],颅脑损伤在全身创伤患者中的致残率与死亡率均居于首位,尤其是重型颅脑损伤患者的预后不良发生率可高达25.71%,给患者的身心健康及生命安全均造成了极大的危害。血清CXC趋化因子配体12(CXC chemokine ligand 12,CXCL12)水平被证实与神经系统损害有关[3],目前研究认为CXCL12通路可调控神经元的增殖与凋亡,从而可影响神经系统功能[4],而神经功能是影响患者预后的主要因素[5],故此血清CXCL12水平可能与颅脑损伤患者的预后情况有关。但是该指标是否能够用于预测颅脑损伤患者预后不良及其价值尚未明确。鉴于此,本研究特对颅脑损伤患者及正常健康志愿者的CXCL12水平进行分析以探讨上述问题,详情见如下报道。
1 资料与方法 1.1 临床资料申报医院医学伦理委员会批准后(批准证号:201705016)对2017年6月—2019年9月收治的124例颅脑损伤患者(A组)的临床资料和86例正常健康志愿者(B组)的体检资料进行回顾性分析。A组男性85例,女性39例;年龄20~78岁,平均(45.52±6.78)岁;体重指数(BMI)17.2~28.5kg/m2,平均(23.41±2.34)kg/m2;受伤原因:交通事故69例、高处坠落30例、打架斗殴18例、其他7例;损伤类型:闭合性颅脑损伤52例,开放性颅脑损伤72例;格拉斯哥昏迷量表(Glasgow coma scale,GCS)[6]评分3~15分,平均(10.25±3.85)分,轻型(GCS 13~15分)35例、中型(GCS 9~12分)68例、重型(GCS 3~8分)21例。B组:男性60例,女性26例;年龄18~75岁,平均(45.07±7.52)岁;BMI 18.5~24.9kg/m2,平均(23.26±2.22)kg/m2。A组与B组基线资料比较,差异均无统计学意义(P>0.05)。
纳入标准:①A组均证实存在颅脑损伤,B组均经过全身检查证实健康;②两组均为成年人,且均有完整的资料。排除标准:①存在神经系统疾病史者;②伴有其他部位创伤者;③A组入院24 h内死亡者;④伴有其他类型内科疾病者。
1.2 方法血清CXCL12水平检测:A组于开始治疗前、B组于体检当天空腹抽取外周静脉血,置于真空抽血管中,共5 ml,需注意实施抗凝处理。贴上受试者的信息标签,轻轻摇晃后于2 h内送至检验科。利用湖南湘仪仪器厂生产的L500型台式离心机对待检测样本进行离心处理,转速设置为3 500 r/min,共离心10 min。取上清,采用日本日立7600型全自动生化分析仪并利用该公司生产的配套试剂盒测定所有受试者的血清CXCL12水平,所用方法为酶联免疫吸附试验。
A组治疗方法:参照《颅脑损伤外科治疗指南》[7]实施对症治疗,包括标准去大骨瓣减压术、修补术、血肿引流术等,同时予以调整水电解质紊乱、调节血压与血糖、营养脑神经、亚低温等疗法。
A组预后评价方法:3个月后采用格拉斯哥预后量表(GOS)[8]对A组患者的预后进行评价,若死亡则记为1分;若植入生存且仅有最小反应则记为2分;若重度残疾,清醒但日常生活需要照料则记为3分;若轻度残疾但可独立生活,能在保护下工作则记为4分;若恢复良好,尽管有轻度缺陷但不影响正常生活则记为5分。评分越高认为预后越好,GOS评分为1~3分者记为预后不良,为4或5分者记为预后良好。
1.3 观察指标① 对比A组与B组血清CXCL12水平,并对比A组不同伤情患者血清CXCL12水平;②对比A组中预后不良与预后良好患者血清CXCL12水平,并对比A组不同伤情患者预后不良与预后良好患者血清CXCL12水平;③分析血清CXCL12水平预测A组患者预后不良的价值。
1.4 统计学方法数据分析利用SPSS 24.0统计软件,计量资料若符合正态分布,则采用均数±标准差“(x±s)”描述,比较用t检验;计数资料以率“(%)”描述比较采用χ2检验,若理论频数为1~5则对其校正。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,借助曲线下面积(area under curve,AUC)评价血清CXCL12水平预测A组患者预后不良的价值。P<0.05为差异有统计学意义。
2 结果 2.1 A组与B组血清CXCL12水平对比A组血清CXCL12水平高于B组(t=72.308, P<0.001), 且A组重型患者高于A组轻型和A组中型患者(t=30.093, P<0.001;t=17.590, P<0.001),A组中型患者高于A组轻型患者(t=21.106, P<0.001)。见表 1。
| 组别 | n | CXCL12 |
| A组轻型 | 35 | 2 214.35±169.78 |
| A组中型 | 68 | 3 386.69±204.69① |
| A组重型 | 21 | 4 749.52±328.57①② |
| A组 | 124 | 3 286.59±212.37③ |
| B组 | 86 | 1 430.30±128.97 |
| 注:与A组轻型对比,①P<0.05;与A组中型对比,②P<0.05;与B组对比,③P<0.05。 | ||
A组中共有26例预后不良,预后不良发生率为20.97%,其中死亡2例、植物状态4例、重度残疾20例。A组轻型、中型、重型患者预后不良发生率分别为5.71%(2/35)、14.71%(10/68)、66.67%(14/21),重型患者高于轻型和中型患者(校正χ2=21.000,P=0.000;χ2=21.996,P=0.000)。
A组中轻型、中型、重型预后不良患者血清CXCL12水平均高于A组中轻型、中型、重型预后良好患者,且A组预后不良患者血清CXCL12水平高于A组预后良好患者,差异均有统计学意义(P<0.05),见表 2。
| 预后 | n | CXCL12 |
| A组轻型不良 | 2 | 2 598.14±172.59a |
| A组轻型良好 | 33 | 2 191.09±155.63 |
| A组中型不良 | 10 | 3 986.75±228.95a |
| A组中型良好 | 58 | 3 283.23±197.03 |
| A组重型不良 | 14 | 5 102.54±388.95a |
| A组重型良好 | 7 | 4 043.49±256.30 |
| A组不良 | 26 | 4 875.26±296.73a |
| A组良好 | 98 | 2 865.11±201.35 |
| 注:与预后良好患者对比,aP<0.05。 | ||
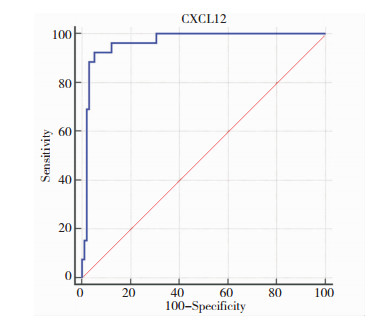
血清CXCL12水平预测A组预后不良的Cut-off值为3 435.19mmol/L,此时AUC最高,灵敏度、特异度、AUC分别为92.31%、94.90%、0.964,见表 3和图 1。
| 指标 | Cut-off值 | 灵敏度 | 特异度 | AUC | 95%CI |
| CXCL12 | 3 435.19 mmol/L | 92.31 | 94.90 | 0.964 | 0.914~0.989 |
|
| 图 1 血清CXCL12水平预测A组预后不良的ROC曲线 |
颅脑损伤的常见原因有交通事故、高处坠落、打架斗殴等,可由于直接或间接暴力打击所致,导致患者出现意识障碍、呕吐、头痛头晕等表现,还可导致呼吸、脉搏、心率等紊乱,血压下降,危害严重。颅脑损伤患者的预后不良发生率高,常见危险因素为损伤面积大、有颅内血肿、颅内高压未有效控制等,均可导致局部脑组织出现严重损伤,威胁患者的健康与生命[9]。目前临床上常用GCS评价颅脑损伤患者的病情,并据此判断预后不良的发生风险,但GCS评分对预后不良的预测并不准确,效能不理想[10-11]。
本研究中发现,A组血清CXCL12水平均高于B组,且重型患者血清CXCL12水平高于中型和轻型患者,中型患者血清CXCL12水平高于轻型患者,提示颅脑损伤患者中血清CXCL12水平升高,且与病情有关。CXCL12属于CXC家族成员之一,可趋化T细胞、B细胞、单核细胞等,还可促使细胞表面的整合素活化,从而增强其黏附作用,发挥趋动效能,参与T细胞的活化,进而可激活免疫系统,刺激促炎症因子大量生成和释放,诱发组织免疫炎症损伤,还可参与细胞凋亡、侵袭与迁移的调控[12],故而该指标水平可反映机体局部炎症反应的严重程度,从而可评价组织损伤程度。有研究指出[13],CXCL12具有细胞趋化作用,不仅可维持大脑正常的生物学作用,还可参与大脑异常改变。在正常生理状态下该因子水平常维持在较低水平。但是当发生颅脑损伤后其水平可显著升高,可趋化白细胞、淋巴细胞以及单核细胞等,并且参与脑胶质、神经和颗粒细胞炎症损伤。在神经损伤、神经功能失调和神经细胞变性坏死等生物学过程中均积极参与且发挥重要作用。此外,CXCL12还可破坏血脑屏障,增加其通透性,招募白细胞沿浓度梯度迁移至炎症部位,进而参与神经炎症反应损伤[14]。颅脑损伤患者的伤情越严重,局部炎症反应也越严重,CXCL12水平也越高。因此在颅脑损伤患者中血清CXCL12水平普遍高于正常健康志愿者,且与病情呈正相关。
此外,本研究中A组预后不良发生率约为20.97%,与既往Kadriye Kahveci等[15]报道的20.25%相近,表明颅脑损伤患者的预后不良发生风险高,提示探讨理想的预后不良预测指标具有其重要性和必要性;本研究还发现重型患者预后不良发生率高于轻型和中型患者,提示病情与预后相关,也说明颅脑损伤患者的病情越严重预后不良发生率越高;A组中预后不良患者的血清CXCL12水平均高于预后良好患者,且在轻型、中型、重型患者中规律一致,提示颅脑损伤预后不良患者血清CXCL12水平升高,在不同病情患者中预后不良者均高于预后良好者。CXCL12可通过多种途径参与中枢神经系统损伤,介导炎性因子的释放和向脑实质的浸润,加重颅脑损伤和神经功能缺损程度。既往国内外相关报道均证实炎症因子水平是颅脑损伤病情与预后的重要构成因素[16-17],因而推测CXCL12水平也可用于评价颅脑损伤患者的病情并预测预后不良的发生风险。本研究ROC分析结果中显示,血清CXCL12水平预测A组预后不良的Cut-off值为3 435.19 mmol/L,灵敏度、特异度、AUC均理想。血清CXCL12水平与炎症反应性损伤程度有关,而炎症反应越严重,意味着神经系统损伤越严重,因而预后不良的发生风险越高。
综上述,颅脑损伤患者预后不良发生率高,此类患者血清CXCL12水平升高,且病情越重其水平越高,且预后不良患者血清CXCL12水平高于预后良好患者,对预后有良好的预测价值。
| [1] |
胡锦, 姚海军, 刘永, 等. 华东地区颅脑创伤流行病学调查[J]. 中华神经外科杂志, 2008, 24(2): 88-91. DOI:10.3321/j.issn:1001-2346.2008.02.006 |
| [2] |
解美玲, 白剑刚. 早期外周血NSE、CRP及D-二聚体水平检测与颅脑损伤患者临床预后的关系[J]. 山东医药, 2019, 59(26): 65-67. DOI:10.3969/j.issn.1002-266X.2019.26.019 |
| [3] |
毛伟峰. CXCL12对大鼠创伤性脑损伤后损伤区周围脑组织中神经元凋亡的影响[C].中国解剖学会2012年年会论文文摘汇编, 2012.
|
| [4] |
林剑彪. SDF-1α/CXCR4信号通路在轴向应力刺激促进骨缺损再生中的作用研究[D].福州: 福建医科大学, 2018.
|
| [5] |
Tan HP, Guo Q, Hua G, et al. Inhibition of endoplasmic reticulum stress alleviates secondary injury after traumatic brain injury[J]. Neural Regeneration Research, 2018, 13(5): 827. DOI:10.4103/1673-5374.232477 |
| [6] |
刘海兵, 魏梁锋, 洪景芳, 等. 创伤性重型颅脑损伤早期格拉斯哥昏迷量表评分动态变化与CTP的相关性[J]. 临床神经外科杂志, 2018, 15(6): 52-55. |
| [7] |
刘伟国, 赵奇煌. 颅脑损伤外科治疗指南[J]. 中国临床医生杂志, 2006, 34(11): 29-29. DOI:10.3969/j.issn.1008-1089.2006.11.012 |
| [8] |
何艳斌, 林清, 王斐, 等. 行为量表联合电生理检查对颅脑损伤意识障碍患者预后的评估[J]. 临床神经外科杂志, 2017, 14(6): 437-440. DOI:10.3969/j.issn.1672-7770.2017.06.007 |
| [9] |
杨中鑫, 刘海波, 范英俊, 等. 高压氧对重型颅脑外伤患者血清和肽素的影响[J]. 国际神经病学神经外科学杂志, 2018, 45(3): 251-254. |
| [10] |
谢勰, 丁宛海, 牛朝诗, 等. 颅脑损伤的GCS评分联合CT评分对患者预后判定的临床价值[J]. 立体定向和功能性神经外科杂志, 2018, 31(5): 265-270. |
| [11] |
余菲, 张琳. 格拉斯哥昏迷-瞳孔反应评分在ICU重型颅脑损伤患者中的临床应用价值[J]. 临床与病理杂志, 2019, 39(1): 104-109. |
| [12] |
Deng QJ, Xu XF, Ren J. Effects of SDF-1/CXCR4 on the repair of traumatic brain injury in rats by mediating bone marrow derived mesenchymal stem cells[J]. Cellular & Molecular Neurobiology, 2017, 38(2): 1-11. |
| [13] |
阳军, 黄骥. 血清CXCL12水平在急性脑出血患者预后评估中的价值[J]. 山东医药, 2018, 58(36): 83-85. |
| [14] |
Li YN, Chang SL, Li W, et al. Cxcl12-engineered endothelial progenitor cells enhance neurogenesis and angiogenesis after ischemic brain injury in mice[J]. Stem Cell Res Ther, 2018, 9(1): 139. |
| [15] |
Kadriye Kahveci, Metin Diner, Cihan Doger, et al. Traumatic brain injury and palliative care: a retrospective analysis of 49 patients receiving palliative care during 2013-2016 in Turkey[J]. Neural Regeneration Research, 2017, 12(1)rd I. Perinatal Brain Injury: Mechanisms, Prevention, and Outcomes[J]. Clin Perinatol, 2018, 45(2): 357-375.
|
| [16] |
葛风, 蒋云召, 陆华, 等. 重型颅脑外伤术后颅内感染患者高迁移率族蛋白B-1和炎症因子表达水平[J]. 中华医院感染学杂志, 2019, 29(17): 2661-2664. |
| [17] |
Khatri N, Thakur M, Pareek V, et al. Oxidative Stress:Major threat in traumatic brain injury[J]. CNS Neurol Disord Drug Targets, 2018, 17(9): 689-695. DOI:10.2174/1871527317666180627120501 |
 2020, Vol. 47
2020, Vol. 47


