扩展功能
文章信息
- 赵岗, 张哲莹, 杜宝顺, 王阳, 马欢
- ZHAO Gang, ZHANG Zhe-Ying, DU Bao-Sun, WANG Yang, Ma Huan
- 长链非编码RNA SNHG6在胶质瘤组织中表达及临床意义
- Expression and clinical significance of long non-coding RNA SNHG6 in glioma tissues
- 国际神经病学神经外科学杂志, 2020, 47(3): 254-258
- Journal of International Neurology and Neurosurgery, 2020, 47(3): 254-258
-
文章历史
收稿日期: 2019-09-11
修回日期: 2020-06-22
2. 河南省新乡医学院基础医学院病理教研室, 河南 新乡 453000
2. Department of Pathology, Xinxiang Medical University, 601 jinsui Road, Xinxiang, Henan 453000, P. R. China
胶质瘤作为最为常见的颅内原发性恶性肿瘤,恶性程度高、侵袭力强,且呈浸润性生长,致使肿瘤组织与正常脑组织界限不清[1],尽管现有的手术及放化疗治疗手段不断提高,但患者治疗后复发率高,总体预后依然较差[2]。有研究指出[3],高侵袭和转移性是导致胶质瘤预后不佳的重要因素。因此,依靠现代分子生物学技术,寻找与胶质瘤侵袭和转移相关的敏感基因,对指导患者治疗及改善预后具有重要意义。长链非编码RNA(long non-coding RNA,LncRNA)作为一种广泛存在于机体内的长度在200个核苷酸以上的RNA,无法正常编码蛋白,但在多种生理、病理及一些疾病发生进展中发挥重要作用[4],近年来,越来越多的研究发现[5-6],LncRNA参与了恶性肿瘤发生、进展过程,与肿瘤细胞恶性生物学特性密切相关。核仁小RNA宿主基因6(small nucleolar RNA host gene 6,SNHG6)是一种重要的LncRNA,在结直肠癌组织中呈高表达[7],参与了结直肠癌细胞增殖、迁移和侵袭过程[8],但其在胶质瘤发生进展中的作用鲜有报道。本研究检测胶质瘤组织中LncRNA SNHG6表达,分析其在不同临床病理指标间表达差异性,并探讨其与患者预后的相关性,以期为胶质瘤机制研究提供参考资料。
1 资料与方法 1.1 一般资料选取2009年2月—2014年2月在新乡市中心医院接受手术治疗的胶质瘤患者,纳入标准:①术前无放化疗等治疗史;②术后经病理学检查确证;③临床资料完成,均顺利完成院外随访。排除标准:①合并有其他肿瘤病史、凝血功能障碍及免疫缺陷性疾病者;②并发颅内感染、血肿等术后并发症;③心肝肾等重要脏器严重功能障碍者;④随访过程中由于其他疾病死亡者。共入选患者94例。其中,男性57例,女性37例;年龄21~75岁,平均(51.37±10.74)岁,中位年龄53岁;肿瘤位置:额部43例,颞部51例;根据2016年世界卫生组织(WHO)关于中枢神经系统肿瘤分级标准[9]:Ⅰ、Ⅱ级41例,Ⅲ、Ⅳ级53例。同期,选取留取因颅脑外伤或癫痫而行手术治疗的正常脑组织37例;其中,男性20例,女性17例;平均年龄(52.02±11.34)岁。两组在性别、年龄等方面比较,差异无统计学意义(P>0.05),均衡可比。所有研究对象均于术中留取组织并置于液氮中,-80℃保存。
1.2 方法 1.2.1 实时荧光定量PCR检测胶质瘤和正常脑组织中LncRNA SNHG6表达取胶质瘤和正常脑组织,切碎,研磨,加入细胞裂解液,按Trizol总RNA提取试剂盒(购自美国Invitrogen公司)说明提取总RNA,并使用紫外分光光度计检测其纯度。用反转录试剂盒(购自日本TaKaRa公司)将总RNA反转录为cDNA,使用美国ABI公司生产的StepOnePlus实时荧光定量PCR仪按PCR扩增试剂盒(购自日本TaKaRa公司)说明对引物扩增,引物合成由上海生工生物公司设计完成。LncRNA SNHG6:正向:5’-TTAGTCATGCCGGTGTGGTG-3’,反向:5’-AATACATGCCGCGTGATCCT-3’;GAPDH:正向:5’-CGAGCCACATCGCTCAGACA-3’,反向:5’-GTGGTGAAGACGCCAGTGGA-3’。反应条件:95℃预变性5 min,94℃变性30 s,60℃退火30 s,76℃延伸30 s,进行38次循环。以GAPDH为参照,采用2-△△Ct法计算SNHG6 mRNA相对表达量。
1.2.2 病例随访所有胶质瘤患者均于院外进行随访,形式包括门诊及住院病历收集、电话随访等,随访截止时间2019年2月28日,以死亡作为终点事件,记录患者总生存时间,生存时间3~120个月,中位生存时间21个月。
1.3 统计学方法使用SPSS 21.0软件分析,计量资料采用均数±标准差(x±s)表示,组间比较采用t检验,生存分析采用Kaplan-Meier法和Log-Rank检验,影响预后的风险因素分析采用Cox比例风险回归模型,以P < 0.05为差异有统计学意义。
2 结果 2.1 胶质瘤和正常脑组织中LncRNA SNHG6表达水平胶质瘤组织中LncRNA SNHG6相对表达量为(1.88±0.17),而在正常脑组织中为(1.01±0.13),两者比较差异有统计学意义(t=28.230,P < 0.001)。
2.2 不同临床指标胶质瘤患者组织中LncRNA SNHG6表达水平不同年龄、性别、肿瘤位置、肿瘤直径和肿瘤数量的胶质瘤组织中LncRNA SNHG6相对表达量比较,差异无统计学意义(P>0.05),不同WHO分级、KPS评分和术后复发的胶质瘤组织中LncRNA SNHG6相对表达量比较差异有统计学意义(P < 0.05),见表 1。
| 临床指标 | n | LncRNA SNHG6表达量 | t值 | P值 |
| 年龄(岁) | ||||
| ≥51 | 52 | 1.85±0.18 | ||
| < 51 | 42 | 1.90±0.15 | 1.460 | 0.148 |
| 性别 | ||||
| 男性 | 57 | 1.87±0.16 | ||
| 女性 | 37 | 1.89±0.17 | 0.698 | 0.487 |
| 肿瘤位置 | ||||
| 额部 | 43 | 1.85±0.17 | ||
| 颞部 | 51 | 1.90±0.16 | 1.494 | 0.139 |
| 肿瘤直径(cm) | ||||
| < 4 | 52 | 1.85±0.17 | ||
| ≥4 | 42 | 1.91±0.16 | 1.770 | 0.080 |
| 肿瘤数量 | ||||
| 单个 | 50 | 1.85±0.16 | ||
| 多个 | 44 | 1.90±0.17 | 1.440 | 0.153 |
| WHO分级 | ||||
| Ⅰ、Ⅱ级 | 41 | 1.82±0.16 | ||
| Ⅲ、Ⅳ级 | 53 | 1.92±0.16 | 3.070 | 0.003 |
| KPS评分 | ||||
| < 80 | 52 | 1.92±0.18 | ||
| ≥80 | 42 | 1.83±0.14 | 2.688 | 0.009 |
| 术后复发 | ||||
| 是 | 43 | 1.93±0.16 | ||
| 否 | 51 | 1.83±0.16 | 2.795 | 0.006 |
以胶质瘤患者组织中LncRNA SNHG6表达量的P25为界值,将患者分为低表达组(n=24)和高表达组(n=70),Kaplan-Meier生存分析结果显示,随访结束时,低表达组存活11例,死亡13例,高表达组存活11例,死亡59例;低表达组患者中位生存时间40.2个月,累积生存率45.8%,高表达组患者中位生存时间19.0个月,累积生存率15.7%,Log-Rank检验差异有统计学意义(χ2=9.562,P=0.002),见图 1。
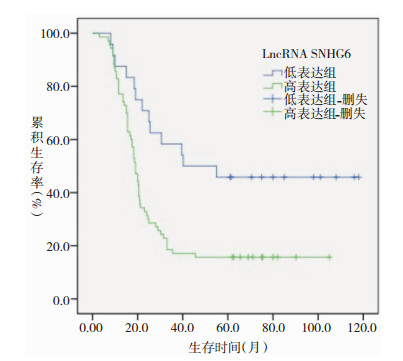
|
| 图 1 胶质瘤患者组织中LncRNA SNHG6表达水平对预后的影响 |
结果显示,WHO分级、KPS评分、术后复发和LncRNA SNHG6表达是影响胶质瘤患者预后的风险因素(P < 0.05),见表 2。
| 指标 | B | SE | Wald χ2 | P | HR(95%CI) |
| 年龄 | 0.138 | 0.254 | 0.294 | 0.588 | 1.148(0.697~1.889) |
| 性别 | 0.019 | 0.269 | 0.005 | 0.944 | 1.019(0.602~1.726) |
| 肿瘤位置 | 0.261 | 0.255 | 1.049 | 0.306 | 1.299(0.787~2.142) |
| 肿瘤直径 | 0.072 | 0.257 | 0.078 | 0.781 | 1.074(0.649~1.779) |
| 肿瘤数量 | 0.194 | 0.271 | 0.514 | 0.474 | 1.214(0.714~2.065) |
| WHO分级 | 0.861 | 0.267 | 10.369 | 0.001 | 2.365(1.401~3.994) |
| KPS评分 | 0.707 | 0.283 | 6.236 | 0.013 | 2.028(1.164~3.534) |
| 术后复发 | 0.783 | 0.263 | 8.862 | 0.003 | 2.188(1.307~3.665) |
| LncRNA SNHG6表达 | 0.712 | 0.343 | 4.323 | 0.038 | 2.038(1.042~3.989) |
胶质瘤作为中枢神经系统恶性程度及侵袭力均较强的肿瘤,近年来发病率呈升高趋势[10],由于该肿瘤很难用手术的方式彻底切除,治疗后极易复发,致使患者总体预后较差,病死率较高[11]。目前,该肿瘤发生及进展机制尚未完全清楚,特别是与该肿瘤高恶性、高侵袭性及高复发相关机制或敏感基因仍在研究探索中。LncRNA作为一类没有编码蛋白能力的长链RNA,越来越多的研究表明[12-13],其在染色体修饰、转录及转录后水平处理、表观遗传调控、基因组防御等方面发挥重要作用。近年来,其在肿瘤恶性生物学行为中的作用越来越受到重视,不仅与肿瘤细胞恶性增殖有关[14],而且参与调控了细胞侵袭转移、化疗耐药、自噬等[15]。SNHG6是一种定位于核仁内的含有472个核苷酸长度的LncRNA,在指导转录后修饰保证产生有效和准确的核糖体中发挥重要作用[16],随着研究的深入,其在恶性肿瘤发生、进展中的作用越来越受到重视。有研究指出[17],SNHG6在肝细胞癌中表达失调,与肿瘤进展密切相关。研究发现[18],SNHG6促进了结直肠癌进展。且与结直肠癌细胞细胞增殖、迁移及侵袭过程密切相关[19]。本研究结果显示,胶质瘤组织中LncRNA SNHG6表达量高于正常脑组织,说明LncRNA SNHG6在胶质瘤组织中呈高表达。本研究结果显示,WHO分级Ⅲ、Ⅳ级、KPS评分 < 80分及术后复发的胶质瘤组织中LncRNA SNHG6表达量升高,说明LncRNA SNHG6可能与胶质瘤恶性程度及预后有关,提示LncRNA SNHG6表达量越高,则预示胶质瘤恶性程度越高、患者术后易复发且预后不佳。
Yan等[19]指出,LncRNA SNHG6在前列腺癌中上调预示预后不良。陈青[20]指出,SNHG6高表达的结直肠患者预后更差。Zhang等[21]指出,LncRNA SNHG6高表达可作为食管鳞癌不良预后的潜在标志物。本研究生存分析结果显示,低表达组患者中位生存时间和累积生存率均高于高表达组,说明LncRNA SNHG6与胶质瘤患者预后有关,LncRNA SNHG6高表达则患者预后较差。本研究Cox比例风险回归模型结果显示,WHO分级、KPS评分、术后复发和LncRNA SNHG6表达是影响胶质瘤患者预后的风险因素,进一步说明LncRNA SNHG6高表达是胶质瘤患者预后的风险因素,可能是评估患者预后的潜在标志物。
综上所述,胶质瘤组织中LncRNA SNHG6表达量升高,且与胶质瘤恶性程度及不良预后有关,可作为患者预后评估的风险因素。但LncRNA SNHG6在胶质瘤发生、进展、侵袭转移中的具体作用机制尚待进一步开展研究以明确。
| [1] |
代从新, 王裕, 马文斌. 脑胶质瘤动物模型的研究进展[J]. 中华医学杂志, 2018, 98(25): 2052-2054. DOI:10.3760/cma.j.issn.0376-2491.2018.25.020 |
| [2] |
Philbrick BD, Adamson DC. Early clinical trials of Toca 511 and Toca FC show a promising novel treatment for recurrent malignant glioma[J]. Expert Opin Investig Drugs, 2019, 28(3): 207-216. DOI:10.1080/13543784.2019.1572112 |
| [3] |
Fu MH, Wang CY, Hsieh YT, et al. Functional role of matrix gla protein in glioma cell migration[J]. Mol Neurobiol, 2018, 55(6): 4624-4636. DOI:10.1007/s12035-017-0677-1 |
| [4] |
Guo J, Liu ZS, Gong RJ. Long noncoding RNA:an emerging player in diabetes and diabetic kidney disease[J]. Clin Sci (Lond), 2019, 133(12): 1321-1339. DOI:10.1042/CS20190372 |
| [5] |
Botti G, Marra L, Malzone MG, et al. LncRNA HOTAIR as prognostic circulating marker and potential therapeutic target in patients with tumor diseases[J]. Curr Drug Targets, 2017, 18(1): 27-34. |
| [6] |
Tao F, Xu YP, Yang DZ, et al. LncRNA NKILA correlates with the malignant status and serves as a tumor-suppressive role in rectal cancer[J]. J Cell Biochem, 2018, 119(12): 9809-9816. DOI:10.1002/jcb.27300 |
| [7] |
黎丰华, 古国财, 庄雄标, 等. 长链非编码RNA SNHG6在结肠癌中的表达及其生物学意义[J]. 重庆医学, 2018, 47(18): 2413-2417. DOI:10.3969/j.issn.1671-8348.2018.18.005 |
| [8] |
Wang XK, Lai QH, He JL, et al. LncRNA SNHG6 promotes proliferation, invasion and migration in colorectal cancer cells by activating TGF-β/Smad signaling pathway via targeting UPF1 and inducing EMT via regulation of ZEB1[J]. Int J Med Sci, 2019, 16(1): 51-59. DOI:10.7150/ijms.27359 |
| [9] |
Diamandis P, Aldape K. World Health Organization 2016 Classification of Central Nervous System Tumors[J]. Neurol Clin, 2018, 36(3): 439-447. |
| [10] |
Ren JH, Jia PL, Feng HX, et al. Involvement of poly(ADP-ribose) polymerase-1 in Chinese patients with glioma:a potential target for effective patient care[J]. Int J Biol Markers, 2018, 33(1): 68-72. DOI:10.5301/ijbm.5000267 |
| [11] |
Dubinski D, Won SY, Gessler F, et al. Dexamethasone-induced leukocytosis is associated with poor survival in newly diagnosed glioblastoma[J]. J Neurooncol, 2018, 137(3): 503-510. DOI:10.1007/s11060-018-2761-4 |
| [12] |
Li Q, Dong CY, Cui JY, et al. Over-expressed lncRNA HOTAIRM1 promotes tumor growth and invasion through up-regulating HOXA1 and sequestering G9a/EZH2/Dnmts away from the HOXA1 gene in glioblastoma multiforme[J]. J Exp Clin Cancer Res, 2018, 37(1): 265-280. DOI:10.1186/s13046-018-0941-x |
| [13] |
李倩, 尹恬恬, 胡宇辰, 等. 长链非编码RNA HULC沉默表达对人脑胶质母细胞瘤细胞SHG44增殖和凋亡的影响[J]. 中山大学学报(医学版), 2019, 40(1): 31-36. |
| [14] |
Yu DJ, Li YH, Zhong M. LncRNA FBXL19-AS1 promotes proliferation and metastasis via regulating epithelial-mesenchymal transition in non-small cell lung cancer[J]. Eur Rev Med Pharmacol Sci, 2019, 23(11): 4800-4806. |
| [15] |
Heery R, Finn SP, Cuffe S, et al. Long non-coding RNAs:key regulators of epithelial-mesenchymal transition, tumour drug resistance and cancer stem cells[J]. Cancers (Basel), 2017, 9(4): 1-48. |
| [16] |
Fan RH, Guo JN, Yan W, et al. Small nucleolar host gene 6 promotes esophageal squamous cell carcinoma cell proliferation and inhibits cell apoptosis[J]. Oncol Lett, 2018, 15(5): 6497-6502. |
| [17] |
Birgani MT, Hajjari M, Shahrisa A, et al. Long non-coding RNA SNHG6 as a potential biomarker for hepatocellular carcinoma[J]. Pathol Oncol Res, 2018, 24(2): 329-337. DOI:10.1007/s12253-017-0241-3 |
| [18] |
Zhu YK, Xing YW, Chi FX, et al. Long noncoding RNA SNHG6 promotes the progression of colorectal cancer through sponging miR-760 and activation of FOXC1[J]. Onco Targets Ther, 2018, 11(11): 5743-5752. |
| [19] |
Yan YJ, Chen ZJ, Xiao Y, et al. Long non-coding RNA SNHG6 is upregulated in prostate cancer and predicts poor prognosis[J]. Mol Biol Rep, 2019, 46(3): 2771-2778. |
| [20] |
陈青. GEO数据库分析长链非编码RNA SNHG6在结肠癌中的表达及临床意义[J]. 临床医学研究与实践, 2018, 3(17): 7-9. |
| [21] |
Zhang YL, Li RJ, Ding XL, et al. Upregulation of long non-coding RNA SNHG6 promote esophageal squamous cell carcinoma cell malignancy and its diagnostic value[J]. Am J Transl Res, 2019, 11(2): 1084-1091. |
 2020, Vol. 47
2020, Vol. 47




