扩展功能
文章信息
- 胡泽军, 陈贵杰, 曹相军, 罗洪涛, 刘静
- HU Ze-Jun, CHEN Gui-Jie, CAO Xiang-Jun, LUO Hong-Tao, LIU Jing
- 颅内动脉瘤介入术后预后不良的危险因素分析
- An analysis of risk factors for poor prognosis of intracranial aneurysm after interventional surgery
- 国际神经病学神经外科学杂志, 2020, 47(3): 225-229
- Journal of International Neurology and Neurosurgery, 2020, 47(3): 225-229
-
文章历史
收稿日期: 2020-04-25
修回日期: 2020-06-20
2. 四川大学华西医院, 四川 成都 610041
 =1.301)、术前Hunt-Hess分级(
=1.301)、术前Hunt-Hess分级( =1.328)、Fisher分级(
=1.328)、Fisher分级( =1.868)、AR值(
=1.868)、AR值( =1.910)、合并并发症(
=1.910)、合并并发症( =2.083)是介入术预后的危险因素(P < 0.05)。结论 手术时机、术前Hunt-Hess分级、Fisher分级、AR值、合并并发症是介入术预后的危险因素,针对有手术指征的动脉瘤患者尽早进行手术、积极防治并发症是改善预后、提高生活质量的有效措施。
=2.083)是介入术预后的危险因素(P < 0.05)。结论 手术时机、术前Hunt-Hess分级、Fisher分级、AR值、合并并发症是介入术预后的危险因素,针对有手术指征的动脉瘤患者尽早进行手术、积极防治并发症是改善预后、提高生活质量的有效措施。2. West China Hospital of Sichuan University, Chengdu, Sichuan 610041
颅内动脉瘤是颅内动脉管壁上的异常膨出,发病率占脑血管病的5%,是蛛网膜下腔出血的首要病因。颅内动脉瘤在破裂之前通常无特异性症状,一旦破裂出血,可在几分钟内出现颅内压升高、神经功能缺损、昏迷以及脑心综合征、应激性溃疡等全身性症状,且短时间内再出血风险极高,大大增加了手术难度[1]。开颅夹闭术是治疗颅内动脉瘤的传统方法,但随着介入技术的发展和微创理念的深入,动脉栓塞术的效果得到了广泛的认可,目前正大规模的应用于临床,与此同时,手术的预后和影响因素也受到了重视[2]。本研究分析了304例行介入栓塞治疗的颅内动脉瘤患者的预后情况以及引起预后不良的危险因素,以便为这类患者的合理治疗和康复提供依据。
1 资料与方法 1.1 一般资料病例来源于2017年1月—2019年1月于我院接受手术治疗的304例颅内动脉瘤患者。其中,男性132例,女性172例;年龄22~85岁。动脉瘤直径2.3~22.5 mm,位置:前循环228例,后循环76例;术前Hunt-Hess分级:Ⅱ级62例,Ⅲ级138例,Ⅳ级82例,V级22例;术前CT Fisher分级:2~3级166例,4级138例;发病至手术时间:≤3 d 184例,>3 d 120例。纳入标准:①符合2015年美国卒中协会关于颅内动脉瘤的诊断标准[3];②动脉瘤破裂,有手术指征并接受介入栓塞治疗。排除标准:①复发的动脉瘤、假性动脉瘤、夹层动脉瘤、创伤性动脉瘤;②行开颅夹闭术或介入术中转开颅者;③入院24 h内死亡者;④合并其他脑血管疾病;⑤临床资料不全及不具备随访条件者。
1.2 方法 1.2.1 信息采集建立Excel分类表记录患者基本信息(性别、年龄)、病史信息(高血压、糖尿病)、术前Hunt-Hess分级(Ⅱ~V级)、CT Fisher分级(2~4级)、手术时机(早期≤3 d,中期4~6 d,晚期≥7 d),术前全脑血管造影(DSA)明确动脉瘤数量(单发/多发)、直径(≤5 mm、>5~15 mm、>15 mm)、瘤体长径与瘤颈宽度的比值(AR)(< 0.5、0.5~2.0、>2.0)、动脉瘤位置(前交通、后交通、颈内系统、大脑中动脉、椎基底动脉系统),统计住院期间手术并发症情况(脑血管痉挛、血栓栓塞、再出血、颅内感染、脑积水)。
1.2.2 手术方法术前常规剂量尼莫地平泵控,全麻后经股动脉将导引导管置入椎动脉或颈内动脉上颈段再次确认责任动脉瘤位置、形态等,全身肝素化,将导引导管置入椎动脉或患侧颈内动脉第二颈椎水平位置,选择合适的微导管和弹簧圈导入动脉瘤内致密填塞。颅内多发动脉瘤患者采取分步填塞的方法,首先将存在破裂出血的动脉瘤部分进行封闭填塞,解除破裂出血风险后对其他动脉瘤或者是可疑责任病灶进行栓塞,栓塞顺序按照破裂出血风险高低由医师术中自主决定。再次造影明确栓塞效果,确认载瘤动脉通畅、无造影剂滞留后缓慢退出导管和动脉鞘,加压包扎股动脉穿刺点,下肢制动24 h。术后给予高血容量、高血压、血液稀释(三H法)治疗7 d,并反复行腰椎穿刺引流脑脊液,防止血管痉挛[4]。
1.2.3 术后随访采用门诊复查或电话随访方式随访至术后6个月,根据格拉斯哥预后量表(GOS)判定预后:1分=死亡;2分=植物生存;3分=清醒、重度残疾(日常生活完全需要照料);4分=轻度残疾(日常生活可独立,能在保护下工作);5分=正常(工作、生活不受影响),GOS 1~3分为预后不良,GOS 4~5分为预后良好[5]。
1.3 统计学方法采用SPSS 21.0软件对本研究数据进行分析处理,计数资料以例(%)表示,比较采用χ2检验或秩和检验,介入术预后的影响因素分析采用多因素Logistic回归,P < 0.05代表差异有统计学意义。
2 结果 2.1 治疗情况单纯弹簧圈栓塞246例(80.9%),见图 1,支架辅助弹簧圈栓塞58例(19.1%),见图 2;术后即刻,DSA显示完全栓塞289例(95.1%),大部分栓塞12例(3.9%),部分栓塞3例(1.0%);术后并发症发生率为16.4%(脑血管痉挛34例、血栓栓塞12例、再出血2例、颅内感染1例、脑积水1例);术后6个月,预后良好224例(73.7%),预后不良80例(26.3%)。
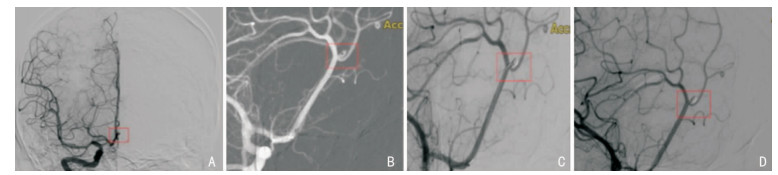
|
| A:术前;B:术中微导丝到位;C:填圈成篮;D:术后即刻动脉瘤完全栓塞 图 1 DSA所示单纯弹簧圈栓塞治疗大脑前动脉-胼周动脉瘤 |
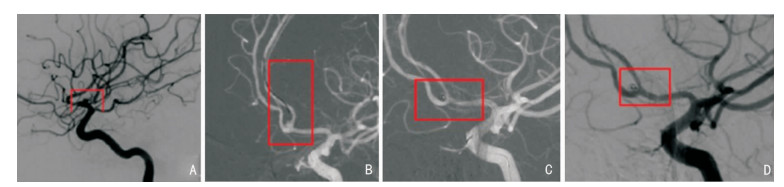
|
| A:术前;B:支架微导管远端在微导丝引导下顺利送达左侧大脑前动脉A2段;C:支架与微导管平行释放;D:术后即刻动脉瘤大部分栓塞 图 2 DSA所示支架辅助弹簧圈栓塞治疗前交通宽颈动脉瘤 |
单因素分析显示,介入术后预后不良组在手术时机、术前Hunt-Hess分级、Fisher分级、AR值、并发症发生率方面与预后良好组差异有统计学意义(P < 0.05);而在性别、年龄、合并高血压、糖尿病、动脉瘤数量、位置和直径方面与预后良好组差异无统计学意义(P>0.05),见表 1。
| 影响因素 | 预后不良组(n=80) | 预后良好组(n=224) | χ2/u值 | P值 | |
| 性别(男) | 34(42.5) | 98(43.8) | 0.082 | 1.000 | |
| 高龄(≥75岁) | 12(15.0) | 26(11.6) | 0.834 | 0.431 | |
| 手术时机 | 早期(≤3 d) | 8(10.0) | 176(78.6) | 16.732 | 0.000 |
| 中期(4~6 d) | 58(72.5) | 48(21.4) | |||
| 晚期(≥7 d) | 14(17.5) | 0(0.0) | |||
| 合并高血压 | 50(62.5) | 126(56.3) | 0.437 | 0.628 | |
| 合并糖尿病 | 26(32.5) | 64(28.6) | 0.792 | 0.526 | |
| 术前Hunt-Hess分级 | Ⅱ级 | 2(2.5) | 60(26.8) | 15.392 | 0.000 |
| Ⅲ级 | 14(17.5) | 124(55.4) | |||
| Ⅳ级 | 46(57.5) | 36(16.1) | |||
| V级 | 18(22.5) | 4(1.7) | |||
| Fisher分级 | 2级 | 2(2.5) | 70(31.3) | 9.373 | 0.005 |
| 3级 | 16(20.0) | 79(34.8) | |||
| 4级 | 62(77.5) | 76(33.9) | |||
| 动脉瘤数量 | 单发 | 58(72.5) | 152(67.9) | 1.324 | 0.331 |
| 多发 | 22(27.5) | 72(32.1) | |||
| 动脉瘤位置 | 前交通 | 32(40.0) | 96(42.8) | 3.579 | 0.362 |
| 后交通 | 16(20.0) | 48(21.4) | |||
| 颈内系统 | 18(22.5) | 46(20.5) | |||
| 大脑中动脉 | 12(15.0) | 24(10.7) | |||
| 椎基底动脉系统 | 2(2.5) | 10(4.5) | |||
| 动脉瘤直径(mm) | ≤5 | 4(5.0) | 14(6.3) | 0.932 | 0.463 |
| 5~15 | 30(37.5) | 90(40.2) | |||
| >15 | 46(57.5) | 120(53.5) | |||
| AR值 | < 0.5 | 34(42.5) | 30(13.4) | 13.752 | 0.000 |
| 0.5~2.0 | 38(47.5) | 62(27.7) | |||
| >2.0 | 8(10.0) | 132(58.9) | |||
| 合并并发症 | 32(40.0) | 18(8.0) | 12.743 | 0.000 | |
以单因素分析中有差异的影响因素为自变量,以预后为因变量进行多因素Logistic回归分析,结果显示晚期手术、术前Hunt-Hess级别高、Fisher级别高、AR值大、合并并发症是影响术后预后的危险因素,见表 2。
| 变量 | β | SE | Wald χ2值 | P值 | OR | 95%CI |
| 手术时机 | 0.263 | 0.128 | 4.222 | 0.040 | 1.301 | 1.012~1.672 |
| Hunt-Hess分级 | 0.284 | 0.137 | 4.297 | 0.038 | 1.328 | 1.016~1.738 |
| Fisher分级 | 0.625 | 0.237 | 6.954 | 0.008 | 1.868 | 1.174~2.973 |
| AR值 | 0.647 | 0.241 | 7.207 | 0.007 | 1.910 | 1.191~3.063 |
| 合并并发症 | 0.734 | 0.353 | 4.324 | 0.038 | 2.083 | 1.043~4.162 |
颅内动脉瘤多为发生于先天(动脉管壁中层菲薄或缺陷)及后天(腔内压力增高、动脉硬化等)因素造成的颅内动脉管壁的异常膨出,具有破裂风险。动脉瘤性蛛网膜下腔出血(SAH)占自发性SAH的85%以上,致残、致死率极高[6]。闭塞动脉瘤、防止再出血是手术治疗的目标[7],包括开颅动脉瘤夹闭术和介入栓塞术两种方式。针对两种术式的效果和安全性,国际蛛网膜下腔动脉瘤研究小组(ISAT)进行多中心大样本量随机对照研究,结果显示介入术组的预后良好率(76%)显著高于夹闭术组(66%),而造成这一差异的主要原因在于前者的术后并发症发生率(12%)低于后者(19%)[8]。本研究回顾性分析了304例行介入治疗的颅内动脉瘤患者临床资料,结果显示动脉瘤完全栓塞289例(95.1%),大部分栓塞12例(3.9%),部分栓塞3例(1.0%),预后良好224例(73.7%),预后不良80例(26.3%),术后并发症发生率为16.4%(脑血管痉挛34例、血栓栓塞12例、再出血2例、颅内感染1例、脑积水1例)。所得结果与国际蛛网膜下腔动脉瘤研究小组的报道一致。
近年来,随着血管内治疗技术的不断提高,球囊、支架、血管导向装置的出现使得颅内动脉瘤介入治疗的效果更为显著,而与此同时,影响手术效果和预后的因素也倍受关注,对此本研究进行了单因素和多因素Logistic回归分析,证实手术时机、术前Hunt-Hess分级、Fisher分级、AR值、合并并发症是介入术后预后的影响因素(P < 0.05),而性别、年龄、是否合并高血压、是否合并糖尿病、动脉瘤数量、动脉瘤位置和直径则与预后无关(P>0.05)。
Hunt-Hess分级是SAH术前判断病情轻重的重要工具,具有良好的重复一致性,大量研究表明,Hunt-Hess可准确评估SAH患者预后,且对治疗方案的选择具有一定的指导价值[9]。马志君研究发现,Hunt-Hess级别越低,手术效果越好,而术前Ⅳ~V级者手术预后较差,主要原因是出血量大、手术难度大、术后脑血管痉挛、再出血发生率高[10]。手术时机是影响预后的重要因素,发病至手术时间与BI指数呈现明显的负相关关系,即越晚进行手术的患者预后越差,这是因为血肿代谢产物和毒性降解产物造成的继发性脑损伤会随着时间的延长而加重[11],早期手术还可减少再出血和血管痉挛的风险,因此对于有手术指征的SAH患者应尽早行手术治疗[12]。
头部CT是SAH早期最重要的诊断手段,发病3d内,CT敏感度高达93%~100%[13],Fisher分级是通过动脉瘤破裂出血后的CT表现(主要是依据出血量和分布部位)来评估病情和判断预后的客观指标,对术后脑血管痉挛具有较高的预测价值[14],本研究显示,Fisher分级与介入栓塞手术预后密切相关,Fisher级别越高,预后不良的风险越高,可作为术前评估手术效果的依据。AR是反应动脉瘤的几何特征的指标,它表示动脉瘤长径和瘤颈直径之比,宽颈动脉瘤AR值小,本研究显示,AR值越小的患者,术后预后不良风险越高,原因是动脉瘤的瘤颈对其内血流具有控制作用,动脉瘤内涡流速度受载瘤动脉血流速度、动脉瘤与载瘤动脉的几何位置关系及瘤颈大小的影响,宽颈动脉瘤内涡流流速快,破裂后出血量大,增加了手术难度和并发症风险[15]。
手术并发症是影响预后的重要因素,其中以再出血和脑血管痉挛为主,SAH发病6h内是再出血的高峰时间,但在此之前能够接受手术治疗患者不足5%,因此有效预防再出血对改善预后至关重要[16]。防治措施包括:①绝对卧床,避免一切颅内压升高因素(烦躁、咳嗽、用力排便等);②控制血压,收缩压 < 160 mHg是适宜的,但要保证脑的灌注以免发生脑梗死;③对于无法早期手术治疗者可给予抗纤溶止血药物短期治疗。脑血管痉挛在出血后3d开始出现,2周后消失,循证医学研究证实,尼莫地平可降低脑血管痉挛引发的神经功能障碍,但并不能有效预防其发生,介入术后尽早清除蛛网膜下腔积血是防止脑血管痉挛的最有效方法,包括反复腰椎穿刺及蛛网膜下腔置管引流等[17]。
综上述,手术时机、术前Hunt-Hess分级、Fisher分级、AR值、合并并发症是介入术预后的影响因素,针对有手术指征的动脉瘤患者尽早进行手术、积极防治并发症是改善预后、提高生活质量的有效措施。
| [1] |
包庆泉, 张小兵, 黄超, 等. 破裂颅内动脉瘤介入治疗的预后因素分析[J]. 中国现代医学杂志, 2019, 43(11): 1-6. |
| [2] |
张继东. 不同治疗方案对前循环颅内动脉瘤患者临床预后及安全性的影响[J]. 卒中与神经疾病, 2018, 25(06): 693-696. |
| [3] |
Hemphill JR, Greenberg SM, Anderson CS, et al. Guidelines for the management of spontaneous intracerebral hemorrhage:A guideline for healthcare professionals from the American heart association/American stroke association[J]. Stroke, 2015, 46(7): 2032-2060. |
| [4] |
马志君. 颅内动脉瘤夹闭术后手术并发症与预后及其相关性研究[J]. 解放军预防医学杂志, 2018, 36(06): 717-719. |
| [5] |
徐苑源, 李建明, 沈洪波. Hunt-Hess分级Ⅲ~Ⅳ级颅内动脉瘤的手术时机选择及预后分析[J]. 中国临床神经外科杂志, 2018, 23(6): 410-412. |
| [6] |
曾庆, 周国平, 曾宪强, 等. 介入栓塞术与开颅夹闭术治疗颅内动脉瘤对照研究[J]. 中国实用神经疾病杂志, 2017, 20(21): 75-79. |
| [7] |
贺喜武, 张强, 李亚东, 等. 颅内动脉瘤患者介入栓塞术或开颅夹闭手术后预后的影响因素研究[J]. 实用心脑肺血管病杂志, 2017, 25(10): 50-54. |
| [8] |
盛宁, 李爱民, 孙勇. 颅内动脉瘤手术治疗的研究进展[J]. 临床神经外科杂志, 2017, 14(2): 158-160. |
| [9] |
张淇, 胡志源. 不同手术时机血管内介入栓塞治疗颅内动脉瘤临床疗效及预后相关因素分析[J]. 临床荟萃, 2016, 31(9): 990-993. |
| [10] |
Lee KM, Jo KI, Jeon P, et al. Predictor and prognosis of procedural rupture during coil embolization for unruptured intracranial aneurysm[J]. J Korean Neurosurg Soc, 2016, 59(1): 6-10. |
| [11] |
冯爱平, 黄其军, 乔伟, 等. 颅内破裂动脉瘤手术时机的选择及预后相关性研究[J]. 浙江临床医学, 2017, 19(1): 48. |
| [12] |
刘旭, 匡涛, 朱家伟, 等. 颅内动脉瘤在不同时机下行介入栓塞术的疗效评价及预后影响因素分析[J]. 实用临床医药杂志, 2014, 18(16): 81-84. |
| [13] |
黄清海, 杨鹏飞. 中国动脉瘤性蛛网膜下腔出血诊疗指导规范[J]. 中国脑血管病杂志, 2016, 13(7): 384-392. |
| [14] |
王楚涵, 段婉莹, 李姝雅, 等. 颅内动脉瘤性蛛网膜下腔出血患者血压变异性与预后的相关性研究[J]. 中国卒中杂志, 2018, 13(10): 1025-1028. |
| [15] |
Zhou G S, Song L J. Influence of different surgical timing on outcome of patients with aneurysmal subarachnoid hemorrhage and the surgical techniques during early surgery for ruptured intracranial aneurysms[J]. Turk Neurosurg, 2014, 24(2): 202-207. |
| [16] |
朱作磊, 罗良生. 动脉瘤性蛛网膜下腔出血的预后相关因素研究进展[J]. 中国临床神经外科杂志, 2016, 21(3): 183-184. |
| [17] |
张玲, 莫晔, 李应宏. 早期腰大池引流与腰椎穿刺脑脊液置换对蛛网膜下腔出血患者血管痉挛的影响[J]. 海南医学, 2016, 27(14): 2289. |
 2020, Vol. 47
2020, Vol. 47


