扩展功能
文章信息
- 蔡宇翔, 杨转移, 刘定阳, 陈晓宇, 刘涧, 杨治权
- CAI Yu-Xiang, YANG Zhuan-Yi, LIU Ding-Yang, CHEN Xiao-Yu, LIU Jian, YANG Zhi-Quan
- 颞叶与非颞叶胚胎发育不良性神经上皮肿瘤的对比分析
- A comparative analysis of dysembryoplastic neuroepithelial tumors in the temporal lobe and the extra-temporal lobe
- 国际神经病学神经外科学杂志, 2020, 47(2): 176-180
- Journal of International Neurology and Neurosurgery, 2020, 47(2): 176-180
-
文章历史
收稿日期: 2019-12-23
修回日期: 2020-03-02
胚胎发育不良性神经上皮肿瘤(dysembryoplastic neuroepithelial tumor, DNET)是一种神经元和神经胶质混合的良性肿瘤,由Daumas-Duport等于1988年首次报道[1]。DNET主要表现为反复发作的药物难治性癫痫,常见于儿童和青少年[2]。外科手术切除是DNET的主要治疗方式,大部分患者的癫痫症状在术后都能得到有效的控制。但是仍有部分患者术后癫痫症状控制不佳,而且对于DNET的手术切除范围,尚有一定争议[3]。2010年1月至2019年1月,我院共有33例癫痫患者行外科手术治疗并最终确诊为DNET。本研究对这33例患者的临床资料分组进行回顾性分析,探讨颞叶和非颞叶DNET的不同临床特点并探究影响预后的相关因素。
1 资料与方法 1.1 一般资料33例患者中颞叶肿瘤16例,非颞叶肿瘤17例。男性19例,女性14例,均以癫痫为主要临床症状,影像学可见异常表现,术后病理检查证实为DNET,术后规律服用抗癫痫药物并定期随访。根据患者的病史及发作期视频脑电图检查结果,患者的发作类型分为局灶性意识清楚发作、局灶性意识受损性发作以及全面性强直-阵挛发作。
1.2 影像学资料所有患者术前均行1.5T或3.0T磁共振检查,检查序列除T1WI和T2WI序列外,还包括成像液体衰减反转恢复序列(FLAIR)和增强T1WI序列,部分患者还包括3D-T1WI序列和2mm薄层T2WI序列。根据DNET在各个磁共振序列上的特点,其被分为3个亚型。Ⅰ型:囊样或多囊样肿瘤,在T1WI上为边界清楚的囊性或多囊性低信号,灰白质分界清晰;Ⅱ型:结节样肿瘤,在T1WI上为边界欠清的结节样或多结节样混杂信号,灰白质分界尚清;Ⅲ型:皮质发育不良样肿瘤,在T1WI上为边界欠清的皮质下异常的等信号或混杂信号,灰白质分界不清(图 1)。
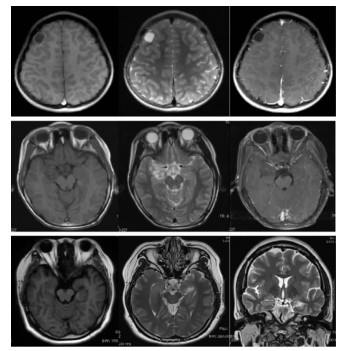
|
| A:Ⅰ型,病变呈边界清晰的囊样或多囊样结构,T1WI低信号,T2WI高信号,瘤周无水肿,增强后病灶无明显强化;B:Ⅱ型,病变呈结节样,T1WI上为边界欠清的混杂信号,T2WI上为混杂高信号,增强后同样无明显强化;C:Ⅲ型,病变常合并皮质发育不良,灰白质分界不清,T1WI上为混杂等信号或低信号,T2WI上为混杂高信号。 图 1 DNET各亚型MRI表现 |
所有患者的病理学标本采用福尔马林浸泡固定后制成石蜡切片。根据DNET的病理学特点,其同样被分为3个亚型:单纯型、复杂型和非特异型。单纯型主要由特异性胶质神经元成分构成;复杂型除特异性胶质神经元成分外,还含有胶质结节和局灶性的皮质发育不良;非特异型主要由胶质和皮质发育不良样物质构成,没有特异型胶质成分和多结节样结构。
1.4 手术策略及术后评估术前根据症状学、脑电图以及磁共振明确手术切除范围,术中行脑电监测,术后72小时内复查头部磁共振,与术前磁共振对比,评估切除程度。将肿瘤及其邻近脑回切除称为扩大切除;将肿瘤本身切除称为病灶切除;将肿瘤未全切称为部分切除。
1.5 随访评估所有患者均在出院后进行随访,随访形式为门诊复查或者电话随访,并根据Engel分级量表对患者预后进行评估。EngelⅠ级:无影响功能的癫痫发作(除外术后早期的癫痫发作);Engel Ⅱ级:仅有稀少的影响功能的癫痫发作(≤3次/年);Engel Ⅲ级:癫痫发作得到相当的改善(减少≧90%);Engel Ⅳ级:癫痫发作改善不明显或加重。EngelⅠ级视为预后良好,EngelⅡ-Ⅳ级视为预后不良。
1.6 统计学方法计量资料以均数±标准差表示,组间比较采用t检验;计数资料以数字和百分比表示,组间比较采用χ2检验(或Fisher精确检验)。采用SPSS 19.0软件进行统计学分析,P值小于0.05为差异有统计学意义。
2 结果 2.1 一般资料33例患者均以癫痫发作为主要临床症状。21例(63.63%)患者主要表现为局灶性意识受损性发作,8例(24.24%)患者主要表现为局灶性意识清楚发作,4例(12.12%)患者主要表现为全面性强直-阵挛发作。起病年龄为2月~32岁,平均11.59±7.46岁;患病时间为8天~18年,平均3.00±4.68年。手术方面,28例(84.85%)患者行扩大切除,3例(9.09%)患者行病灶切除,2例(6.06%)患者因肿瘤位于重要神经功能区,最终行部分切除(表 1)。
| 肿瘤部位 | 颞叶(n=16) | 非颞叶(n=17) | P |
| 起病年龄(岁) | 12.30±9.44 | 10.91±5.17 | 0.599 |
| 患病时间(年) | 3.87±5.93 | 2.18±3.07 | 0.309 |
| 癫痫发作类型 | 0.772 | ||
| 局灶性意识受损性发作 | 11 (68.75) | 10 (58.82) | |
| 局灶性意识清楚发作 | 3 (18.75) | 5 (29.41) | |
| 全面性强直-阵挛发作 | 2 (12.50) | 2 (11.76) | |
| MRI亚型 | < 0.001 | ||
| Ⅰ型 | 5 (31.25) | 15 (88.24) | |
| Ⅱ型 | 8 (50.00) | 0 (0.00) | |
| Ⅲ型 | 3 (18.75) | 2 (11.76) | |
| 切除范围 | 0.094 | ||
| 扩大切除 | 14 (87.5) | 9 (52.94) | |
| 局部切除 | 1 (6.25) | 5 (29.41) | |
| 部分切除 | 1 (6.25) | 3 (17.65) | |
| 病理学亚型 | 0.003 | ||
| 单纯型 | 3 (18.75) | 11 (64.71) | |
| 复杂型 | 2 (12.50) | 4 (23.53) | |
| 非特异型 | 11 (68.75) | 2 (11.76) | |
| 随访时间(年) | 2.65±2.07 | 2.13±1.89 | 0.458 |
| 预后 | 0.018 | ||
| 预后良好 | 11 (68.75) | 17 (100.00) | |
| 预后不良 | 5 (31.25) | 0 (0.00) |
共有16例(48.48%)患者的肿瘤位于颞叶,其次分别为额叶9例(27.27%)、顶叶4例(12.12%)和枕叶1例(3.03%),另外还有2例患者肿瘤累及基底节区,1例患者肿瘤位于下丘脑。MRI示DNET占位效应不明显,边界较清楚,瘤周无明显水肿。T1WI序列通常为低信号,T2WI序列通常为高信号,增强后肿瘤强化不明显。根据术前MRI对患者的DNET进行分型,20例(60.60%)患者属于Ⅰ型,8例(24.24%)患者属于Ⅱ型,5例(15.15%)患者属于Ⅲ型(表 1)。此外,有9例(27.27%)患者的MRI可以看到DENT特征性的“三角征”,6例(18.18%)患者的MRI可以看到FLAIR序列上的“环状征”(图 2)。
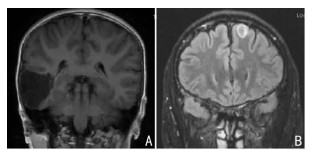
|
| A:三角征,冠状位MRI上病变呈三角形,尖端指向侧脑室;B:环状征,FLAIR序列上,肿瘤边缘与正常脑组织之间环形高信号。 图 2 DNET的特征性MRI表现 |
病理学上,14例(42.42%)患者为单纯型DNET,6例(18.18%)患者为复杂型DNET,13例(39.39%)患者为非特异型DNET(表 1)。单纯型和复杂型DNET的MRI亚型均为Ⅰ型,非特异型DNET的MRI亚型均为Ⅱ型或Ⅲ型。
2.4 预后相关影响因素所有患者均定期门诊复查并进行电话随访,随访时间为4月~8年,平均2.36±1.97年。28例(84.85%)患者达到Engel Ⅰ级,2例(6.06%)患者达到Engel Ⅱ级,3例(9.09%)患者为Engel Ⅲ级。总体预后良好率为84.85%,预后不良的5例患者均为颞叶DNET患者(P=0.018)(表 1)。与预后良好的颞叶DNET患者相比,预后不良的患者起病年龄更大(P=0.049),患病时间更长(P=0.019)(表 2)。
| 一般资料 | 预后良好 (n=11) |
预后不良 (n=5) |
P |
| 起病年龄(岁) | 9.45±7.98 | 18.60±10.11 | 0.048 |
| 患病时间(年) | 1.64±2.71 | 8.78±8.34 | 0.019 |
| 癫痫发作类型 | 0.402 | ||
| 局灶性意识受损性发作 | 7 (63.64) | 4 (80.00) | |
| 局灶性意识清楚发作 | 3 (27.27) | 0 (0.00) | |
| 全面性强直-阵挛发作 | 1 (9.09) | 1 (20.00) | |
| MRI亚型 | 0.180 | ||
| Ⅰ型 | 2 (18.18) | 3 (60.00) | |
| Ⅱ型 | 6 (54.55) | 2 (40.00) | |
| Ⅲ型 | 3 (27.27) | 0 (0.00) | |
| 切除范围 | 0.595 | ||
| 扩大切除 | 9 (81.82) | 5 (100.00) | |
| 局部切除 | 1 (9.09) | 0 (0.00) | |
| 部分切除 | 1 (9.09) | 0 (0.00) | |
| 病理学亚型 | 0.071 | ||
| 单纯型 | 2 (18.18) | 1 (20.00) | |
| 复杂型 | 0 (0.00) | 2 (40.00) | |
| 非特异型 | 9 (81.82) | 2 (40.00) | |
| 随访时间(年) | 2.88±1.98 | 2.14±2.41 | 0.527 |
随着神经影像技术和癫痫外科的发展,DNET逐渐受到人们的关注。中枢神经系统肿瘤分类将其归类为神经元及混合性神经元-胶质肿瘤,为WHO Ⅰ级[4]。DNET常见于儿童及青少年,典型的临床表现为反复发作的药物难治性癫痫,以局灶性意识受损性发作为主[5]。DNET通常位于幕上脑皮质及其邻近白质部位,颞叶为其最常见的发生部位,其次为额叶、顶叶和枕叶。此外,小脑、脑干、丘脑等位置也有报道[6, 7]。本组患者的起病年龄为11.59±7.46岁,临床表现为局灶性意识受损性发作的患者为63.63%,将近一半(48.48%)的患者肿瘤位于颞叶。将颞叶和非颞叶DNET的一般资料进行对比分析可以发现,两组患者的起病年龄、患病时间以及癫痫发作类型没有明显差别。影像学上,颞叶DNET组的MRI亚型以Ⅱ型为主(50%),非颞叶DNET组以Ⅰ型为主(88.24%)。Chassoux等[8]对DNET的MRI亚型和致痫灶之间的关系进行研究发现,MRI亚型为Ⅰ型的致痫灶与肿瘤基本重合,因此对于此类DNET行完整的肿瘤切除即可使致痫灶消失,患者可获得良好预后。而Ⅱ型和Ⅲ型的致痫灶往往比肿瘤所在范围更大,除完整切除肿瘤外,肿瘤周边的皮质也应当进行切除。当此类肿瘤位于颞叶时,应考虑行前颞叶切除术,必要时还要行杏仁核-海马切除术。此外,部分DNET患者的MRI可以观察到特征性的“三角征”和“环状征”(图 2)。“三角征”是指在MRI上尤其是冠状位影像上,DNET的形态类似三角形,在皮质层面病变分布较宽,越往深面病变的分布逐渐缩窄,呈尖端指向脑室的三角形。这种特征性的肿瘤形态可能与DNET的呈放射状异常发育的胶质纤维有关[9]。“环状征”是DNET在FLAIR序列上的特征性表现,表现为DNET和瘤周正常脑组织之间的环状高信号。有学者认为此高信号是由肿瘤边缘松散的胶质神经元成分构成的[10]。
病理学上,特异型胶质神经元成分是DNET的特征性组织形态,其主要为少突胶质细胞组成的沿神经轴索纵向排列成的柱状结构,各柱状结构之间存在黏液样基质,神经元散布于其中,如同漂浮于黏液样基质中[11]。单纯型和复杂型DNET都有特异性胶质神经元成分,但其并非DNET病理学诊断的金标准,非特异型DNET与复杂型类似,含有胶质成分或皮质发育不良,但不存在特异性胶质神经元成分。Chassoux等[11]对78例DNET患者的病理标本进行统计分析后发现,单纯型和复杂型DNET大多与MRI亚型Ⅰ型相对应,肿瘤和致痫灶的范围基本一致;非特异型DNET与MRI的Ⅱ型和Ⅲ型相对应,与Ⅱ型对应时,约一半病例的致痫灶除肿瘤外还包括瘤周区域;与Ⅲ型对应时,大部分病例的致痫灶要远大于肿瘤区域。本组患者中,单纯型和复杂型DNET的MRI亚型均为Ⅰ型,非特异型DNET的MRI亚型均为Ⅱ型或Ⅲ型。然而有文献报道Ⅱ型MRI也可与单纯型和复杂型DNET相对应,这一差别可能是因为本研究样本量较小所致[9]。颞叶DNET组和非颞叶DNET组在MRI分型和病理学分型上均存在显著性差异(P < 0.05)。颞叶组MRI分型以Ⅱ型为主,病理学分型以非特异型为主;非颞叶DNET组MRI分型以Ⅰ型为主,病理学分型以单纯型为主。提示颞叶DNET的致痫灶范围通常要比肿瘤本身的范围更大。此外,颞叶病变的致痫网络非常复杂,常累及颞叶新皮层及内侧结构。Mathern等[12]发现即便肿瘤并未累及海马,海马依然可以成为致痫灶的一部分。Aubert等[13]通过SEEG进行脑电监测发现,在非特异型颞叶内侧DNET中,致痫的异常放电早期就会快速波及颞叶新皮层结构以及颞外区域。一项电生理研究指出这种致痫灶的分布和放电特点可能与这类DNET合并瘤周皮质发育不良有关[14]。还有研究发现大多数术后仍然有癫痫发作的DNET患者的电生理和磁共振提示致痫灶残余,病理学证实残余致痫灶存在皮质发育不良,而皮质发育不良与顽固性的癫痫发作密切相关[15]。因此,致痫灶的完整切除被认为是影响DNET患者预后的重要因素。如果对于颞叶DNET仅行肿瘤切除或者扩大切除范围不够,将导致患者术后癫痫症状控制不佳。而非颞叶DNET的致痫灶范围大多与肿瘤本身的范围一致,对非颞叶DNET患者行肿瘤切除或邻近皮质切除即可获得致痫灶的完整切除。这可能是导致颞叶DNET组患者预后不及非颞叶DNET组患者的原因。
随后我们对16例颞叶DNET患者进行分组,将其分为预后良好组和预后不良组,对其一般资料、影像学资料和病理学资料进行统计学分析(表 2)。统计后发现,两组在MRI亚型、切除范围、病理学亚型上均没有明显差异(P>0.05)。预后良好组的起病年龄为9.45±7.98岁,患病时间为1.64±2.71年;而预后不良组的起病年龄为18.60±10.11岁,患病时间为8.78±8.34年。两组数据有显著性差异(P < 0.05)。提示预后不良患者的起病年龄更大,患病时间更长。这一结果与既往的研究部分一致[16, 17]。虽然既往研究发现DENT的MRI亚型和病理学亚型的致痫灶范围不同,但是本研究中未发现其对预后有明显影响,造成这一结果的可能原因是大部分病例为扩大切除,其次是样本量较小[8, 11]。Nolan等[16]对DNET术后患者的长期随访也发现MRI的亚型对预后没有明显影响,但肿瘤是否全切是预后的影响因素之一。因此,对于预后的影响因素,还需要更大样本量的研究。另外,尽管DENT是一种良性肿瘤,但对于患者的术后随访应继续定期进行,因为有长期的术后随访研究发现,部分患者会在术后出现癫痫复发,尤其是术后的1~3年,85%的患者术后1年时可达到Engel Ⅰ级,但术后平均随访4.3年后,达到Engel Ⅰ级的患者只有62%[16]。
DNET是一种可以通过手术治疗取得良好预后的中枢神经系统肿瘤。但颞叶DNET由于其癫痫网络复杂,与非颞叶DNET相比,预后相对较差。因此对于颞叶DNET患者术前应进行严格的术前评估,不仅要切除肿瘤,必要时还要对邻近脑皮质或颞叶内侧结构进行扩大切除,以充分切除致痫灶。此外,DNET的预后还与患者的起病年龄和患病时间密切相关,因此对于考虑诊断为DNET的患者,应尽早行手术治疗,以期获得良好的预后。
| [1] |
Daumas-Duport C, Scheithauer BW, Chodkiewicz JP, et al. Dysembryoplastic neuroepithelial tumor:a surgically curable tumor of young patients with intractable partial seizures. Report of thirty-nine cases[J]. Neurosurgery, 1968, 23(5): 545-556. |
| [2] |
Cabiol J, Acebes JJ, Isamat F. Dysembryoplastic neuroepithelial tumor[J]. Crit Rev Neurosurg, 1999, 9(2): 116-125. DOI:10.1007/s003290050118 |
| [3] |
Chassoux F, Daumas-Duport C. Dysembryoplastic neuroepithelial tumors:where are we now?[J]. Epilepsia, 2013, 54: 129-134. DOI:10.1111/epi.12457 |
| [4] |
Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization classification of tumors of the central nervous system:a summary[J]. Acta Neuropathol, 2016, 131(6): 803-820. DOI:10.1007/s00401-016-1545-1 |
| [5] |
Bilginer B, Yalnizoglu D, Soylemezoglu F, et al. Surgery for epilepsy in children with dysembryoplastic neuroepithelial tumor:clinical spectrum, seizure outcome, neuroradiology, and pathology[J]. Childs Nerv Syst, 2009, 25(4): 485-491. DOI:10.1007/s00381-008-0762-x |
| [6] |
Sunwoo JS, Kim JS. Cerebellar dysembryoplastic neuroepithelial tumor:report of a case and review of the literature[J]. J Neurol, 2017, 264(11): 2318-2321. DOI:10.1007/s00415-017-8630-9 |
| [7] |
Stark J, Friedman E, Thompson S, et al. Atypical presentations of dysembryoplastic neuroepithelial tumors[J]. Epilepsia, 2018, 59(1): e14-e17. |
| [8] |
Chassoux F, Rodrigo S, Mellerio C, et al. Dysembryoplastic neuroepithelial tumors:an MRI-based scheme for epilepsy surgery[J]. Neurology, 2012, 79(16): 1699-1707. DOI:10.1212/WNL.0b013e31826e9aa9 |
| [9] |
Isler C, Erturk Cetin O, Ugurlar D, et al. Dysembryoplastic neuroepithelial tumors:clinical, radiological, pathological features and outcome[J]. Br J Neurosurg, 2018, 32(4): 436-441. DOI:10.1080/02688697.2018.1476671 |
| [10] |
Paudel K, Borofsky S, Jones RV, et al. Dysembryoplastic neuroepithelial tumor with atypical presentation:MRI and diffusion tensor characteristics[J]. J Radiol Case Rep, 2013, 7(11): 7-14. |
| [11] |
Chassoux F, Landré E, Mellerio C, et al. Dysembryoplastic neuroepithelial tumors:epileptogenicity related to histologic subtypes[J]. Clin Neurophysiol, 2013, 124(6): 1068-1078. DOI:10.1016/j.clinph.2012.11.015 |
| [12] |
Mathern GW, Babb TL, Pretorius JK, et al. The pathophysiologic relationships between lesion pathology, intracranial ictal EEG onsets, and hippocampal neuron losses in temporal lobe epilepsy[J]. Epilepsy Res, 1995, 21(2): 133-147. |
| [13] |
Aubert S, Wendling F, Regis J, et al. Local and remote epileptogenicity in focal cortical dysplasias and neurodevelopmental tumours[J]. Brain, 2009, 132(Pt11): 3072-3086. |
| [14] |
Ferrier CH, Aronica E, Leijten FS, et al. Electrocorticographic discharge patterns in glioneuronal tumors and focal cortical dysplasia[J]. Epilepsia, 2006, 47(9): 1477-1486. DOI:10.1111/j.1528-1167.2006.00619.x |
| [15] |
Pasquier B, Péoc'HM, Fabre-Bocquentin B, et al. Surgical pathology of drug-resistant partial epilepsy. A 10-year-experience with a series of 327 consecutive resections[J]. Epileptic Disord, 2002, 4(2): 99-119. |
| [16] |
Nolan MA, Sakuta R, Chuang N, et al. Dysembryoplastic neuroepithelial tumors in childhood:long-term outcome and prognostic features[J]. Neurology, 2004, 62(12): 2270-2276. DOI:10.1212/01.WNL.0000130495.69512.6F |
| [17] |
Hennessy MJ, Elwes RD, Honavar M, et al. Predictors of outcome and pathological considerations in the surgical treatment of intractable epilepsy associated with temporal lobe lesions[J]. J Neurol Neurosurg Psychiatry, 2001, 70(4): 450-458. DOI:10.1136/jnnp.70.4.450 |
 2020, Vol. 47
2020, Vol. 47




