扩展功能
文章信息
- 贺淑慧, 孙洪英
- HE Shu-Hui, SUN Hong-Ying
- 多药耐药相关蛋白1基因多态性及蛋白表达与癫痫患者耐药机制关系的研究
- Association of polymorphisms and protein expression of the multidrug resistance-associated protein 1 gene with drug resistance in patients with epilepsy
- 国际神经病学神经外科学杂志, 2020, 47(2): 141-147
- Journal of International Neurology and Neurosurgery, 2020, 47(2): 141-147
-
文章历史
收稿日期: 2019-08-05
修回日期: 2019-12-17
多药耐药相关蛋白1(multidrug resistance-associated protein 1, MRP1)属于细胞表面转运蛋白的ATP结合盒蛋白家族,参与多种内源性和外源性分子的运输,MRP1蛋白表达的增加可阻碍抗癫痫药物(anti-epileptic drugs, AED)通过血脑屏障,这使得AED在癫痫灶周围难以达到有效的抗癫痫药物浓度,导致耐药的出现。本研究采用DNA测序的方法对癫痫患者的血标本进行MRP1基因G128C(rs41395947)、C218T(rs41494447)、G2168A(rs4148356)、G3173A(rs41410450)四个位点多态性检测并进行分析,探究上述四个位点是否存在多态性及其在AED耐药组和AED敏感癫痫患者中分布频率,采用ELISA方法分析MRP1蛋白表达,采用化学发光法检测AEDs血药浓度,探讨MRP1基因多态性更易导致哪种AED耐药及MRP1蛋白表达与癫痫耐药的关系,从而我们从遗传学的角度能够进一步对癫痫的发生完善在分子生物学水平上的探究,更好地早期识别诊断癫痫,对癫痫患者采取个体化的治疗,更加有效的控制癫痫的反复发作,减少其对大脑造成不可逆的损伤。
1 对象与方法 1.1 研究对象通过癫痫患者调查问卷,收集2017年11月至2018年6月就诊于包头医学院第一附属医院门诊和病房以及包头市中心医院癫痫门诊的癫痫患者共98例,诊断符合2014年国际抗癫痫联盟(International League Against Epilepsy, ILAE)关于癫痫的诊断标准[1, 2, 11],均经视频脑电图及头颅MRI证实。
患者分组如下[2],AED耐药组:癫痫患者接受两种或两种以上抗癫痫药物治疗,观察两年后,癫痫发作未见明显改善(12个月内仍有发作或者发作间期小于三个治疗前发作间期),共31例,男16例,女15例。AED敏感组:患者服用抗癫痫药物一年后,癫痫发作频率及症状较前有明显改善,共67例,男35例,女32例。
排除标准:①神经学检查或MRI检查发现颅脑肿瘤、血管损伤或畸形及癫痫发作相关的脑软化灶;②明确的引发癫痫的致病因素如产伤、感染、头部外伤等;③患有智力障碍、神经系统遗传性或发作性疾病、精神心理障碍等;④直系亲属三代内与遗传相关的常染色体显性癫痫遗传方式。
该实验经我院伦理委员会及包头市中心医院伦理委员会审查,所有入选患者在入选前均签署知情同意书。
1.2 实验试剂及仪器氢氧化钠、冰乙酸(acetic acid)、三羟甲基氨基甲烷(tris base)、乙二胺四乙酸(EDTA),购自天津市化学试剂三厂;琼脂糖,购自生工生物工程(上海)股份有限公司;无水乙醇,购自天津华东试剂厂;Eppendorf管、一次性吸头(0.5~10 μl、20~200 μl、200~1 000 μl),购自美国Axygen公司;一次性吸管,购自美国KIRGEN公司;恒温水浴箱、37℃恒温箱,购自上海新苗医疗器械制造有限公司;低温离心机、普通离心机,购自湘仪离心机厂;移液枪,购自Thermo公司;Rayto酶标分析仪,购自雷杜生命科学股份有限公司;Sartorius电子天平,购自德国赛多利斯公司;-20℃冰箱、-80℃冰箱、4℃冰箱,购自西门子公司。
1.3 方法 1.3.1 一般资料及标本收集通过问卷调查的方法收集患者的年龄、性别、病程、用药时间等,对两组间上述基本资料进行统计学检验,差异不具有统计学意义(P>0.05)。收集符合标准的癫痫患者空腹8 h的肘静脉血6 ml于EDTA抗凝管中。
1.3.2 MRP1浓度检测所有样本血清均用华美生物工程有限公司提供的酶免人多药耐药相关蛋白1试剂盒在同等条件下测量MRP1浓度。实验前把标准品按倍数稀释备用,在酶标包被板上设立对照孔、标准孔、待测孔,各加样50 μl,先将40 μl稀释液加入待测测样品孔,然后再加稀释5倍后的10 μl待测样品用封板膜封住板后,小心置于37℃水浴箱恒温温育30 min;用蒸馏水将浓缩洗涤液稀释30倍;静置30 s后弃去,重复5次;将50 μl酶标试剂加入标准孔及待测孔;用封板膜封住板后,小心置于37℃水浴箱恒温温育30 min;依次向每个空加入着色剂、显色剂,各50 μl,震荡,置于37℃恒温箱,黑暗处理10 min;向三个孔中加入50 μl终止液终止反应。在将空白孔调节至零后,通过酶标分析仪在450 nm的波长下测量每个孔的吸光度(OD值),并在此时记录。该步骤在添加终止溶液后15 min内完成;根据OD值计算各样本的MRP1浓度,再乘以五,得出最终样本MRP1浓度。
1.3.3 提取样本DNA所有EDTA抗凝管收集的全血,用Axyprep血基因组DNA试剂盒根据说明书提取样本DNA:加500 μl Buffer AP1到1.5 ml离心管中;将200 μl抗凝全血(绿帽管血液)加入缓冲液AP1中,来回吸注几次,使残留在尖端的血液完全溶解。盖紧离心管盖子,旋涡振荡10 s;加100 μl Buffer AP2,旋涡振荡10 s;12 000 r/min,离心10 min。将滤液加入到制备管中,离心1 min,12 000 r/min。弃滤液后重复步骤5,加入700 μl Buffer W1A,室温放置2 min后12 000×g离心30 s。将制备管置回到原2 ml离心管中,加入500 μl Buffer W2到制备管中,12 000×g离心1 min。所有样本均送至北京阅微基因技术有限公司进行MRP1基因的4个单核苷酸多态性(SNP)位点测序。
1.3.4 DNA琼脂糖凝胶电泳检测提前配置50×TAE缓冲液(称量Tris base 242 g,EDTA 18.612 g于1L烧杯中;向烧杯中加入约800 ml去离子水并充分混合;加入57.1 ml的Acetic acid,充分溶解;用NaOH调节pH至8.3,用去离子水稀释至1 L,并在室温下储存。使用时稀释50倍,即1×TAE Buffer)及6×loading Buffer[30 mM EDTA、36%(v/v) Glycerol、0.05%(w/v) Xylene Cyanol FF、0.05%(w/v) Bromophenol Blue]。
配制1%琼脂糖凝胶:琼脂糖0.4 g加入40 ml×TAE缓冲液,用EB染色。点样:5 μl提取样本DNA与1 μL loading Buffer混匀后加样,5 μL 100bp Marker,100 V电压电泳,照相得到凝胶电泳效果图片。
1.3.5 测定卡马西平、丙戊酸钠血药浓度将血样送至包头医学院第一附属医院核医学科,通过西门子公司生产的ADVIA Centaur XP仪器采用化学发光免疫法进行检测卡马西平及丙戊酸钠的血药浓度。
1.4 统计学分析使用SPSS 21.0统计软件分析数据。计量资料数据采用均数±标准差(x±s)表示,组间比较采用成组t检验;计数资料以例数表示,组间比较采用χ2检验。采用多因素logistic回归分析评估耐药的影响因素。P < 0.05表示差异有统计学意义。
2 结果 2.1 AED耐药组和AED敏感组一般临床资料比较本实验一共收集98例癫痫患者,AED耐药组与AED敏感组在年龄、性别、病程时间、用药时间上差异无统计学意义(P>0.05)。见表 1。
| 组别 | 例数 | 性别(男/女,例) | 年龄(x±s,岁) | 病程(x±s,月) | 用药时间(x±s,月) |
| AED耐药组 | 31 | 16/15 | 31.77±12.27 | 244.71±119.38 | 38.90±25.93 |
| AED敏感组 | 67 | 32/35 | 26.31±11.99 | 190.70±108.89 | 26.81±24.19 |
| t/χ2值 | 0.126 | 2.082 | 2.215 | 2.250 | |
| P值 | 0.723 | 0.040 | 0.029 | 0.027 |
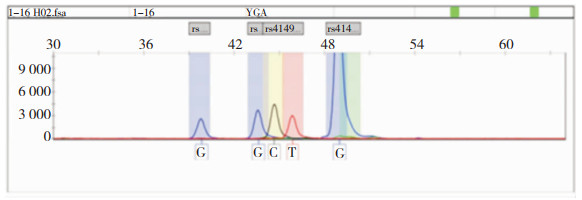
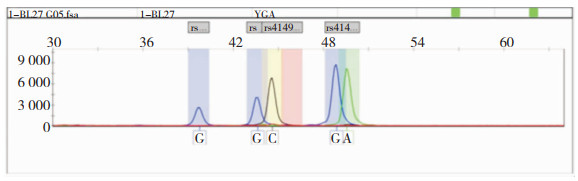
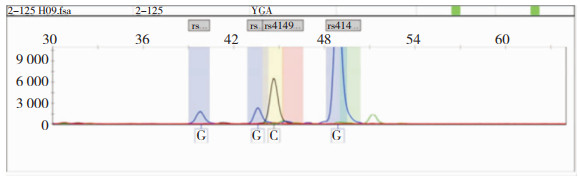
所有样本DNA提取后,均至于-20℃冰箱保存,在保温条件下一起送至北京阅微基因技术有限公司进行MRP1基因的128G>C、218C>T、2168G>A、3173G>A四个位点测序。SNP测序结果见图 1、图 2、图 3。
|
| 图 1 MRP1基因218C>T(rs41494447)位点突变图,仅可见C→T转换 |
|
| 图 2 MRP1基因2168G>A(rs4148356)位点突变图,仅可见G→A转换 |
|
| 图 3 MRP1基因128G>C(rs41395947)、3173G>A(rs41410450)位点突变图,未见突变 |
送检的98份DNA样本中,所检测MRP1基因的128G>C(rs41395947)、218C>T(rs41494447)、2168G>A(rs4148356)、3173G>A(rs41410450)位点序列,其中128G>C(rs41395947)、3173G>A(rs41410450)位点未见突变,均以纯合子GG型存在;218C>T(rs41494447)位点可见C→T转换5例;2168G>A(rs4148356)位点可见G→A转换9例。见表 2。
| 指标 | 218C>T(rs41494447) | 2168G>A(rs4148356) | ||
| 基因频数 | C | 191 | G | 187 |
| T | 5 | A | 9 | |
| 基因型频数 | CC | 93 | GG | 89 |
| CT | 5 | GA | 9 | |
| TT | 0 | AA | 0 | |
| Hardy-Weinber 平衡定律检验 |
χ2值 | 0.067 | χ2值 | 0.227 |
| P值 | 0.796 | P值 | 0.634 | |
MRP1基因G128C(rs41395947)、C218T(rs41494447)、G2168A(rs4148356)、G3173A(rs41410450)四个位点的基因型的观察值和预期值之间的差异没有统计学意义(P>0.05),提示四个位点SNP分布符合Hardy-Weinberg平衡定律,群体基因遗传平衡,样本代表性良好。见表 2。
2.3 AED耐药组与AED敏感组样本基因频数及基因型频数AED耐药组MRP1 218位CT基因型所占比例为80%,AED敏感组MRP1 218位CC基因型所占频率为20%,前者高于后者,两者差异无统计学意义(P>0.05);AED耐药组MRP1 2168位GA基因型所占比例为67%,AED敏感组MRP1 2168位GA基因型所占频率为33%,前者高于后者,两者差异有统计学意义(P < 0.05)。见表 3。
| 分组 | 218C>T(rs41494447) | TT | 2168G>A(rs4148356) | AA | ||||||
| C | T | CT | CC | G | A | GA | GG | |||
| AED耐药组 | 58(93.5) | 4(6.5) | 4(12.9) | 27(87.1) | 0 | 56 | 6 | 6(67) | 25(28) | 0 |
| AED敏感组 | 133(99.3) | 1(0.7) | 1(1.5) | 66(98.5) | 0 | 131 | 3 | 3(33) | 64(72) | 0 |
| χ2值 | 5.550 | 5.699 | 5.354 | 5.624 | ||||||
| P值 | 0.018 | 0.017 | 0.021 | 0.018 | ||||||
MRP1 218位点基因CC型与CT型的卡马西平、丙戊酸钠血药浓度差异无统计学意义(P>0.05)。见表 4。
| 测定指标 | CC | CT | t值 | P值 |
| 丙戊酸钠血药浓度 | 60.56±20.76 | 58.17±18.36 | 0.217 | 0.829 |
| 卡马西平血药浓度 | 5.45±1.55 | 3.98±1.65 | 1.754 | 0.090 |
MRP1 2168位点基因GA型癫痫患者卡马西平、丙戊酸钠血药浓度均值低于GG型,差异有统计学意义(P < 0.05)。见表 5。
| 测定指标 | GG | GA | t值 | P值 |
| 丙戊酸钠血药浓度 | 60.36±20.68 | 40.95±18.02 | 2.594 | 0.012 |
| 卡马西平血药浓度 | 5.23±1.67 | 2.98±0.98 | 3.906 | < 0.001 |
AED耐药组MRP1蛋白的浓度与AEDs敏感组相比明显增高,两组差异有统计学意义(P < 0.05)。见表 6。
| 分组 | 例数 | MRP1浓度 | t值 | P值 |
| AED敏感组 | 67 | 46.64±29.83 | -6.407 | < 0.001 |
| AED耐药组 | 31 | 92.88±39.69 |
98例不同基因型癫痫患者血清中MRP1蛋白表达水平(平均光密度,OD)如下,MRP1 218位CC基因型与CT基因型患者MRP1蛋白平均光密度值差异无统计学意义(P>0.05);MRP1 2168位GG基因型和GA基因型患者MRP1蛋白平均光密度值差异无统计学意义(P>0.05)。见表 7、表 8。
| 基因型 | 例数(n) | MRP1 OD值 | t值 | P值 |
| MRP1 218CC | 27 | 0.26±0.05 | 0.605 | 0.550 |
| MRP1 218CT | 4 | 0.24±0.04 |
| 基因型 | 例数(n) | MRP1 OD值 | t值 | P值 |
| MRP1 2168GG | 58 | 0.26±0.04 | 0.591 | 0.557 |
| MRP1 2168GA | 9 | 0.25±0.06 |
以患者耐药情况为因变量,以年龄、病程、用药时间、MRP1浓度和218位基因型5项单因素分析有统计学意义的指标为自变量,进行多因素logistic回归分析。结果显示,MRP1浓度和218位基因型为耐药的独立危险因素,有统计学意义(P < 0.05)。从上述2项指标的OR值可以看出,MRP1浓度每升高1个单位,患者发生耐药的风险增加1.049倍;218位基因型中C/T型发生耐药的风险是C/C型的13.264倍。见表 9。
| 影响因素 | B | Wald | P | OR | 95%CI |
| 年龄 | 0.037 | 0.876 | 0.349 | 1.038 | 0.96~1.122 |
| 病程 | 0.001 | 0.073 | 0.787 | 1.001 | 0.993~1.01 |
| 用药时间 | 0.017 | 1.949 | 0.163 | 1.017 | 0.993~1.042 |
| MRP1浓度 | 0.048 | 18.078 | < 0.001 | 1.049 | 1.026~1.073 |
| 218位基因型(与CC型比较) | 2.585 | 4.193 | 0.041 | 13.264 | 1.117~157.463 |
以患者耐药情况为因变量,以年龄、病程、用药时间、MRP1浓度和2168位基因型5项单因素分析有统计学意义的指标为自变量,进行多因素logistic回归分析。结果显示,MRP1浓度和2168位基因型为耐药的独立危险因素,有统计学意义(P < 0.05)。从上述2项指标的OR值可以看出,MRP1浓度每升高1个单位,患者发生耐药的风险增加1.046倍;2168位基因型中G/A型发生耐药的风险是G/G型的8.560倍。见表 10。
| 影响因素 | B | Wald | P | OR | 95%CI |
| 年龄 | 0.039 | 0.980 | 0.322 | 1.040 | 0.962~1.124 |
| 病程 | 0.004 | 0.772 | 0.380 | 1.004 | 0.996~1.012 |
| 用药时间 | 0.022 | 2.784 | 0.095 | 1.022 | 0.996~1.048 |
| MRP1浓度 | 0.045 | 15.346 | < 0.001 | 1.046 | 1.023~1.069 |
| 2168位基因型与(与GG型比较) | 2.147 | 4.109 | 0.043 | 8.560 | 1.074~68.236 |
迄今为止,耐药性癫痫的发病机制主要涉及以下几个方面:①基因突变导致钠通道功能缺陷,进而导致严重肌阵挛等;②先天性脑发育异常导致的神经网络异常;③某些自身抗体的存在;④耐药基因的存在。MRP1蛋白在血脑屏障(blood-brain barrier, BBB)的血管内皮细胞过度表达[3],通过消耗能量将抗癫痫药物从细胞内运输至细胞外,从而降低脑内致痫灶周围抗癫痫药物浓度,大大降低药效,导致耐药的发生[4]。近年来,人们对MRP1基因的单核苷酸多态性(single-nucleotide polymorphisms, SNPs)进行了广泛的研究,研究表明编码区的多个遗传变异能够影响MRP1的功能。例如G2168A(Arg723gln)可以影响卵巢癌患者对化疗的敏感性;G1299T(Arg 433ser)通过减少HeLa细胞内药物积累而产生对阿霉素的耐药性;G3173A(Arg 1058gln)的变异增加了Hek 293和cho-K1细胞对依托泊苷的反应。
据报道,单核苷酸多态性(SNPs)与耐药有关,特别是通过阻断电压门控钠(NA)通道[5, 6]。NA通道神经元Ⅰ型α亚单位(SCN1A)编码NAV1.1NA通道的α亚基,被认为与抗癫痫药物耐药有关。本研究在98例癫痫患者中探讨了MRP1基因SNPs与癫痫耐药的关系,AED耐药组和AED敏感组癫痫患者MRP1基因G128C(rs41395947)、C218T(rs41494447)、G2168A(rs4148356)、G3173A(rs41410450)四个位点,DNA测序显示,MRP1 G128 C和G3173 A位点没有基因突变,单核苷酸多态性存在于MRP1 C218 T和G2168 A的两个位点,但是AED耐药组与AED敏感组MRP1 C218T(rs41494447)多态性分布无显著差异;而MRP1 G2168A(rs4148356)多态性在AED耐药组与AED敏感组分布差异有差异。
陈海燕等[7]通过实验建立了耐药性癫痫大鼠模型,通过RT-PCR等技术发现癫痫模型组海马MRP1 mRNA及其表达产物明显高于对照组,耐药性癫痫患者MRP1基因型的检测可能为新型药物的研发提供有价值的参考。国外学者研究发现,海马硬化相关癫痫患者的海马旁回血管内皮细胞中MRP1表达增加[8, 12, 4];另外,MRP1蛋白的含量与癫痫患者病史的长短也存在一定关系,病程越长,该蛋白可能表达越多,预示着病程越长,发生耐药的风险性越高[7, 9, 14]。
本研究还发现MRP1蛋白在AED耐药组的表达高于AED敏感组,考虑MRP1蛋白高表达可能是引起癫痫患者耐药的一个因素,与学者陈海燕等[7]的研究结果一致。我们在研究抗癫痫药物卡马西平、丙戊酸钠与MRP1基因多态性的关系中,最初的假设是MRP1基因多态性的出现可能会引起MRP1蛋白表达的增加,阻碍抗癫痫药物进入血脑屏障,无法有效控制癫痫的发作,从而增加了癫痫的发作频率,发展为耐药性癫痫;但在研究发现卡马西平、丙戊酸钠的血药浓度在MRP1基因2 168位GG、GA基因型患者中有显著性差异,GA基因型患者这两种抗癫痫药物血药浓度低于GG基因型,考虑癫痫患者MRP1基因在2168位点发生G到A突变者更易出现对卡马西平、丙戊酸钠耐药。我们在研究初期假设MRP1多态性的存在与癫痫耐药的发生有关,但在本研究中我们发现MRP1 218位基因与MRP1 2168基因中不同基因型MRP1蛋白平均光密度值的比较,提示MRP1基因多态性可能不是导致MRP1高表达的原因,可能存在其他导致MRP1蛋白高表达的因素。
本研究认为MRP1基因G2168A SNP的存在可能通过影响AED血药浓度,进而导致癫痫耐药的发生。这是首次发现G2168A (rs4148356)与卡马西平、丙戊酸钠耐药之间的关系,但具体的机制尚不清楚,国内很多研究发现癫痫耐药患者中存在MRP1蛋白的高表达,为什么发生耐药后MRP1蛋白浓度会升高,我们发现与MRP1 2 168、218位点单核苷酸多态性无关,是否由其他基因突变引起,还需要进一步研究。
| [1] |
Fisher RS. Final Comments on the Process:ILAE Definition of Epilepsy[J]. Epilepsia, 2014, 55(4): 492-493. |
| [2] |
Fisher RS, Cross JH, French JA, et al. Operational classification of seizure types by the International League Against Epilepsy:Position Paper of the ILAE Commission for Classification and Terminology[J]. Epilepsia, 2017, 58(4): 522-530. |
| [3] |
Jinming JI, Gang LI, Yunxia MA, et al. Expression of Multidrug Resistance Genes in Peripheral Blood of Patients with Refractory Epilepsy and the Reverse Effect of, Oxcarbazepine on Its Expression[J]. Iran J Public Health, 2018, 47(1): 40-48. |
| [4] |
Hauser RM, Henshall DC, Lubin FD. The epigenetics of epilepsy and its progression[J]. Neuroscientist, 2018, 24: 186-200. |
| [5] |
Abo EFW, Abd ENS, Habib MS, et al. The potential implication of SCN1A and CYP3A5 genetic variants on antiepileptic drug resistance among Egyptian epileptic children[J]. Seizure, 2016, 41: 75-80. |
| [6] |
Zhang HL, Lin YH, Qu Y, et al. The effect of miR-146a gene silencing on drug-resistance and expression of protein of P-gp and MRP1 in epilepsy[J]. Eur Rev Med Pharmacol Sci, 2018, 22: 2372-2379. |
| [7] |
陈海燕, 黄建敏, 李雪斌, 等. 耐药性癫痫患者外周血铁调节转运体-1基因及蛋白表达的研究[J]. 中风与神经疾病杂志, 2018, 35(6): 513-516. |
| [8] |
Sun Y, Luo X, Yang K, et al. Neural overexpression of multidrug resistance-associated protein 1 and refractory epilepsy:a meta-analysis of nine studies[J]. Int J Neurosci, 2016, 126: 308. |
| [9] |
Henshall DC, Hamer HM, Pasterkamp RJ, et al. MicroRNAs in epilepsy:pathophysiology and clinical utility[J]. Lancet Neurol, 2016, 15: 1368-1376. |
| [10] |
A Novel Scoring System to Evaluate the Efficacy of Vagus Nerve Stimulation for Pediatric Drug-Resistant Epilepsy[J]. Child Neurol, 2019, 12(16): 1-3.
|
| [11] |
Hemispherotomy for drug-resistant epilepsy in an Indonesian population[J]. Epilepsy Behav Rep, 2019, 12(5): 12-18.
|
| [12] |
Surgical treatment of drug-resistant epilepsy caused by gliomas in eloquent areas: experience report[J]. Arq Neuropsiquiatr, 2019, 77(11): 34-42.
|
| [13] |
Potassium citrate supplementation with ketogenic dietary therapy for drug-resistant epilepsy[J]. Dev Med Child Neurol, 2020, 62(1): 25-36.
|
 2020, Vol. 47
2020, Vol. 47




