扩展功能
文章信息
- 钟懿, 熊晓星
- ZHONG Yi, XIONG Xiao-Xing
- U0126介导T细胞亚型增殖在缺血性脑卒中的神经保护作用及机制研究
- Neuroprotective effect and mechanism of U0126-mediated T cell subset proliferation in ischemic stroke
- 国际神经病学神经外科学杂志, 2020, 47(2): 111-115
- Journal of International Neurology and Neurosurgery, 2020, 47(2): 111-115
-
文章历史
收稿日期: 2019-11-28
修回日期: 2020-04-02
由于脑血流的突然中断引发的缺血性脑卒中是全球残疾和死亡的第二大原因[1],然而当前脑卒中的治疗,包括静脉溶栓和机械取栓的实施具有明显的条件严苛性和局限性,仅轻微改善了现状。这促使人们越来越关注于如何从病理生理机制入手来延缓病情进展以减轻患者痛苦。T细胞是继发性卒中进展的主要调节因子,在大脑受到缺血刺激后数小时至数天内完全激活,并驱动强烈的急性炎症反应[2-3]。动物实验中缺乏淋巴细胞的转基因小鼠在短暂性大脑中动脉阻塞(transient middle cerebral artery occlusion, tMCAO)处理后表现出病变缩小,而通过脾细胞的过继转移恢复免疫缺陷动物的淋巴细胞群逆转了这种保护作用,其梗死体积与野生型动物相似[2]。并且,抗体介导的单个T细胞亚群的耗竭,同样减缓了继发性病变的进展[2]。
丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)是存在于胞内的一组重要信号转导系统,在缺血性脑卒中后被迅速激活参与调控各种细胞活动[4]。然而,Jun氨基端激酶(Jun amino-terminal kinase, JNK)和p38 MAPK的过度激活常常与神经元死亡/凋亡密切相关[5],U0126是丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase, MEK)1/2特异且高效的抑制剂,能够在体外和体内抑制ERK1/2的活化, 阻断ERK的磷酸化及信号传递[5]。多项研究已经证实[6-9],用MEK1/2抑制剂U0126治疗可减少实验性局灶性缺血性脑卒中后的梗死面积,缓解神经功能缺损,并改善长期的功能恢复。此外,选择性ERK激活还与T淋巴细胞的增殖有关[10],因此,本研究主要通过构建小鼠tMCAO模型,探讨U0126在缺血性脑卒中的保护效应,以及初步阐明该效应可能的发生机制。
1 材料与方法 1.1 实验动物及分组野生型(Wild Type, WT)C57BL/6J小鼠40只,严重联合免疫缺陷(severe combined immunodeficiency disease, SCID)小鼠40只,体重20~25 g,购买于湖北省疾病预防控制中心(43004700018871)。小鼠均繁殖饲养于武汉大学人民医院动物实验中心,实验前自由进食进水。
分别将WT小鼠和SCID小鼠均随机分为sham组、sham+U0126(2 g/L)组、MCAO组及MCAO+U0126组,每组各10只,每天固定时间腹腔注射给药1次,连续7 d,末次给药1 h后进行手术,手术后继续每天给药1次直至术后48 h取材。sham组和MCAO组每次给予等量生理盐水,其余实验步骤相同。
1.2 试剂与仪器MAPK/ERK1/2抑制剂U0126购自英国Abcam公司(ab120241);ConA购自美国Sigma-Aldrich公司(C2272);3H-胸腺嘧啶购自上海易汇生物科技有限公司(IR-70170);β液闪仪购自美国PerkinElmer公司(Quantulus GCT 6220);玻璃纤维过滤器购自上海联硕生物科技有限公司(431412)。
1.3 大脑中动脉模型制作使用5%异氟烷吸入麻醉小鼠,术中异氟烷浓度保持在1%~2%。仰卧位固定,颈部中线切开,钝性分离大鼠左侧皮下组织和肌肉,暴露左侧颈总动脉、颈外动脉及颈内动脉,结扎颈外动脉分支,结扎颈总动脉近心端(距分叉点约1.0 cm),用动脉夹暂时阻断颈总动脉的远心段(距分叉点约0.5 cm),在颈总动脉远心端和近心端之间,剪开一小切口,于颈外动脉内插入一6~0单丝线栓直达大脑中动脉主干的起始部。随后,扎紧远心端备用线,固定尼龙线。假手术组线栓只插入0.5 cm左右。缺血60 min后,将线栓轻轻取出。整个手术过程中小鼠体温恒定保持于37±0.5℃,严密监测呼吸、心律、氧饱和度、动脉氧分压,二氧化碳分压、pH值及脑血流改变。再灌注后不同时间,称重,采用双盲法评估小鼠神经功能情况包括转身实验,前肢上台实验,前肢应用协调实验等[11]。
1.4 2% 2, 3, 5-氯化三苯基四氮唑(TTC)法测量脑梗死体积卒中后72 h评估脑梗死体积。异氟烷深度麻醉小鼠后处死,断头取脑,将鼠脑置入专用的切片模具中,沿冠状位作2 mm的连续切片,置于2%的TTC中浸泡30 min,避光,均匀染色后浸于4%多聚甲醛中固定过夜,染成红色的为正常脑组织,白色为梗死脑组织。使用NIH Image J软件处理数据,通过矫正脑水肿而计算脑组织损伤程度,即测量梗死对侧整个大脑半球面积和梗死同侧正常半球面积,两者相减得到梗死面积,其结果乘以切片厚度(2 mm)即为梗死体积。整个半球的梗死程度由5片大脑切片梗死体积相加而来。最终结果以梗死体积占对侧大脑皮质体积的百分比表示。首先计算每个层面脑片的梗死面积,再将各脑片梗死面积之和乘以厚度(2 mm)为总的梗死体积[11]。
1.5 脾脏切除与增殖能力实验MCAO术后第3天,异氟烷深度麻醉小鼠后处死,仰卧位固定,剪净小鼠左侧腹部毛发,经75%酒精消毒后,于无菌条件下剪开皮肤和腹膜,翻开其余脏器并剥离脂肪组织找出脾脏并摘除,置于5 mlEP管中称重,比较各组小鼠间脾脏大小。用1 640完全培养基冲洗脾脏,收集细胞,用新培养基重悬细胞,调整细胞浓度为2.6×105。按分组铺板,每组设3孔,每孔100 μL细胞,并加入适量2 μg/mL的ConA,同时设阴性对照,37℃、5%CO2孵育66 h。随后加入3H-胸腺嘧啶,继续培养18 h。将细胞收集至玻璃纤维过滤器上,烤干后β液闪仪计数,结果以每分钟计数(counts per minutes, CPM)表示,每天至少重复检测3次[12-13]。
1.6 统计学处理采用SPSS 18.0软件进行统计学处理。实验数据以均数±标准差表示, 多组间均数比较采用单因素方差分析(One-way ANOVA),组间两两比较应用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 T细胞缺陷对小鼠脑缺血再灌注损伤后梗死体积的影响MCAO后60 min及75 min的SCID组小鼠与WT组相比脑梗死体积均显著减小(P < 0.05)。见图 1。
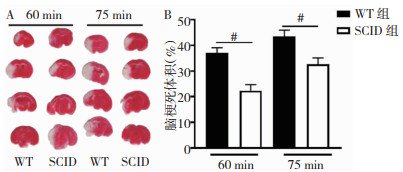
|
| 注:A:TTC染色结果图;B:两组比较的统计学结果,#为SCID组与WT组比较,P < 0.05 图 1 MCAO后60 min及75 min的SCID组小鼠与WT组脑梗死体积比较 |
建立MCAO模型75 min后,与对照组相比,U0126组脑梗死体积明显减小(P < 0.05)(图 2)。
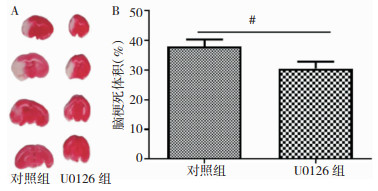
|
| 注:A:TTC染色检测U0126对CIRI小鼠脑梗死体积的影响;B:两组脑梗死体积的比较。#为与对照组相比,P < 0.05 图 2 U0126对小鼠脑缺血再灌注损伤后脑梗死体积的影响 |
与WT组相比,U0126的添加并未明显减小SCID小鼠的脑梗死面积,反而使梗死体积增大了(P < 0.05)。见图 3。
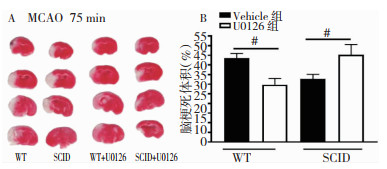
|
| 注:A:四组TTC染色效果图;B:四组梗死体积的量化结果比较。#为Vehicle组与U0126组比较,P < 0.05 图 3 T细胞缺乏对U0126神经保护作用的影响 |
MCAO 75 min后分别提取五组小鼠的脾脏进行比较,发现U0126的应用可减小缺血性脑卒中后脾脏萎缩的程度(P < 0.05)。见图 4。
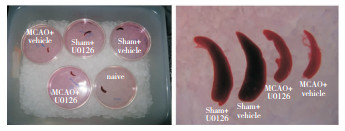
|
| 图 4 脑缺血再灌注后各组脾脏体积的变化与对比 |
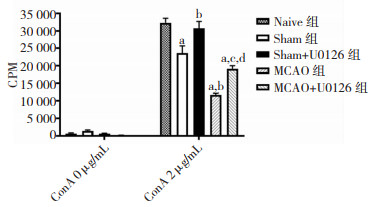
使用2 μg/ml的ConA刺激T细胞增生后,U0126恢复了其在脑缺血再灌注损伤中的保护作用,促进了脾细胞的增殖(P < 0.05)。见图 5。
|
| 注:a为与Naive组比较;b为与Sham组比较;c为与Sham+U0126组比较;d为与MCAO组比较;P值均 < 0.05 图 5 MCAO 72 h后U0126对脾脏增殖的影响,P < 0.05 |
缺血性脑卒中是一种危及生命的疾病,也是全球致残致死的主要原因之一,它能导致多种神经功能缺陷,包括运动受限、认知功能障碍和抑郁等,影响患者的生活质量。由于卒中发病率日益攀升,现有防治措施局限颇多,因而探寻新型治疗途径迫在眉睫。U0126是一种ERK1/2抑制剂,本研究发现,在小鼠tMCAO模型中,U0126的施用可减小脑梗死体积,有望成为新型的神经保护剂。在脑缺血急性期,由于脑血流量的骤然减少,引发一系列分子事件,如兴奋性毒性、氧化应激和炎症免疫反应等,活性氧、活性氮等氧化应激产物通过作用于相应受体、钙通道或酪氨酸激酶诱导ERK1/2的活化,活化的ERK1/2随后与胞浆成分相互作用或进行核转位,促进细胞死亡[14]。此外,该通路也可增加炎症介质的释放,刺激血管收缩受体和基质金属蛋白酶的表达,恶化神经损伤[9]。U0126是一种MEK1/2抑制剂,进而在体内外抑制下游ERK1/2的活化,虽然它也能阻遏某些其他蛋白激酶,但比抑制MAPK级联激活所需浓度高约1 000倍,这揭示了U0126高度的特异性。目前,U0126在缺血性脑卒中的神经保护作用已得到广泛认可。在神经细胞中,使用U0126能阻断谷氨酸[15]、多巴胺[16]或锌离子[17]等各种物质导致的神经元死亡,有效缩小脑梗死范围,临床数据表明梗死体积与卒中幸存患者的长期功能结局相关[18]。研究显示,它还能减轻缺血后血管内皮细胞上内皮素B型受体表达的增加,缓解脑血管收缩[6];在卒中急性期抑制ERK1/2还可维持血管稳定性及促进血管生成,加强脑血流恢复使脑灌注正常化,这对预防细胞死亡和促进感觉运动功能的恢复大有裨益[19]。并且,U0126的使用在稳定血脑屏障,降低促炎细胞因子活性(TNFα,IL-1β和IL-6等)[7],抑制N-甲基-D-天冬氨酸受体表达等方面也具有良好的效果[8]。
近期研究表明,在实验性卒中的急性期,T细胞及其亚型迅速从外周迁移至缺血核心区,不仅参与引发针对中枢神经系统抗原的自身免疫反应,导致大脑局部炎症,加重脑损伤;而且与脑卒中诱导的免疫抑制相关,导致外周各器官的感染发生率增加[20]。因此,T细胞缺陷通常认为是脑保护性的,在缺乏淋巴细胞的免疫缺陷小鼠中观察到梗死面积显著减小,而T细胞的重新注入恢复了梗死灶。在我们的研究中也显示,与WT小鼠相比,SCID在接受同样的处理后其梗死范围明显较大。但在进一步的实验中,即使给予同样剂量的神经保护剂U0126,SCID小鼠的脑梗死面积不减反增,而使用ConA刺激T细胞增生后,重新观察到U0126对脾脏增殖的促进效应,并且U0126似乎与ConA具有协同效应,这一点与前文中SCID小鼠梗死面积减小相悖。对此,我们猜测这是由T细胞亚型的不同功能所致[20]。T细胞根据CD4和CD8分子表达水平分为CD4+T细胞(辅助性T细胞,helper T cells,Th)和CD8+T细胞(细胞毒性T细胞,cytotoxic T cells,Tc)。Tc细胞主要通过释放细胞毒性介质直接破坏靶细胞,或通过FasL途径诱导细胞凋亡。Th细胞根据其细胞因子分泌情况进一步分为Th1、Th2、Th17和Tfh细胞。Th1和Th2细胞是至今研究最为明确的两种Th细胞亚型。激活状态下,Th1细胞分泌促炎因子干扰素γ(IFNγ)和淋巴毒素LT-a,而Th2细胞产生抗炎因子白细胞介素4(IL-4)、IL-10和IL-13[13, 20]。由此可知T细胞亚群在脑损伤中起着不同的作用:Th1细胞的缺乏导致较小的梗死灶,Th2细胞的缺乏加重梗死[21]。本实验中U0126可能具有选择性促进Th2细胞增殖的特点,Th2细胞的存在也保障了U0126益处的发挥,两者相辅相成,因此U0126能够减轻外周免疫抑制造成的淋巴器官萎缩,而对SCID小鼠而言,在免疫缺陷和缺血缺氧的双重刺激下,脑损伤加剧,U0126的脑保护作用被消除,但这需要进一步的实验来证实。
根据上述结果,在缺血性脑卒中急性期给予U0126能够显著改善脑缺血带来的损伤,这是通过抑制ERK1/2信号通路实现的,同时我们的研究提示其神经保护作用可能与选择性促进T细胞增殖有关。当前治疗缺血性脑卒中可供选择的主要药物是t-PA,却因治疗窗的狭窄(< 4.5 h)及随之带来的出血转化和神经毒性等风险[22],很大比例的患者未能获得理想疗效。U0126作为关键信号通路的高效阻滞剂,在未来可能具有可观的治疗潜力,但它的具体作用机制如何及存在哪些潜在副作用,仍需大量研究探明完善。
| [1] |
Mostajeran M, Wetterling F, Blixt FW, et al. Acute mitogen-activated protein kinase 1/2 inhibition improves functional recovery and vascular changes after ischaemic stroke in rat-monitored by 9.4 T magnetic resonance imaging[J]. Acta Physiol (Oxf), 2018, 223(1): e12985. DOI:10.1111/apha.12985 |
| [2] |
Cramer J V, Benakis C, Liesz A. T cells in the post-ischemic brain:Troopers or paramedics?[J]. J Neuroimmunol, 2019, 326: 33-37. DOI:10.1016/j.jneuroim.2018.11.006 |
| [3] |
Kim EY, Oldham WM. Innate T cells in the intensive care unit[J]. Mol Immunol, 2019, 105: 213-223. DOI:10.1016/j.molimm.2018.09.026 |
| [4] |
Sawe N, Steinberg G, Zhao H. Dual roles of the MAPK/ERK1/2 cell signaling pathway after stroke[J]. J Neurosci Res, 2008, 86(8): 1659-1669. DOI:10.1002/jnr.21604 |
| [5] |
Wang ZQ, Wu DC, Huang FP, et al. Inhibition of MEK/ERK 1/2 pathway reduces pro-inflammatory cytokine interleukin-1 expression in focal cerebral ischemia[J]. Brain Res, 2004, 996(1): 55-66. |
| [6] |
Ahnstedt H, Mostajeran M, Blixt FW, et al. U0126 attenuates cerebral vasoconstriction and improves long-term neurologic outcome after stroke in female rats[J]. J Cereb Blood Flow Metab, 2015, 35(3): 454-460. DOI:10.1038/jcbfm.2014.217 |
| [7] |
Christensen ST, Johansson SE, Radziwon-Balicka A, et al. MEK1/2 inhibitor U0126, but not nimodipine, reduces upregulation of cerebrovascular contractile receptors after subarachnoid haemorrhage in rats[J]. PLoS One, 2019, 14(4): e0215398. DOI:10.1371/journal.pone.0215398 |
| [8] |
Li J, Yan D, Liu X, et al. U0126 protects hippocampal CA1 neurons against forebrain ischemia-induced apoptosis via the ERK1/2 signaling pathway and NMDA receptors[J]. Neurol Res, 2018, 40(4): 318-323. DOI:10.1080/01616412.2018.1441693 |
| [9] |
Mostajeran M, Edvinsson L, Warfvinge K, et al. Inhibition of mitogen-activated protein kinase 1/2 in the acute phase of stroke improves long-term neurological outcome and promotes recovery processes in rats[J]. Acta Physiol (Oxf), 2017, 219(4): 814-824. DOI:10.1111/apha.12632 |
| [10] |
Sun J, Nan G. The Mitogen-Activated Protein Kinase (MAPK) Signaling Pathway as a Discovery Target in Stroke[J]. J Mol Neurosci, 2016, 59(1): 90-98. DOI:10.1007/s12031-016-0717-8 |
| [11] |
Xiong X, Barreto GE, Xu L, et al. Increased brain injury and worsened neurological outcome in interleukin-4 knockout mice after transient focal cerebral ischemia[J]. Stroke, 2011, 42(7): 2026-2032. DOI:10.1161/STROKEAHA.110.593772 |
| [12] |
Ajmo CT, Jr., Vernon DO, Collier L, et al. The spleen contributes to stroke-induced neurodegeneration[J]. J Neurosci Res, 2008, 86(10): 2227-2234. DOI:10.1002/jnr.21661 |
| [13] |
Gu L, Xiong X, Wei D, et al. T cells contribute to stroke-induced lymphopenia in rats[J]. PLoS One, 2013, 8(3): e59602. |
| [14] |
Gu L, Jian Z, Stary C, et al. T Cells and Cerebral Ischemic Stroke[J]. Neurochem Res, 2015, 40(9): 1786-1791. DOI:10.1007/s11064-015-1676-0 |
| [15] |
Gu L, Xiong X, Zhang H, et al. Distinctive effects of T cell subsets in neuronal injury induced by cocultured splenocytes in vitro and by in vivo stroke in mice[J]. Stroke, 2012, 43(7): 1941-1946. DOI:10.1161/STROKEAHA.112.656611 |
 2020, Vol. 47
2020, Vol. 47




