扩展功能
文章信息
- 林烈桔, 麦朗君, 陈光, 赵二侬, 薛明, 苏显都
- LIN Lie-Ju, MAI Lang-Jun, CHEN Guang, ZHAO Er-Nong, XUE Ming, SU Xian-Du
- 血清高迁移率族蛋白B1及胶质纤维酸性蛋白水平预测新生儿缺氧缺血性脑病预后的价值
- Value of the serum levels of high-mobility group box B1 and glial fibrillary acidic protein in predicting the prognosis of neonatal hypoxic-ischemic encephalopathy
- 国际神经病学神经外科学杂志, 2020, 47(1): 62-66
- Journal of International Neurology and Neurosurgery, 2020, 47(1): 62-66
-
文章历史
收稿日期: 2019-08-12
修回日期: 2019-11-17
2. 儋州市人民医院检验科, 海南省儋州市 571799
2. Department of Clinical Laboratory, The People's Hospital of Danzhou, Danzhou, Hainan 571799, China
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)是指新生儿在围产期由于缺血缺氧而导致的脑部损伤性疾病,可导致新生儿神经系统后遗症,引发残疾甚至围产儿死亡[1]。因此,早期判断新生儿脑损伤的病情程度及其预后具有重要的临床意义。近年来研究发现,高迁移率族蛋白B1(high mobility group protein B1, HMGB1)广泛存在于脑组织中,是一种新型的促炎性细胞因子,可作为炎症反应的关键调控分子,通过其受体介导参与炎症反应,在脑损伤的发生发展过程中发挥着重要的作用[2]。胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)是脑组织特异性的分子标志物,在脑损伤患者中明显升高,与神经系统损伤及修复有关,有望作为评估脑损伤病情和预后的指标[3]。本研究通过检测HIE患儿第1天、第3天、第5天血清HMGB1及GFAP水平变化,并分析其与HIE患儿的病情及预后的关系,旨在为判断HIE患儿的预后及救治提供参考依据。
1 对象与方法 1.1 研究对象选取2012年1月至2018年12月儋州市人民医院儿科收治的新生儿缺氧缺血性脑病115例,其中男性69例,女性46例;日龄2~7 d,平均日龄(3.50±0.32) d。
纳入标准:①符合HIE诊断标准[4];②胎龄37~42周,出生体质量2 500~4 000 g,Apgar评分≤7分;③经CT或MRI检查确定脑损伤情况。
排除标准:①先天性心脏病、神经系统发育畸形、脑膜炎、非窒息及产伤史所致头颅血肿、感染性疾病、呼吸系统疾病、巨大儿;②住院时间不足5 d、不能配合本次研究者。
本研究符合伦理学标准,经我院伦理学委员会审核批准,且所有入组新生儿的家属均已签署了知情同意书。
1.2 诊断标准参考新生儿缺氧缺血性脑病诊断标准[4]:①有明确的可导致胎儿宫内窘迫的异常产科病史,以及严重的胎儿宫内窘迫表现;②出生时有重度窒息;③出生后不久出现神经系统症状,并持续至24 h以上;④排除电解质紊乱、颅内出血和产伤等原因引起的抽搐,以及宫内感染、遗传代谢性疾病和其他先天性疾病所引起的脑损伤。同时具备以上4条者可确诊。
1.3 研究方法对出生3 d内的HIE患儿神经症状进行仔细的动态观察,并给予临床分度,其中轻度HIE组38例(兴奋抑制交替、肌张力正常或稍高、可有肌阵挛、瞳孔正常或扩大、原始反射、中枢性呼吸衰竭及脑电图正常);中度HIE组42例(嗜睡、肌张力及原始反射减弱、常有惊厥、有中枢性呼吸衰竭、瞳孔缩小、脑电图表现为低电压);重度HIE组35例(昏迷、肌张力表现为松软或间歇性伸肌张力增高、原始反射消失、伴有惊厥、中枢性呼吸衰竭明显、瞳孔不对称或扩大、对光反射迟钝、脑电图呈现爆发抑制、等电线)。
记录所有HIE患儿出生时的日龄、性别、胎龄、出生体质量、分娩方式、体温及心率等基本资料。轻-中度组和重度组之间基本资料的比较,差异均无统计学意义(P>0.05)。根据治疗后好转情况将115例患儿分为87例存活组(好转出院)和28例死亡组。28例死亡组患儿中,轻-中度组8例,重度组20例。
1.4 观察指标所有HIE患儿均分别于出生确诊当天(第1天)、第3天、第5天采集静脉血3 mL,3 500r/min,离心10 min,离心半径15 cm,检测血清HMGB1及GFAP水平变化。采用酶联免疫吸附法测定血清HMGB1及GFAP水平,试剂盒由美国R&D公司生产。操作过程均严格按照仪器SOP文件及试剂盒说明书进行。
1.5 统计学分析采用SPSS 20.0统计软件分析。计量资料以均数±标准差(x±s)表示,两独立样本均数的比较采用成组t检验,组内比较采用重复测量的方差分析。计数资料以百分率(%)表示,率的比较采用c2检验。应用受试者工作特征(receiver operating characteristic, ROC)曲线分析血清HMGB1及GFAP水平对HIE患儿预后评估的价值,曲线下面积(area under cure, AUC)比较采用Z检验。相关性分析采用Pearson相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 死亡组和存活组一般资料比较死亡组和存活组的性别、日龄、胎龄、出生体质量、分娩方式、体温及心率比较,差异无统计学意义(P>0.05)。见表 1。
| 项目 | 存活组(n=87) | 死亡组(n=28) | c2/t值 | P值 |
| 男性/女性(例) | 51/36 | 18/10 | 0.283 | 0.595 |
| 日龄(d) | 3.60±0.35 | 3.45±0.30 | 0.619 | 0.628 |
| 胎龄(周) | 39.20±1.20 | 38.90±1.05 | 1.207 | 0.246 |
| 出生体质量(kg) | 3.06±0.53 | 2.97±0.45 | 1.116 | 0.302 |
| 顺产/剖宫产(例) | 57/30 | 16/12 | 0.641 | 0.423 |
| 体温(℃) | 36.90±1.10 | 37.20±1.25 | 0.962 | 0.385 |
| 心率(次/min) | 135.40±19.20 | 136.80±19.50 | 0.913 | 0.407 |
死亡组第1天、第3天、第5天血清HMGB1及GFAP水平均明显高于存活组,差异均有统计学意义(P < 0.05);且死亡组血清HMGB1及GFAP水平随时间变化呈升高趋势,各时间点比较,差异均有统计学意义(P < 0.05)。见表 2。
| 组别 | 例数(n) | HMGB1(μg/L) | GFAP(ng/L) | |||||
| 第1天 | 第3天 | 第5天 | 第1天 | 第3天 | 第5天 | |||
| 存活组 | 87 | 5.80±2.16 | 6.12±2.28 | 4.70±1.82 | 103.60±31.52 | 120.38±34.75 | 115.60±32.42 | |
| 死亡组 | 28 | 9.35±3.24 | 13.60±4.18a | 18.64±6.95ab | 152.80±44.72 | 186.24±53.40a | 227.50±64.38ab | |
| t值 | 4.390 | 7.813 | 12.637 | 9.620 | 12.793 | 16.835 | ||
| P值 | 0.016 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | ||
| 注:a为与同组第1天比较,P < 0.05;b为与同组第3天比较,P < 0.05 | ||||||||
重度组第1天、第3天、第5天血清HMGB1及GFAP水平均明显高于轻度组,差异均有统计学意义(P < 0.05);且重度组血清HMGB1及GFAP水平随时间变化,呈升高趋势,各时间点比较,差异均有统计学意义(P < 0.05)。见表 3。
| 组别 | 例数(n) | HMGB1(μg/L) | GFAP(ng/L) | |||||
| 第1天 | 第3天 | 第5天 | 第1天 | 第3天 | 第5天 | |||
| 轻-中度组 | 80 | 6.38±2.37 | 6.63±2.40 | 5.82±2.14 | 112.73±33.60 | 131.46±36.72 | 124.73±34.58 | |
| 重度组 | 35 | 9.14±3.15 | 12.75±3.84a | 16.90±6.42ab | 145.20±40.83 | 172.80±48.63a | 213.80±62.42ab | |
| t值 | 3.984 | 6.792 | 10.718 | 5.216 | 7.824 | 14.217 | ||
| P值 | 0.032 | < 0.001 | < 0.001 | 0.005 | < 0.001 | < 0.001 | ||
| 注:a为与同组第1天比较,P < 0.05;b为与同组第3天比较,P < 0.05 | ||||||||
在单项指标中,第3天GFAP最佳截值取158.40 ng/L时,其预测HIE患儿死亡的敏感度和特异度较好,分别为85.2%和81.6%。第3天HMGB1联合GFAP水平预测HIE患儿死亡的AUC(95%CI)为0.926(0.862~0.974)明显高于第3天HMGB1[0.824(0.765~0.882)]及第3天GFAP[0.854(0.782~0.905)],差异有统计学意义(Z=5.116, 4.384; P < 0.05),其敏感度和特异度为93.0%和87.3%。见表 4。
| 项目 | 最佳截值 | AUC(95%CI) | 敏感度(%) | 特异度(%) | 阳性预测值(%) | 阴性预测值(%) |
| 第1天HMGB1 | 7.24 μg/L | 0.718(0.662~0.776) | 70.2 | 66.0 | 68.4 | 67.5 |
| 第3天HMGB1 | 10.15 μg/L | 0.824(0.765~0.882) | 81.3 | 78.2 | 82.0 | 77.6 |
| 第5天HMGB1 | 14.20 μg/L | 0.780(0.722~0.828) | 77.0 | 71.6 | 73.8 | 75.0 |
| 第1天GFAP | 130.25 ng/L | 0.743(0.675~0.796) | 71.4 | 73.0 | 75.8 | 68.4 |
| 第3天GFAP | 158.40 ng/L | 0.854(0.782~0.905) | 85.2 | 81.6 | 84.3 | 83.7 |
| 第5天GFAP | 183.72 ng/L | 0.795(0.738~0.850) | 79.4 | 75.3 | 78.2 | 76.5 |
| 第1天两项联合 | - | 0.801(0.745~0.862) | 82.0 | 74.2 | 77.3 | 79.6 |
| 第3天两项联合 | - | 0.926(0.862~0.974) | 93.0 | 87.3 | 90.6 | 90.2 |
| 第5天两项联合 | - | 0.837(0.768~0.886) | 84.2 | 77.4 | 80.5 | 81.7 |
Pearson相关分析显示,死亡组血清HMGB1与GFAP水平呈正相关(r=0.806, P < 0.01),存活组血清HMGB1与GFAP水平无明显相关性(r=0.172, P>0.05)。见图 1。
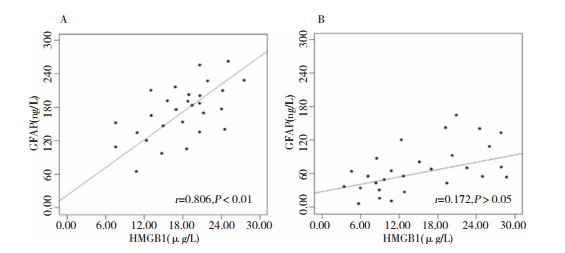
|
| 注:A:死亡组;B:存活组 图 1 血清HMGB1与GFAP水平的相关性 |
HIE是新生儿常见的脑部损伤性疾病,具有较高的发病率及死亡率。HMGB1为真核细胞核内的一种高度保守的非组蛋白,广泛表达于胶质细胞、内皮细胞,具有调节基因转录、稳固胞核结构及介导炎症反应等生物学功能。Parker等[5]研究表明,HMGB1与多种细胞因子、血管黏附分子、促炎细胞趋化因子等相互作用,参与创伤、神经损伤等疾病的发生发展,并与缺血-再灌注损伤密切相关。孙恺等[6]研究发现,在新生儿脑损伤中,血清HMGB1的浓度高于正常新生儿,认为HMGB1在新生儿缺血-再灌注损伤中有着显著的意义。GFAP是星形胶质细胞独有的细胞骨架蛋白,以可溶性蛋白和中间丝蛋白两种形式存在于神经胶质细胞的胞质中,脑损伤后GFAP在反应性星形细胞中的表达均增强,对胶质细胞损伤有着高度的敏感性和特异性。McKenney等[7]研究发现,在正常情况下,血中GFAP水平较稳定;脑损伤后因星形胶质细胞增生而表达增加,进入周围细胞间隙,通过血脑屏障进入血液中,使血中GFAP水平上调。另有研究表明,早产儿血中GFAP水平升高程度与HIE的发生、病程密切相关,可有效反映早产儿脑损伤的程度,亦可早期评估其神经系统预后[8]。
本研究结果显示,死亡组第1天、第3天、第5天血清HMGB1及GFAP水平均明显高于存活组,且死亡组血清HMGB1及GFAP水平随时间推移呈持续升高的状态;重度组第1天、第3天、第5天血清HMGB1及GFAP水平均明显高于轻-中度组,且重度组血清HMGB1及GFAP水平随时间推移呈持续升高的状态。说明血清HMGB1及GFAP水平变化可在一定程度上反映HIE患儿病情的严重程度,死亡HIE患儿病情无法得到有效地控制,血清HMGB1及GFAP水平升高,而且第3天显著升高。杨艳辉等[9]研究显示,血清HMGB1水平在新生儿脑损伤中显著升高,且随着患儿病情加重其水平显著升高,可作为新生儿脑损伤早期诊断的可靠指标。黄玮玲等[10]研究表明,早产儿血清GFAP水平可作为早期评估脑损伤的敏感标志物,其水平变化随着脑损伤程度加重而明显升高,有助于判断早产儿脑损伤严重程度。
本研究应用ROC曲线分析显示,不同时间点血清HMGB1及GFAP水平预测HIE患儿预后的AUC不同,在单项指标中,第3天GFAP水平预测HIE患儿死亡的敏感度和特异度较好,且第3天血清HMGB1联合GFAP水平预测HIE患儿死亡的曲线下面积最大,其敏感度和特异度最高。相关性分析也显示,死亡组血清HMGB1与GFAP水平显著相关。这说明单独检测血清HMGB1或GFAP水平预测HIE患儿预后具有一定的局限性,第3天血清HMGB1联合GFAP水平检测能有助于提高HIE患儿预后评估的准确性。刘巍等[11]研究显示,检测新生儿窒息生后静脉血中HMGBl相关变化,有助于早期诊断窒息新生儿脑损伤。刘春丽等[12]研究发现,HIE患儿血清GFAP含量增加除了与疾病严重程度相关,还与预后相关,检测HIE新生儿血清GFAP变化,有助于判定疾病严重程度及评估患儿的预后。另有研究表明,新生儿血浆GFAP水平与新生儿神经行为评分和脑损伤均相关,能够反映新生儿脑损伤程度,且检测简便,可能作为新生儿脑损伤评估的参考指标[13]。
综上所述,血清HMGB1及GFAP水平变化与HIE患儿的病情严重程度及预后相关,动态监测血清HMGB1及GFAP水平变化有助于指导临床医生治疗,对降低HIE患儿的病死率具有重要意义。单独使用血清HMGB1或GFAP水平预测HIE患儿预后的价值有限,第3天HMGB1联合GFAP检测为HIE患儿预后预测提供了较高的参考价值。
| [1] |
Yıldız EP, Ekici B, Tatlı B. Neonatal hypoxic ischemic encephalopathy:an update on disease pathogenesis and treatment[J]. Expert Rev Neurother, 2017, 17(5): 449-459. DOI:10.1080/14737175.2017.1259567 |
| [2] |
Xu M, Zhou GM, Wang LH, et al. Inhibiting High-Mobility Group Box 1(HMGB1) Attenuates Inflammatory Cytokine Expression and Neurological Deficit in Ischemic Brain Injury Following Cardiac Arrest in Rats[J]. Inflammation, 2016, 39(4): 1594-1602. DOI:10.1007/s10753-016-0395-2 |
| [3] |
Çatlı G, Anık A, Acar S, et al. Brain injury markers:S100 calcium-binding protein B, neuron-specific enolase and glial fibrillary acidic protein in children with diabetic ketoacidosis[J]. Pediatr Diabetes, 2018, 19(5): 1000-1006. DOI:10.1111/pedi.12667 |
| [4] |
中华医学会儿科学分会新生儿学组. 新生儿缺氧缺血性脑病诊断标准[J]. 中华儿科杂志, 2005, 43(8): 584. DOI:10.3760/j.issn:0578-1310.2005.08.007 |
| [5] |
Parker TM, Nguyen AH, Rabang JR, et al. The danger zone:Systematic review of the role of HMGB1 danger signalling in traumatic brain injury[J]. Brain Inj, 2017, 31(1): 2-8. DOI:10.1080/02699052.2016.1217045 |
| [6] |
孙恺, 王翀. 高迁移率族蛋白B1与脑损伤研究进展[J]. 中华神经创伤外科电子杂志, 2015(3): 45-49. |
| [7] |
McKenney SL, Mansouri FF, Everett AD, et al. Glial fibrillary acidic protein as a biomarker for brain injury in neonatal CHD[J]. Cardiol Young, 2016, 26(7): 1282-1289. DOI:10.1017/S1047951115002346 |
| [8] |
裘艳梅, 侯洪涛, 王炜, 等. 动脉血气分析、神经烯醇化酶及血清神经胶质纤维酸性蛋白在早产儿脑损伤早期诊断中的价值[J]. 实用医学杂志, 2016, 32(17): 2847-2850. DOI:10.3969/j.issn.1006-5725.2016.17.019 |
| [9] |
杨艳辉, 崔凯. 血清HMGB1、IGF-1、NSE在新生儿低血糖脑损伤中的变化及应用价值[J]. 中国妇幼保健, 2018, 33(22): 5171-5174. |
| [10] |
黄玮玲, 卢红艳, 朱海涛, 等. 早产儿血清泛素羧基末端水解酶L1、神经胶质原纤维酸性蛋白与脑损伤的关系[J]. 临床儿科杂志, 2018, 36(1): 44-47. DOI:10.3969/j.issn.1000-3606.2018.01.010 |
| [11] |
刘巍, 王智新, 李茜娴. 高迁移率族蛋白1和星形胶质原性蛋白与新生儿窒息后脑损伤关系的研究[J]. 重庆医学, 2018, 47(1): 107-109. DOI:10.3969/j.issn.1671-8348.2018.01.037 |
| [12] |
刘春丽, 梅花, 张亚昱, 等. 胶质原纤维酸性蛋白与新生儿脑损伤[J]. 四川医学, 2018, 39(9): 1083-1086. |
| [13] |
刘其爱, 朱文娟, 莫炜明, 等. 联合检测GFAP、NSE、hs-CRP对新生儿脑损伤的临床应用评价[J]. 广东医学, 2018, 39(11): 1650-1653. DOI:10.3969/j.issn.1001-9448.2018.11.012 |
 2020, Vol. 47
2020, Vol. 47




