扩展功能
文章信息
- 陈祖芝, 梅文丽, 尹昌林, 张彦, 张永辉, 陈俞余
- CHEN Zu-Zhi, MEI Wen-Li, YIN Chang-Lin, ZHANG Yan, ZHANG Yong-Hui, CHEN Yu-Yu
- 一腓骨肌萎缩症家系临床及基因分析
- Clinical and genetic analyses of a family of Charcot-Marie-Tooth disease
- 国际神经病学神经外科学杂志, 2020, 47(1): 58-61
- Journal of International Neurology and Neurosurgery, 2020, 47(1): 58-61
-
文章历史
收稿日期: 2019-08-30
修回日期: 2019-12-03
2. 郑州大学人民医院神经电生理科, 河南省郑州市 450003
2. Department of Electrophysiology Method, People's Hospital of Zhengzhou University, Zhengzhou 450003, China
腓骨肌萎缩症(Charcot-Marie-Tooth, CMT)是具有高度的临床和遗传异质性的周围神经病变之一,最早于1886年首先报道,发病率1/2500[1]。而其中CMT1A型是由于PMP22重复突变导致过度编码蛋白,从临床表现方面,主要表现为进行性肢体远端无力、双下肢肌肉萎缩、手脚畸形、远端肢体感觉障碍。从遗传学方面,CMT常见遗传方式为常染色体显性遗传,少数是常染色体隐性遗传、X-性连锁显性遗传以及X-性连锁隐性遗传[2]。既往研究中报道超过70个基因与CMT疾病相关[3]。本研究为在我院收集一家系患者相关资料,并用PCR-双酶切方法(Polymerase Chain Reaction-double enzyme digestion)及多重连接依赖的探针扩增技术(multiples ligation dependent probe amplificantion, MLPA)检测等不同的基因检测方法确诊为CMT1A家系。
1 研究对象及方法 1.1 研究对象该家系共4代共5例发病者,均来自郑州,并同时收集60例性别、年龄与该家系无明显差异的健康人作为对照。所有研究对象的纳入标准参考Dyck1993[4]。其家系图见图 1。

|
| 图 1 家系图 |
收集该家系8名成员(因客观因素只收集到该家系的8名成员,其中包括5例发病者)和60名对照组成员的外周血液标本各5 mL。
1.3 PCR-双酶切法引物由生工生物工程股份有限公司合成。引物设计原理见[Kon-Ping Lin2006][5]。引物名称分别是F1、R1、F2、R2;序列分别为5′-TTGGATTCAAAGATATTAGTGTTAT-3′;5′-TAGTAGAGCTCACTCTACAG-3′;5′-TTGGATTCACAGAGACATTAGTTAC-3′;5′-TAGTAGAGTGAGTACAGTGGAC-3。
取血液标本5 ml,运用血液基因组DNA提取试剂盒提取DNA。50 μL PCR反应体系中分别加入DNA 5 μL,dNTPs 5 μL,2XGC BufferI 25 μL,TaqDNA多聚酶0.5 μL,F1和R2各2.5 μL,加灭菌水至50 μL。循环参数:94℃变性30 s,57℃退火60 s,30个循环后72℃延伸5 min。取PCR产物10 μL,分别加buffer3.1 2.5 μL,EcoR I 0.5 μL,Nsi I 1 μL,灭菌水6 μL,37 ℃水浴酶切过夜,80℃失活3 min。1.5%琼脂糖凝胶电泳,同时参照2 000 bp Marker相对分子质量标准,1 760 bp条带为特异性酶切片段,有此片段可诊断为PMP22基因重复。
1.4 多重连接依赖探针扩增法 1.4.1 变性、杂交 1.4.2 连接上下游杂交探针彼此相邻,由热稳定的连接酶连接。
1.4.3 PCR所有连接产物均由同一对引物进行PCR扩增。
1.4.4 毛细管电泳分析扩增产物通过与对照DNA标本比较相同片段长度峰高的不同来确定目标序列的对拷贝数变化。
2 结果 2.1 临床资料患者Ⅱ9(先证者)现52岁,自幼有弓形足,平素易疲劳,30岁时逐渐出现行走不稳,呈跨阈步态;双下肢自觉无力,表现为上楼梯需扶扶手。患者Ⅱ3现62岁,自幼有弓形足,40岁出现行走不稳,逐渐加重,现已无法行走。
患者Ⅱ11和Ⅲ7自幼体育较差,且有弓形足,上下楼梯时呈跨阈步态。患者Ⅰ1自幼有弓形足,现已故,死因不详。
体格检查:所有患者均有弓形足,双下肢腱反射消失或减弱,双上肢腱反射对称存在,均无感觉障碍、无肌肉萎缩、无自主神经功能障碍。
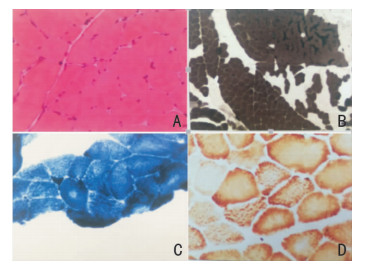
2.2 肌肉病理活检结果该家系中先证者的腓肠肌病理活检结果提示神经源性肌病(图 2)。而该家系中其余成员因经济原因未同意进行此检查。
|
| 注:A:HE×200,腓肠肌肉活检组织2块,部分肌纤维肥大,散在小角化肌纤维;B:ATP4.35×40,Ⅰ型肌纤维多于Ⅱ型肌纤维,小角化纤维以Ⅱ型为主,同型肌纤维群组化分布可见;C:NADH×200,小角化肌纤维浓染,个别肌纤维可见中央轴空;未见靶纤维或靶样纤维;D:COX,部分肌纤维胞浆染色不均匀,呈颗粒状 图 2 先证者的腓肠肌病理活检图 |
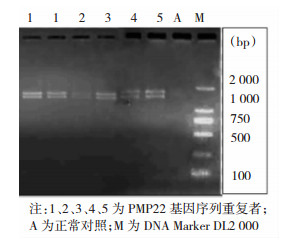
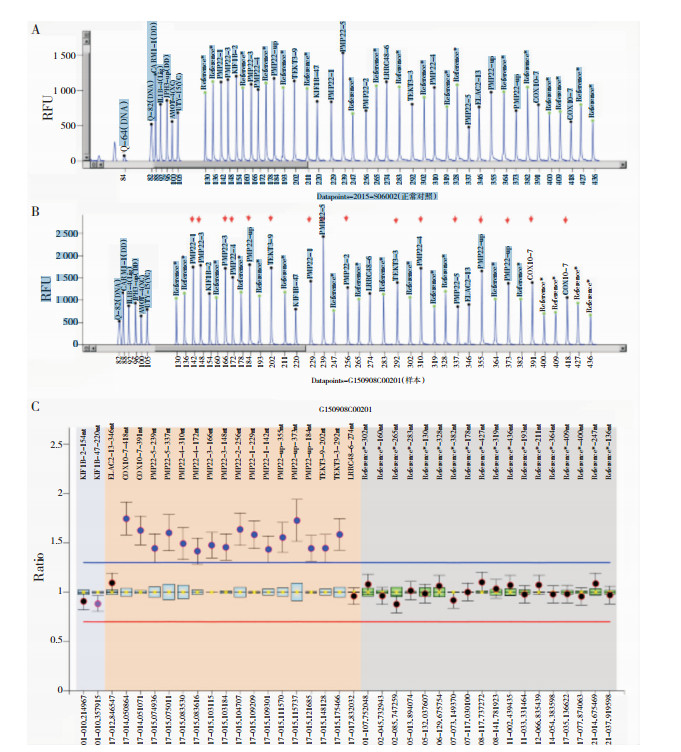
该家系8名成员运用PCR-双酶切法检测出5名成员有PMP22基因的重复突变(即1 760 bp片段)(图 3),其中出现临床症状的有4名成员(Ⅱ3、Ⅱ9、Ⅱ11、Ⅲ7),其基因携带者有1名(Ⅲ5)。该家系8名成员运用MLPA方法筛查出5名成员(Ⅱ3、Ⅱ9、Ⅱ11、Ⅲ5、Ⅲ7)PMP22基因区域发生基因拷贝数增加,存在重复突变序列(图 4)。运用PCR-双酶切方法及MLPA方法检测该家系基因突变结果是一致的。
|
| 图 3 PCR-双酶切法检测PMP22基因的重复突变 |
|
| 注:A:正常对照者;B:该家系的先证者;C:通常认定荧光信号强度介于0.75-1.25之间为正常。MLPA提示PMP22基因区域检测到基因拷贝数增高,存在重复突变 图 4 MLPA方法筛查PMP22基因的重复突变 |
该家系中4例患者(Ⅱ3、Ⅱ9、Ⅱ11、Ⅲ7)双侧正中神经运动神经传导速度平均19 m/s,均 < 38 m/s,感觉神经传导速度均无波形;双胫后神经、腓总神经运动传导潜伏时延长、速度明显减慢、波幅低,双腓肠神经感觉传导未引出;右胫后神经F波、双下肢H反射未引出;双胫前肌、腓肠肌内头、股直肌肌电图静息期未见异常自发电位,胫前肌MUAP时限宽,主动收缩募集减少,股直肌MUAP时限正常,主动收缩募集正常。1例基因携带者(Ⅲ5)双侧正中神经运动神经传导速度25 m/s、感觉神经传导速度均无波形。60例对照组成员神经传导和肌电图均未见明显异常。
3 讨论CMT是一组常见的具有临床和遗传异质性的周围神经遗传病,大多数在儿童期或青春期发病,少数发病在成年后[6]。该家系中所有患病者均在儿童期开始发病,表现为出现弓形足畸形,这符合既往文献报道内容。CMT病程通常在20~30年,甚至更长周期,且下肢症状较上肢症状出现得早、程度更严重[7]。主要临床表现为进行性、对称性肢体远端无力和肌肉萎缩,而该家系患者主要表现双下肢无力,行走不稳,呈“跨阈步态”,伴弓形足畸形,均未见明显的肌肉萎缩(如未见典型”鹤腿”、“香槟腿”),这与国内外文献报道有一定差异,这可能是CMT相对少见的临床表现型,在临床上应重视,有必要时进行基因筛查,从而明确诊断[8]。该家系患者今后是否出现“鹤腿”或“香槟腿”,还需我们长期随访。
初步根据先证者临床表现、肌肉神经病理检查结果及电生理特点考虑为CMT1型,故运用PCR-双酶切及MLPA方法检测PMP22基因重复突变情况,结果发现先证者PMP22基因存在重复突变。同时对该家系中其余7名成员运用上述两种基因检测法进行该基因筛查,检测出余4名成员存在PMP22基因重复突变序列,其中1名为携带者,余3名成员及60名健康人均未发现异常重复突变序列。上述两种基因检测方法检测基因突变结果是一致,但相比较MLPA方法更具有优势:操作简便、灵敏度高、特异性好、精确度高、重复性强,而传统的PCR-双酶切法实验操作时易受DNA标本浓度、引物浓度、PCR条件及酶切温度等影响,故在临床中条件具备者尽量选择MLPA方法筛查CMT1型的PMP22基因重复突变情况。
| [1] |
Braathen GJ. Genetic epidemiology of Charcot-Marie-Tooth disease[J]. Acta Neurol Scand Suppl, 2012(193): iv-22. |
| [2] |
Shin JS, Chung KW, Cho SY, et al. NEFL Pro22Arg mutation in Charcot-Marie-Tooth disease type 1[J]. J Hum Genet, 2008, 53(10): 936-940. DOI:10.1007/s10038-008-0333-8 |
| [3] |
Rossor AM, Polke JM, Houlden H, et al. Clinical implications of genetic advances in Charcot-Marie-Tooth disease[J]. Nat Rev Neurol, 2013, 9(10): 562-571. DOI:10.1038/nrneurol.2013.179 |
| [4] |
Dyck PJ, Chance P, Lebo R, et al. Here ditary motor and sensory neuropathy[M]. Philadephia: WB Saunders, 1993, 1094-1132.
|
| [5] |
Lin KP, Chou CH, Lee HY, et al. Allele-specific all-or-none PCR product diagnostic strategy for Charcot-Marie-Tooth 1A and hereditary neuropathy with liability to pressure palsies[J]. J Chin Med Assoc, 2006, 69(2): 68-73. DOI:10.1016/S1726-4901(09)70116-9 |
| [6] |
Jani-Acsadi A, Krajewski K, Shy ME. Charcot-Marie-Tooth neuropathies:diagnosis and management[J]. Semin Neurol, 2008, 28(2): 185-194. DOI:10.1055/s-2008-1062264 |
| [7] |
Colomban C, Micallef J, Lefebvre MN, et al. Clinical spectrum and gender differences in a large cohort of Charcot-Marie-Tooth type 1A patients[J]. J Neurol Sci, 2014, 336(1): 155-160. |
| [8] |
Jones EA, Brewer MH, Srinivasan R, et al. Distal enhancers upstream of the Charcot-Marie-Tooth type 1A disease gene PMP22[J]. Hum Mol Genet, 2012, 21(7): 1581-1591. DOI:10.1093/hmg/ddr595 |
 2020, Vol. 47
2020, Vol. 47




