扩展功能
文章信息
- 郭彦杰, 冯娅, 李璇, 赵文娟, 马金旺, 吴云成
- GUO Yan-Jie, FENG Ya, LI Xuan, ZHAO Wen-Juan, MA Jin-Wang, WU Yun-Cheng
- 沉默信息调节因子1/p53信号通路参与MPTP诱导的帕金森病小鼠多巴胺能神经元丢失
- Silent information regulator1/p53 signaling pathway is involved in loss of dopaminergic neurons induced by 1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine in mice with Parkinson's disease
- 国际神经病学神经外科学杂志, 2020, 47(1): 38-43
- Journal of International Neurology and Neurosurgery, 2020, 47(1): 38-43
-
文章历史
收稿日期: 2019-05-20
修回日期: 2019-11-11
2. 上海交通大学附属第一人民医院神经内科, 上海市 200080;
3. 上海交通大学药学院, 上海市 200240
2. Department of Neurology, Shanghai General Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200080, China;
3. School of Pharmacy, Shanghai Jiao Tong University, Shanghai 200240, China
帕金森病(Parkinson’s disease, PD)是一种常见的神经变性疾病,其主要的病理改变是中脑黑质多巴胺能神经元的变性丢失[1]。基因突变、环境毒素的接触、线粒体功能障碍和氧化应激等因素共同参与了PD的发病,但是多巴胺能神经元凋亡的具体机制至今未完全阐明。
p53是一种重要的转录因子,因其在细胞凋亡中的重要作用备受关注。p53蛋白含有多个保守的结构域,能够被多种转录后修饰机制所调控,如磷酸化、泛素化和类泛素化、硝基化、甲基化和乙酰化等,其中p53蛋白的乙酰化修饰是介导其转录激活的重要机制之一[2]。沉默信息调节因子1(silent information regulation 1, SIRT1)是一种NAD+依赖的去乙酰化酶,通过直接靶向去乙酰化组蛋白或其他转录因子如p53而被认为是一种可能的保护因子[3, 4]。本实验在动物活体水平探讨SIRT1与p53在1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶(MPTP)小鼠模型中的变化,为阐明SIRT1/p53信号通路参与PD的发病机制提供实验依据。
1 材料与方法 1.1 实验动物雄性C57BL/6小鼠20只,10~12周龄,体重24~28 g,由上海斯莱克实验动物有限责任公司提供(生产许可证编号:SCXK(沪)2012-0002)。小鼠每笼4~5只,自由进食和饮水,室温20~25℃,相对湿度40%~50%,12 h昼夜节律,饲养于上海交通大学实验动物中心(使用许可证编号:SYXK(沪)2013-0052)。
1.2 实验动物分组与给药雄性C57BL/6小鼠适应1周后,进行行为学训练1周,随机分为对照组和MPTP组,每组各10只。MPTP组小鼠腹腔注射MPTP(30 mg/kg,Sigma,USA),对照组腹腔注射等量生理盐水,连续注射5 d。最后一次给药后第21天处死小鼠,取材,进行后续实验。
1.3 行为学实验在首次给药前1天、及末次给药后第1、7、14、21天分别进行行为学测试。爬杆实验(pole test)的装置[5]是长60 cm,直径约1 cm,上端覆以直径约2.5 cm的球形突起。实验时将小鼠头朝上置于球形突起,记录其自放置于杆顶到头转向下的时间(T-turn)和自放置杆顶至爬至杆底后肢着地的总时间(T-total)。每只小鼠测试3次取平均值,每次测试间隔10 min以上。
1.4 小鼠心脏灌注及取材末次行为学检测结束后,一部分小鼠经心脏灌注取全脑用于组织免疫荧光检测。按40 mg/kg腹腔注射10%水合氯醛进行麻醉,之后心脏灌注操作,断头,小心剥离全脑,置于4%多聚甲醛(paraformaldehyde, PFA)中进行后固定24 h,然后依次浸于20%和30%蔗糖溶液中脱水,至脑组织下沉至瓶底。脑组织经OCT包埋后在冰冻切片机上进行冠状切片,脑片厚度为20 μm。脑片储存于脑片防冻液中,-20℃保存进行免疫荧光及TUNEL检测。另一部分小鼠经颈椎脱臼处死、断头取脑,冰上迅速分离纹状体和黑质,保存于液氮进行高效液相色谱(high performance liquid chromatography, HPLC)及Western blot检测相关蛋白表达。
1.5 高效液相色谱检测神经递质取剥离纹状体称重,按10 μl/mg加入含有10 mM依地酸钠钙(ethylene diamine tetraacetic acid, EDTA)的磷酸盐缓冲液(phosphate buffered saline, PBS)中。冰上避光静置15 min,超声破碎组织。以4℃,15 000 rpm,离心10 min,取上清,记录样品上清量。上清中加入等体积含10 mM EDTA的0.4 M的冷冻HCLO4混匀。冰上避光静置15 min后,以4℃,15 000 rpm,离心15 min,取中间层进行HPLC检测,检测DA及其代谢产物。
1.6 免疫荧光检测黑质区TH阳性神经元及SIRT1表达参照小鼠脑图谱每一个标本取3片相同部位脑片,采用免疫荧光检测黑质区酪氨酸羟化酶(tyrosine hydroxylase, TH)阳性神经元及SIRT1表达。主要流程如下:洗去脑片防冻液→冰冻切片抗原修复液室温修复5 min→洗去抗原修复液→10%山羊血清封闭1 h→一抗孵育:加TH及SIRT1抗体,4℃过夜→洗去多余一抗→二抗孵育(避光):加抗鼠荧光二抗(Alexa Fluor 594)及抗兔荧光二抗(Alexa Fluor 488),室温1 h→洗去多余二抗(避光)→含DAPI的抗荧光淬灭封片液封片→避光晾干→使用奥林巴斯BX51荧光显微镜,在放大10倍、20倍视野下观察拍摄。
1.7 黑质细胞凋亡检测取1.4中制备的各组脑组织切片,根据TUNEL细胞凋亡检测试剂盒操作步骤进行常规脱水、透明和封片。使用奥林巴斯BX51荧光显微镜,在放大10倍、20倍、40倍视野下观察拍摄。
1.8 Western blot检测纹状体区TH、SIRT1、p53、ac-p53、Bcl-2、Bax蛋白的表达取各组小鼠纹状体组织,称重,按照适当比例分别加入包含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液,冰上组织匀浆器破碎30 s,置于冰上摇床裂解30 min,在4℃、16 000 rpm条件下离心30 min,收集上清液。BCA法测定蛋白浓度。各标本取40 μg,上样,使用SDS-PAGE凝胶电泳分离蛋白,电泳结束后将蛋白转印到PVDF膜上,完成转膜后使用5% BSA液室温封闭1 h,分别加入不同一抗TH(1 :2 000)、SIRT1(1 :1 000)、p53(1 :1 000)、ac-p53(1 :1 000)、Bcl-2(1 :1 000)、β-actin(1 :2 000)、Bax(1 :1 000),4℃孵育过夜。次日用TBST清洗,再分别加入辣根过氧化物酶标记的抗兔或抗小鼠二抗(1 :5 000)室温孵育1 h,ECL显色照相,结果用Image-J软件分析图像。
1.9 统计学分析采用SPSS 19.0软件进行统计学分析。所有数据均用均数±标准差(x±s)表示。行为学数据的比较使用重复测量数据的方差分析;组间比较用单因素方差分析;组内两两比较采用Dunnett’s T3检测或LSD法。P < 0.05为差异具有统计学意义。
2 结果 2.1 MPTP诱导的帕金森病小鼠表现出行为学异常爬杆试验是常用的评价MPTP模型小鼠运动迟缓的指标。PD患者临床上也常常表现为运动迟缓。我们发现给予MPTP后的各个时间点,MPTP组的转向时间(T-turn)(P < 0. 01)及爬杆总时间(T-total)(P < 0.001)均较对照组小鼠显著延长。见图 1。
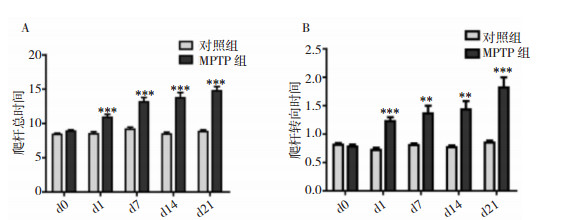
|
| 注:A:爬杆总时间(T-total);B:转向时间(T-turn)。**P < 0.01、***P < 0.001均为与对照组比较(n=10) 图 1 MPTP对小鼠行为学的影响 |
我们使用HPLC检测两组小鼠脑纹状体组织多巴胺(DA)、二羟基苯乙酸(DOPAC)及高香草酸(HVA)的含量。我们发现MPTP组DA(P < 0. 01)、DOPAC(P < 0.001)及HVA(P < 0.01)含量与对照组比较均明显减少。见图 2。
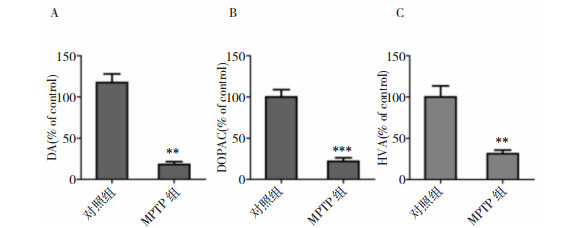
|
| 注:A:DA;B:DOPAC;C:HVA。*P < 0.05、**P < 0.01、***P < 0.001均为与对照组比较(n=4) 图 2 MPTP对小鼠纹状体DA及其代谢产物的影响 |
PD患者主要的病理改变为黑质致密部DA能神经元变性丢失。在本研究中,我们首先利用免疫荧光双标同时染色TH阳性神经元(红色荧光)及SIRT1蛋白(绿色荧光)。我们发现MPTP组小鼠黑质区TH阳性神经元数目减少的同时,SIRT1蛋白表达也明显减少。见图 3。
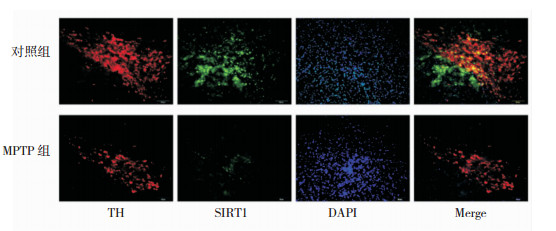
|
| 注:黑质区TH阳性神经元(红色荧光)与SIRT1免疫荧光(绿色荧光)双染典型图片,图中标尺:50 μm 图 3 MPTP对小鼠黑质区TH阳性神经元及SIRT1蛋白表达的影响 |
进一步通过Western blot检测两组小鼠纹状体区TH及SIRT1蛋白表达水平。我们发现,MPTP组小鼠纹状体区TH及SIRT1蛋白表达与对照组比较均明显减少(图 4)。该结果与黑质区免疫荧光双标结果一致。
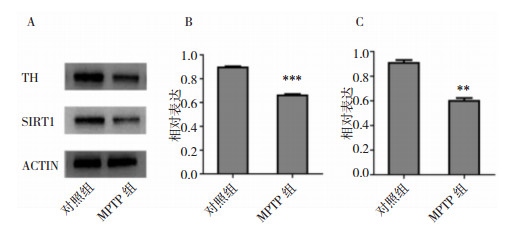
|
| 注:A:纹状体区TH及SIRT1蛋白Western blot图谱;B:纹状体区TH与ACTIN灰度比统计图;C:纹状体区SIRT1与ACTIN灰度比统计图。**P < 0.01、***P < 0.001均为与对照组比较 图 4 MPTP对纹状体区TH及SIRT1蛋白表达的影响 |
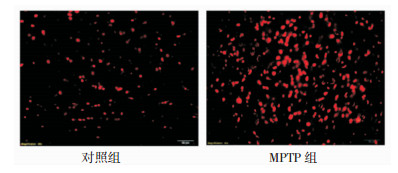
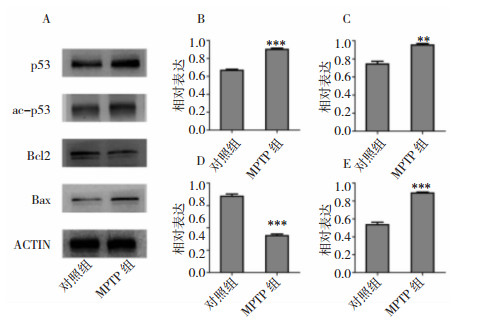
细胞凋亡在PD的发病机制中扮演重要的角色。TUNEL检测结果显示,与对照组相比,MPTP组黑质区凋亡阳性细胞数明显增多(图 5)。细胞凋亡的途径通常包括外部信号途径和内部细胞凋亡途径,其中线粒体介导的细胞内部凋亡通路主要是由DNA损伤后激活的p53蛋白诱导,而p53蛋白的乙酰化修饰是介导其转录激活的重要机制之一。本实验中,我们发现,MPTP组小鼠纹状体区SIRT1蛋白下降的同时,乙酰化的p53蛋白含量较对照组明显升高,同时p53总蛋白的含量也升高(图 6)。因此我们推测,MPTP能通过抑制SIRT1而引起乙酰化的p53蛋白含量的升高,进而促进黑质多巴胺能细胞凋亡。
|
| 图 5 MPTP对小鼠黑质区细胞凋亡的影响。图中标尺:20 μm |
|
| 注:A:纹状体区p53、ac-p53、Bcl-2、Bax蛋白Western blot图谱;B:纹状体区p53与ACTIN灰度比统计图;C:纹状体区ac-p53与ACTIN灰度比统计图;D:纹状体区Bcl-2与ACTIN灰度比统计图;E:纹状体区Bax与ACTIN灰度比统计图。**P < 0.01、***P < 0.001均为与对照组比较 图 6 MPTP对纹状体区p53、ac-p53及凋亡相关蛋白表达的影响 |
Bcl-2家族在调控细胞凋亡中具有重要作用,其可分为促进凋亡和抑制凋亡蛋白两类。Bcl-2和Bax是该家族中最主要的抑制凋亡和促进凋亡的蛋白质,细胞内此两种蛋白表达的异常与细胞凋亡的发生密切相关[6]。我们发现,MPTP组小鼠Bcl-2蛋白质的水平较对照组明显下降,与之相对应的是,MPTP组Bax蛋白质水平较对照组显著升高(图 6)。
3 讨论PD最主要的病理改变是中脑黑质多巴胺能神经元的变性丢失,且目前的多巴胺替代疗法只能缓解临床症状,未能减少多巴胺能神经元的凋亡,缓解疾病的进展[1, 7, 8]。目前对PD的研究主要是通过神经毒素特异性的损伤中脑黑质多巴胺能神经元,模拟PD的病理改变和临床症状而实现的。MPTP是常用的制备PD动物模型的药物[9]。与既往研究结果一致[10],本研究发现,MPTP小鼠的爬杆总时间及爬杆转向时间均较对照组明显延长,因爬杆实验是常用的评价MPTP模型小鼠运动迟缓的指标,爬杆动作的完成同时需要姿势调整及平衡协调能力的参与,说明本实验中MPTP小鼠行为学上出现运动迟缓及姿势协调障碍。同时,我们利用HPLC对DA及其代谢产物的检测结果及利用免疫荧光对小鼠黑质区TH阳性神经元的检测结果,共同证实本实验中MPTP小鼠能复制出PD的病理及生化改变。总之,本研究利用MPTP亚急性造模方式[11],即MPTP按30 mg/kg连续腹腔注射5天,能够产生稳定的PD病理生化及行为学改变,此种造模方法可应用于临床医学生科研和实践教学。
p53是一种常见的转录因子,通过多种信号通路参与了细胞周期、细胞代谢和自噬、细胞凋亡等过程的调节,尤其在细胞凋亡中的作用备受瞩目。研究发现,鱼藤酮处理PC12细胞后,通过激活p38MAPK诱导p53蛋白向细胞核内的转移进而上调Bax的表达,最终引起线粒体依赖的细胞凋亡[12]。脂多糖处理PC12细胞后,通过激活p53-caspase3途径诱导细胞凋亡[13]。神经元接触6-羟基多巴胺后,仅p53蛋白丝氨酸-15位点发生磷酸化的细胞发生死亡,表明p53信号通路的激活可能是6-羟基多巴胺暴露引起细胞凋亡的始动因素[12]。以上提示,p53蛋白是PD模型多巴胺能神经元死亡的重要中介因子。p53蛋白含有多个保守的结构域,能够被多种转录后修饰机制所调控,如磷酸化、泛素化和类泛素化、硝基化、甲基化和乙酰化等。其中p53蛋白的乙酰化修饰是介导其转录激活的重要机制之一。
SIRT1是一种NAD+依赖的去乙酰化酶,通过直接靶向去乙酰化组蛋白或其他转录因子如p53而被认为是一种可能的保护因子。本实验在动物活体水平探讨SIRT1、p53及相关凋亡蛋白在MPTP小鼠中变化,发现MPTP模型小鼠TH阳性神经元凋亡的同时,SIRT1蛋白表达下调,p53蛋白表达及其乙酰化活性上调,促凋亡蛋白Bax表达上调,抑制凋亡蛋白Bcl-2表达下调,提示SIRT1-p53信号通路参与了PD的发病过程,激活或上调SIRT1可能通过调控p53蛋白乙酰化水平,进而抑制p53介导的细胞凋亡。未来研究靶向激活或上调SIRT1相关药物,可能为PD的治疗提供新的思路。
| [1] |
Kalia LV, Lang AE. Parkinson's disease[J]. Lancet, 2015, 386(9996): 896-912. DOI:10.1016/S0140-6736(14)61393-3 |
| [2] |
Ong ALC, Ramasamy TS. Role of Sirtuin1-p53 regulatory axis in aging, cancer and cellular reprogramming[J]. Ageing Res Rev, 2018, 43: 64-80. DOI:10.1016/j.arr.2018.02.004 |
| [3] |
Feng Y, Liu T, Dong SY, et al. Rotenone affects p53 transcriptional activity and apoptosis via targeting SIRT1 and H3K9 acetylation in SH-SY5Y cells[J]. J Neurochem, 2015, 134(4): 668-676. DOI:10.1111/jnc.13172 |
| [4] |
Shi X, Pi L, Zhou S, et al. Activation of Sirtuin 1 Attenuates High Glucose-Induced Neuronal Apoptosis by Deacetylating p53[J]. Front Endocrinol (Lausanne), 2018, 9: 274. DOI:10.3389/fendo.2018.00274 |
| [5] |
Drucker-Colin R, Garcia-Hernandez F. A new motor test sensitive to aging and dopaminergic function[J]. J Neurosci Methods, 1991, 39(2): 153-161. DOI:10.1016/0165-0270(91)90081-A |
| [6] |
Hwang GH, Jeon YJ, Han HJ, et al. Protective effect of butylated hydroxylanisole against hydrogen peroxide-induced apoptosis in primary cultured mouse hepatocytes[J]. J Vet Sci, 2015, 16(1): 17-23. DOI:10.4142/jvs.2015.16.1.17 |
| [7] |
李璇, 吴云成. 线粒体功能障碍及相关药物在帕金森病中的作用[J]. 国际神经病学神经外科学杂志, 2018, 45(2): 178-181. |
| [8] |
郭彦杰, 董素艳, 赵文娟, 等. 白藜芦醇通过SIRT1/AMPK信号通路减轻MPTP诱导的小鼠多巴胺能神经元丢失[J]. 国际神经病学神经外科学杂志, 2016, 43(2): 97-102. |
| [9] |
Jackson-Lewis V, Przedborski S. Protocol for the MPTP mouse model of Parkinson's disease[J]. Nat Protoc, 2007, 2(1): 141-151. DOI:10.1038/nprot.2006.342 |
| [10] |
Guo YJ, Dong SY, Cui XX, et al. Resveratrol alleviates MPTP-induced motor impairments and pathological changes by autophagic degradation of alpha-synuclein via SIRT1-deacetylated LC3[J]. Mol Nutr Food Res, 2016, 60(10): 2161-2175. DOI:10.1002/mnfr.201600111 |
| [11] |
崔新新, 董素艳, 郭彦杰, 等. MPTP小鼠脑沉默信息调节因子1和缺氧诱导因子-1α的表达及行为学检测[J]. 国际神经病学神经外科学杂志, 2017, 44(1): 28-34. |
| [12] |
Wu F, Wang Z, Gu JH, et al. p38(MAPK)/p53-Mediated Bax induction contributes to neurons degeneration in rotenone-induced cellular and rat models of Parkinson's disease[J]. Neurochem Int, 2013, 63(3): 133-140. DOI:10.1016/j.neuint.2013.05.006 |
| [13] |
Ye J, Liu Z, Wei J, et al. Protective effect of SIRT1 on toxicity of microglial-derived factors induced by LPS to PC12 cells via the p53-caspase-3-dependent apoptotic pathway[J]. Neurosci Lett, 2013, 553: 72-77. DOI:10.1016/j.neulet.2013.08.020 |
 2020, Vol. 47
2020, Vol. 47




