扩展功能
文章信息
- 许韵晨, 傅勤慧, 裴建
- miRNA在阿尔茨海默病发病机制中作用的研究进展
- 国际神经病学神经外科学杂志, 2019, 46(6): 671-675
-
文章历史
收稿日期: 2019-06-18
修回日期: 2019-12-06
阿尔茨海默病(Alzheimer’s disease, AD)的生物标志物在其发病、诊断和治疗的神经病理学机制中起着重要作用,2018年美国阿尔茨海默病指南工作组提出了AD的生物学定义研究框架[1],简称AT(N)诊断框架:“A”:脑脊液(cerebrospinal fluid, CSF)β-淀粉样蛋白(β-amyloid, Aβ);“T”:CSF磷酸化tau蛋白(P-tau);“N”:神经变性或神经元损伤的生物标志物,如CSF总tau、神经丝轻链、神经颗粒等。通过对这些生物标志物生理病理学的研究,目前用于治疗AD的方法包括β和γ分泌酶抑制、tau激酶抑制、Aβ聚集抑制等,这些疗法均能暂时延缓发病或改善症状,尚无法从根源上为疾病提供疗效确切的治疗方法。
探索在认知功能衰退前便可识别神经功能衰退过程的生物标志物对临床早期诊断及治疗有着重要意义。近年来大量研究显示,miRNA在神经元中异常表达,对认知功能有重要影响,其功能受损涉及到AD的病因和发病机制[2],可直接或间接调控Aβ、tau等AD相关的生物标志物。且由于miRNA相对分子质量小,能够通过血脑屏障,在外周血中有稳定的表达[3],可用标准实验室设备隔离检测,便于临床应用。因此,miRNA对AD的发病机制和诊断研究等领域具有广阔的前景。本文依据近年来的研究成果,回顾miRNA在AD中作用的相关文献,探讨miRNA与AD相关的发病机制、临床诊断价值以及未来的应用前景。
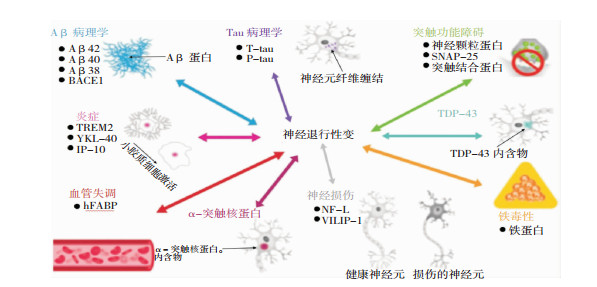
1 AD的发病机制AD作为一种神经退行性疾病,其主要的发病机制是由淀粉样蛋白前体(amyloid precursor protein, APP)经β-分泌酶1(BACE1)裂解,在γ-分泌酶作用下,切割氨基酸位点产生纤维状的Aβ42或Aβ40。Aβ形成的神经炎症斑块和由高磷酸化的tau蛋白构成的神经原纤维缠结在神经元内积聚,破坏神经元之间的通讯和运输,并产生神经毒性,导致了AD神经病理学上的改变。神经炎症也参与了AD病理发展过程,小胶质细胞介导炎症因子和神经毒素的产生与释放参与炎症反应,加速神经细胞死亡。此外,通过调节Aβ和tau途径间接影响AD神经病理学机制的因素还包括血管失调、突触功能障碍、神经损伤等。见图 1。
miRNA是内源性的20~24核苷酸非编码RNA,通过转录降解或翻译抑制转录后沉默来调节大多数基因的表达。失调的miRNA通过对靶蛋白的调控作用影响AD的病程进展,通过近年来前人对miRNA在AD患者靶蛋白的研究,总结出了失调的miRNA及其与AD相关的靶蛋白。见表 1。
| miRNA | 表达水平 | 靶蛋白 | 研究对象 | 调节通路 | 引用的文献 |
| miR-193b | 下调 | APP | 血液/CSF | 增加APP表达 | [6] |
| miR-101 | 大鼠细胞 | 增加APP表达 | [7] | ||
| miR-124 | AD模型果蝇 | 调节APP外显子剪接 | [9] | ||
| miR-29c | 下调 | BACE1 | SH-SY5Y细胞 | 调节BACE1表达 | [12] |
| miR-195 | SAMP8小鼠/ N2a/WT细胞 | 增加BACE1蛋白水平 | [14] | ||
| miR-124 | PC12细胞 | 促进Aβ合成及细胞损伤 | [13] | ||
| mir-219 | 下调 | tau | AD模型果蝇 | 抑制tau合成 | [18] |
| miR-132/212 | AD/FTLD模型小鼠 | 增加tau的表达和磷酸化 | [17] | ||
| miR-34a | 上调 | SH-SY5Y/M17D细胞 | 促进内源性tau的表达 | [16] | |
| mir-128 | 大鼠细胞 | 调节tau的降解和聚集 | [19] | ||
| miR-125b | 原代神经元细胞 | 促进tau的磷酸化 | [22] | ||
| miR-26b | Cdk5 | 大鼠神经元细胞 | 激活tau磷酸化激酶 | [20] | |
| miR-922 | 上调 | UCHL1 | SH-SY5Y和HEK-293T细胞 | 促进tau的磷酸化 | [21] |
| mir-34a | 上调 | TREM2 | 海马CA1 | 导致先天免疫缺陷和炎症变性 | [23] |
| mir-155 | 上调 | T细胞 | 小鼠细胞 | 调节T细胞功能 | [25] |
| mir-181 | 下调 | HMGB1 | 小鼠原代星形胶质细胞 | 导致促炎因子增加和细胞衰老 | [26] |
在AD患者的脑中积累的Aβ,是由BACE1和γ-分泌酶对APP的蛋白水解切割产生的。AD病理学与APP表达增加、APP加工异常、BACE1活性增加和Aβ清除率改变等有关。
2.1.1 miRNA调控APP转录物调节AβAPP经蛋白酶裂解后产生具有毒性作用的Aβ,其表达水平可以在基因组、转录或翻译以及降解率上进行调节[5]。研究显示APP受miRNA的调节,miR-193b在痴呆患者的CSF中表达水平降低,与Aβ42呈负相关。过表达的miR-193b[6]可以通过结合3’非翻译区(3’-UTR)衰减其mRNA和蛋白表达来抑制APP的表达,而其抑制剂寡核苷酸可诱导APP上调。miR-101[7]的抑制增加了海马神经元中APP的水平,而慢病毒介导的miR-101过表达则可以显著降低APP和Aβ。且miR-101还参与APP对促炎细胞因子IL-1β的调节,在神经病理学条件下发挥作用。
APP的异常神经元剪接可导致Aβ增多。miR-124在AD脑中下调[8],通过降低神经细胞系中内源性多嘧啶结合蛋白1的水平,导致APP外显子7和8的异常剪接[9],其结果影响了神经细胞功能的获得和丧失。而重新引入的miR-124通过Notch信号通路在AD果蝇中发挥神经保护作用,改善AD果蝇的爬升能力和学习能力并可延长其寿命,表明miR-124在AD分子病理学中的重要作用[10]。
2.1.2 miRNA调控BACE1AD脑中BACE1的表达水平增高,酶活性增加[11],其对APP的切割是Aβ形成速率的决定步骤。
体内外BACE1活性与miR-29家族的调节密切相关[12]。下调的miR-29c通过在人和小鼠细胞系中靶向其3'-UTR直接上调BACE1的mRNA和蛋白水平,并促进APP的积累。而操作上调miR-29c可显著降低人神经母细胞瘤SH-SY5Y细胞BACE1和APP的蛋白水平[13]。miR-124通过靶向操纵BACE1成为一种AD过程中细胞死亡的调控因子,其表达与神经毒性所致的细胞死亡有关[14],而通过上调miR-124则可降低BACE1和内源性Aβ的产生来防止细胞死亡。miR-195的水平与AD小鼠的BACE1蛋白水平呈负相关,而其在N2a/WT细胞中过表达则可通过抑制BACE1的翻译调节Aβ的产生[15]。
2.2 miRNA调控tau蛋白tau病理学与任何调节其代谢过程的破坏有关,tau过度磷酸化可能是由tau激酶的上调或异常表达,磷酸酶的下调、突变,tau的共价修饰等引起的[16]。
2.2.1 miRNA调控tau mRNA表达和代谢miRNA可以直接调节tau的mRNA和蛋白质水平。miR-34a在AD患者脑组织和血液单核细胞中表达上调,研究发现,在长tau 3'-UTR亚型中具有miR-34a的结合位点,可以控制内源性tau的表达[17],影响tau的积累和聚集。miR-132/212在AD等tau蛋白病中被下调,小鼠miR-132/212的缺乏直接靶向tau mRNA来调节其表达,导致tau表达增加,磷酸化和聚集。而用miR-132模拟物治疗AD小鼠可恢复部分记忆功能和tau代谢功能[18]。
在产生人类tau的果蝇模型中,mir-219的减少可加剧tau的毒性,而过表达的mir-219则可以部分废除毒性效应,证明mir-219可在体内调节tau。后在哺乳动物细胞模型中,mir-219与tau mRNA的3’-UTR结合,并在转录后水平抑制tau合成[19],从而沉默tau表达,干扰神经纤维变性过程。另一种影响tau mRNA水平的机制是破坏降解过程,使tau以泛素丝的形式在神经元中积聚。BAG2/Hsp70复合物与微管相连,能捕获tau并将其传递给蛋白酶体,从而实现泛素降解。上调的mir-128通过调控BAG2作用于tau的降解途径进而导致神经变性[20],由此可见,tau的产生和降解都可能与miRNA的调控有关。
2.2.2 miRNA调控tau磷酸化tau磷酸化受到激酶的调节。Cdk5是一种与tau磷酸化、细胞周期调节和有丝分裂后神经元死亡有关的主要激酶。上调的miR-26b直接作用于视网膜母细胞瘤蛋白,下游信号转导促凋亡转录靶点,导致Cdk5被激活,引起DNA复制和细胞周期异常进入,增加了tau磷酸化,最终导致神经细胞的凋亡和细胞死亡[21]。
在人类细胞系中显示,miR-922可通过下调可溶性泛素羧基末端水解酶L1(ubiquitin carboxy-terminal hydrolase L1, UCHL1)来增加tau磷酸化[22],UCHL1在AD患者的大脑中减少,其水平与神经纤维缠结数成负相关。在原代神经元中,mir-125b的过度表达可导致tau的高磷酸化和Cdk5、p35的信号上调,通过将mir-125b注射到小鼠海马中可损伤其联想学习能力,并导致体内tau磷酸化的增加[23]。
2.3 miRNA调节神经炎症AD病理与大脑中的免疫机制有错综复杂的联系。神经炎症主要通过活化的小胶质细胞和反应星形胶质细胞进行。在病理情况下髓样细胞TREM2产生的细胞类型,可导致小胶质细胞被激活并释放促炎因子。
在散发性AD的海马CA1的样本中,TREM2的表达下调。其作用机制与NF-κB介导的miRNA-34a调节AD患者的TREM2蛋白水平下调有关[24],该表观遗传机制可导致先天免疫缺陷和炎症性神经变性。在AD动物模型中,mir-155的上调导致由Aβ激活的小胶质细胞和星形胶质细胞活化增加[25],从而促进炎症介质的产生,且该途径发生在细胞外Aβ聚集物出现之前,提示如Aβ低聚物等较简单的Aβ物种可能参与早期神经炎症的发生。mir-155还可以通过调节T细胞功能作用于AD免疫相关途径[26]。
炎性细胞因子的脑浓度升高与AD发病机制有关,mir-181含量减少可导致促炎症细胞因子的显著增加,而其过表达则导致星型胶质细胞中的抗炎细胞因子IL-10水平的增加[27],提示mir-181在炎症及神经系统损伤中的作用。此外,mir-181还与细胞衰老密切相关,其表达可通过调控调节蛋白p63和Sirt1的水平,诱导增生的角质形成使细胞过早衰老[28]。
3 小结与展望自2003年以来,几乎没有新的药物被批准用于治疗AD[29],而现有的治疗大都是短期有限的治疗效果。针对AD不同方面的药物目前正在开发和临床试验中,但Aβ体内表达已成为最广泛验证和最具说服力的治疗指标[30]。近期白藜芦醇的药物二期临床研究通过调节miR-155介导的免疫信号通路控制tau蛋白过度磷酸化、神经炎症、BACE1活性和Aβ积聚[31],且耐受性良好,不良反应较轻,显示出较好的临床治疗的前景,为药物调节miRNA在AD发病机制中产生作用提供了一种方法。
用来操控miRNA表达的技术有反义mRNA[32]和RNAi[33]技术,其作为治疗剂具有的主要优点是可以靶向多个基因,可以对整个疾病途径产生影响,尤其是AD这类有众多复杂致病因素的疾病。同样值得注意的是,这种多靶向的特征也带来了脱靶效应的风险,因此,miRNA治疗AD的研究仍处于早期阶段,需要进一步确定AD患者失调的miRNA,并提高特定异常表达的miRNA靶向治疗精准度,使miRNA成为一种新型的AD诊断和治疗策略。
| [1] |
Jack CR, Bennett DA, Blennow K, et al. NIA-AA Research Framework: Toward a biological definition of Alzheimer's disease[J]. Alzheimer Dement, 2018, 14(4): 535-562. DOI:10.1016/j.jalz.2018.02.018 |
| [2] |
Goodall EF, Heath PR, Bandmann O, et al. Neuronal dark matter: The emerging role of microRNAs in neurodegeneration[J]. Front Cell Neurosci, 2013, 7(40): 178. |
| [3] |
Leidinger P, Backes C, Deutscher S, et al. A blood based 12-miRNA signature of Alzheimer disease patients[J]. Gen Biol, 2013, 14(7): 1-16. |
| [4] |
Molinuevo JL, Ayton S, Batrla R, et al. Current state of Alzheimer's fluid biomarkers[J]. Acta Neuropathol, 2018, 136(6): 821-853. DOI:10.1007/s00401-018-1932-x |
| [5] |
Weiner MW. Dementia in 2012: Further insights into Alzheimer disease pathogenesis[J]. Nat Rev Neurol, 2013, 9(2): 65-66. |
| [6] |
Liu CG, Song J, Zhang YQ, et al. MicroRNA-193b is a regulator of amyloid precursor protein in the blood and cerebrospinal fluid derived exosomal microRNA-193b is a biomarker of Alzheimer's disease[J]. Mol Med Rep, 2014, 10(5): 2395-2400. DOI:10.3892/mmr.2014.2484 |
| [7] |
Vilardo E, Barbato C, Ciotti MT, et al. MicroRNA-101 regulates amyloid precursor protein expression in hippocampal neurons[J]. J Biol Chem, 2010, 285(24): 18344-18351. DOI:10.1074/jbc.M110.112664 |
| [8] |
Yuan L, Wan C, Zhang D, et al. The Role of miR-124 in Drosophila Alzheimer's Disease Model by Targeting Delta in Notch Signaling Pathway[J]. Curr Mol Med, 2015, 15(10): 980-989. DOI:10.2174/1566524016666151123114608 |
| [9] |
Smith P, Al Hashimi A, Girard J, et al. In vivo regulation of amyloid precursor protein neuronal splicing by microRNAs[J]. J Neurochem, 2011, 116(2): 240-247. DOI:10.1111/j.1471-4159.2010.07097.x |
| [10] |
Qin X, Wang Y, Paudel HK. Early Growth Response 1 (Egr-1) Is a Transcriptional Activator of β-Secretase 1 (BACE-1) in the Brain[J]. J Biol Chem, 2016, 291(42): 22276-22287. DOI:10.1074/jbc.M116.738849 |
| [11] |
Yang G, Song Y, Zhou X, et al. MicroRNA-29c targets β-site amyloid precursor protein-cleaving enzyme 1 and has a neuroprotective role in vitro and in vivo[J]. Mol Med Rep, 2015, 12(2): 3081-3088. DOI:10.3892/mmr.2015.3728 |
| [12] |
Lei X, Lei L, Zhang Z, et al. Downregulated miR-29c correlates with increased BACE1 expression in sporadic Alzheimer's disease[J]. Int J Clin Exp Pathol, 2015, 8(2): 1565-1574. |
| [13] |
Fang M, Wang J, Zhang X, et al. The miR-124 regulates the expression of BACE1/β-secretase correlated with cell death in Alzheimer's disease[J]. Toxicol Letters, 2012, 209(1): 94-105. DOI:10.1016/j.toxlet.2011.11.032 |
| [14] |
Zhu HC, Wang LM, Wang M, et al. MicroRNA-195 downregulates Alzheimer's disease amyloid-β production by targeting BACE1[J]. Brain Res Bull, 2012, 88(6): 596-601. DOI:10.1016/j.brainresbull.2012.05.018 |
| [15] |
Zeng K, Li M, Hu J, et al. Ginkgo biloba extract EGb761 attenuates Hyperhomocysteinemia-induced AD like tau hyperphosphorylation and cognitive impairment in rats[J]. Curr Alzheimer Res, 2018, 15(1): 89-99. |
| [16] |
Dickson JR, Kruse C, Montagna DR, et al. Alternative polyadenylation and miR-34 family members regulate tau expression[J]. J Neurochemistr, 2013, 127(6): 739-749. DOI:10.1111/jnc.12437 |
| [17] |
Smith PY, Hernandez-Rapp J, Jolivette F, et al. miR-132/212 deficiency impairs tau metabolism and promotes pathological aggregation in vivo[J]. Human Mol Genet, 2015, 24(23): 6721-6735. DOI:10.1093/hmg/ddv377 |
| [18] |
Santa-Maria I, Alaniz M, Renwick N, et al. Dysregulation of microRNA-219 promotes neurodegeneration through post-transcriptional regulation of tau[J]. J Clin Invest, 2015, 125(2): 681-686. DOI:10.1172/JCI78421 |
| [19] |
Carrettiero DC, Hernandez I, Neveu P, et al. The Cochaperone BAG2 Sweeps Paired Helical Filament- Insoluble Tau from the Microtubule[J]. J Neurosci, 2009, 29(7): 2151-2161. DOI:10.1523/JNEUROSCI.4660-08.2009 |
| [20] |
Absalon S, Kochanek DM, Raghavan V, et al. MiR-26b, Upregulated in Alzheimer's Disease, Activates Cell Cycle Entry, Tau-Phosphorylation, and Apoptosis in Postmitotic Neurons[J]. J Neurosci, 2013, 33(37): 14645-14659. DOI:10.1523/JNEUROSCI.1327-13.2013 |
| [21] |
Zhao ZB, Wu L, Xiong R, et al. MicroRNA-922 promotes tau phosphorylation by downregulating ubiquitin carboxy-terminal hydrolase L1 (UCHL1) expression in the pathogenesis of Alzheimer's disease[J]. Neuroscience, 2014, 275: 232-237. DOI:10.1016/j.neuroscience.2014.06.013 |
| [22] |
Banzhaf-Strathmann J, Benito E, May S, et al. MicroRNA-125b induces tau hyperphosphorylation and cognitive deficits in Alzheimer's disease[J]. EMBO J, 2014, 33(15): 1667-1680. DOI:10.15252/embj.201387576 |
| [23] |
Zhao Y, Bhattacharjee S, Jones BM, et al. Regulation of TREM2 expression by an NF-кB-sensitive miRNA-34a[J]. Neuroreport, 2013, 24(6): 318-323. DOI:10.1097/WNR.0b013e32835fb6b0 |
| [24] |
Guedes JR, Custodia CM, Silva RJ, et al. Early miR-155 upregulation contributes to neuroinflammation in Alzheimer's disease triple transgenic mouse model[J]. Human Mol Genet, 2014, 23(23): 6286-6301. DOI:10.1093/hmg/ddu348 |
| [25] |
Song J, Lee JE. miR-155 is involved in Alzheimer's disease by regulating T lymphocyte function[J]. Front Aging N eurosci, 2015, 30(7): 61. |
| [26] |
Hutchison ER, Kawamoto EM, Taub DD, et al. Evidence for miR-181 involvement in neuroinflammatory responses of astrocytes[J]. Glia, 2013, 61(7): 1018-1028. DOI:10.1002/glia.22483 |
| [27] |
Melino G, Saintigny G, Mahé C, et al. p63-microRNA feedback in keratinocyte senescence[J]. Annales de Dermatologie et de Vénéréologie, 2013, 140(12): S623-S624. |
| [28] |
Godyń J, Jończyk J, Panek D, et al. Therapeutic strategies for Alzheimer's disease in clinical trials[J]. Pharmacol Rep, 2016, 68(1): 127-138. |
| [29] |
Selkoe DJ, Hardy J. The amyloid hypothesis of Alzheimer's disease at 25 years[J]. EMBO Molecular Medicine, 2016, 8(6): 595-608. DOI:10.15252/emmm.201606210 |
| [30] |
Kou X, Chen N. Resveratrol as a Natural Autophagy Regulator for Prevention and Treatment of Alzheimer's Disease[J]. Nutrients, 2017, 24(9): 927. |
| [31] |
Christopher AF, Kaur RP, Kaur G, et al. MicroRNA therapeutics: Discovering novel targets and developing specific therapy[J]. Perspect Clin Res, 2016, 7(2): 68-74. DOI:10.4103/2229-3485.179431 |
| [32] |
Li YF, Cheng YF, Huang Y, et al. Phosphodiesterase-4D Knock-Out and RNA Interference-Mediated Knock-Down Enhance Memory and Increase Hippocampal Neurogenesis via Increased cAMP Signaling[J]. J Neurosci, 2011, 31(1): 172-183. DOI:10.1523/JNEUROSCI.5236-10.2011 |
 2019, Vol. 46
2019, Vol. 46