扩展功能
文章信息
- 杨静, 印卫兵
- 雌激素相关的可逆性脑血管收缩综合征1例报道
- 国际神经病学神经外科学杂志, 2019, 46(6): 668-670
-
文章历史
收稿日期: 2019-06-18
修回日期: 2019-09-07
2. 南京医科大学第一附属医院神经内科, 江苏省南京市 210000
可逆性脑血管收缩综合征(reversible cerebral vasoconstriction syndrome, RCVS)是以较长时间可逆性脑动脉收缩为病理基础的疾病,典型的血管改变为颅内血管节段性、多灶性狭窄。并于发病后1~3个月内自行恢复正常[1]。为神经系统少见疾病,目前病因尚不明确,现将1例可能药物滥用相关的RCVS病例报告如下。
1 临床资料患者,女,37岁,“发作性头痛16 d”入院。患者16 d前出现发作性头痛,以右侧颞、枕部为主,疼痛剧烈,每次几分钟至半小时,一天可多次发作。当地行腰穿、头部MR、MRA未见明显异常(图 1A、图 1B);CTA示:RICA-CI段、双侧VA管腔明显狭窄(图 2)。遂行脱水、抗血小板聚集、止痛等治疗12 d,改善不明显。后头痛加重,呈爆炸样,伴恶心、呕吐,头晕、行走不稳,转入我科。
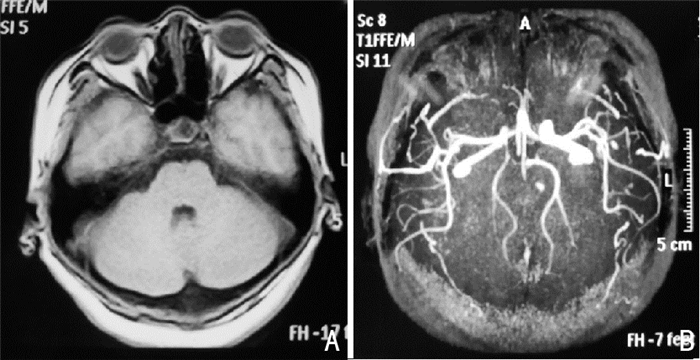
|
| 注:A、B:未见明显异常 图 1 头部MR、MRA所示 |

|
| 图 2 CTA示L-ICA:CI、R-ICA:CI狭窄 |
既往体健,否认类似头痛发作、头部外伤、吸毒史,患者自2017年9月至2019年1月非正规“试管婴儿”2次,期间超剂量应用药物戊酸雌二醇片(后称为A)及黄体酮(后称为B),具体剂量如下:2017年9月“A:口服3 mg每天2次”15 d,“移植”后“A:口服3 mg每天2次+B:口服50 mg每天1次+B:肌肉注射10 mg每天1次”3个月,孕6月流产;2018年6月“A:口服5 mg每天2次”3 d,后“A:口服3 mg每天2次”15 d,“移植”后,“A:口服3 mg每天2次+B:口服50 mg每天1次+B:肌肉注射10 mg每天1次”1月,孕3月流产;2018年11月“A:口服3 mg每天2次”10 d,2019年1月“A:口服3 mg每天2次”10 d,因发病停药。
入院查体:Romberg征阳性,右侧Horner征阳性,颈强直,余未见特殊。辅助检查:入院生化、血常规、抗核抗体、甲功、肿标、血沉、风湿、免疫、抗核抗体、颞动脉超声未见明显异常。患者入院当天头颅CT示:未见明显异常(图 3)。
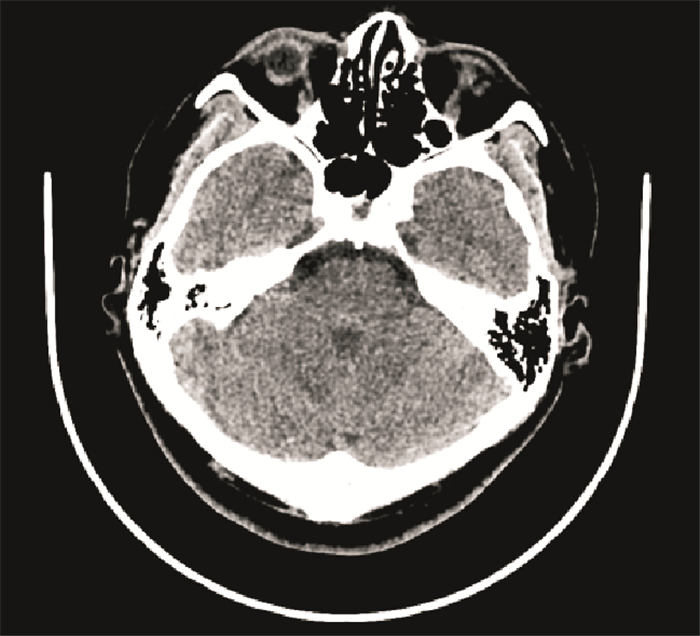
|
| 图 3 入院CT示未见异常 |
入院给予甘露醇、普瑞巴林、加巴喷丁改善症状,仍反复头痛;伴血压波动,最高180/105 mmhg。
入院1 d后,出现神志差,查体示:双眼向右侧凝视;右侧肌力:上肢2级,下肢1级。
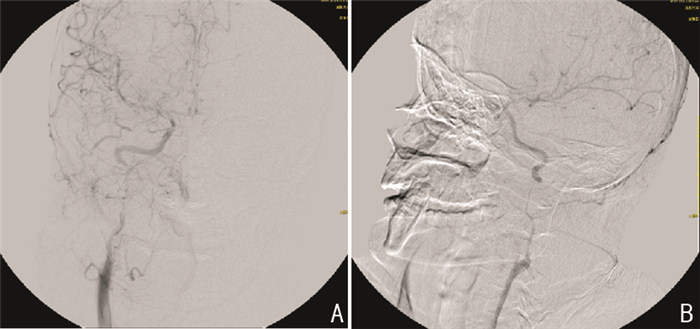
CT+CTA+CTP:右侧小脑半球大面积梗死(图 4a);颅内多处血管狭窄,PCA等呈“串珠样”改变(图 4b);两侧大脑半球灌注异常(图 4c)。DSA:RICA纤细,BA狭窄、LICA近闭塞,R-PICA闭塞(图 5A、图 5B)。TCD:双侧ICA-MCA血流速度明显增快呈节段性改变伴涡流,LACA血流速度增快伴涡流(图 6)。
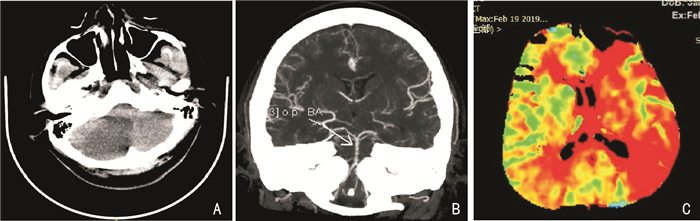
|
| 注:A:右侧小脑半球低密度;B:基底动脉呈“串珠样”改变(箭头所示);C:两侧大脑半球灌注异常 图 4 患者CT、CTA和CTP所示 |
|
| 注:A、B示颅内颅外多支血管狭窄闭塞 图 5 CTA所示 |

|
| 图 6 TCD示R-ICA流速高达225 cm/s |
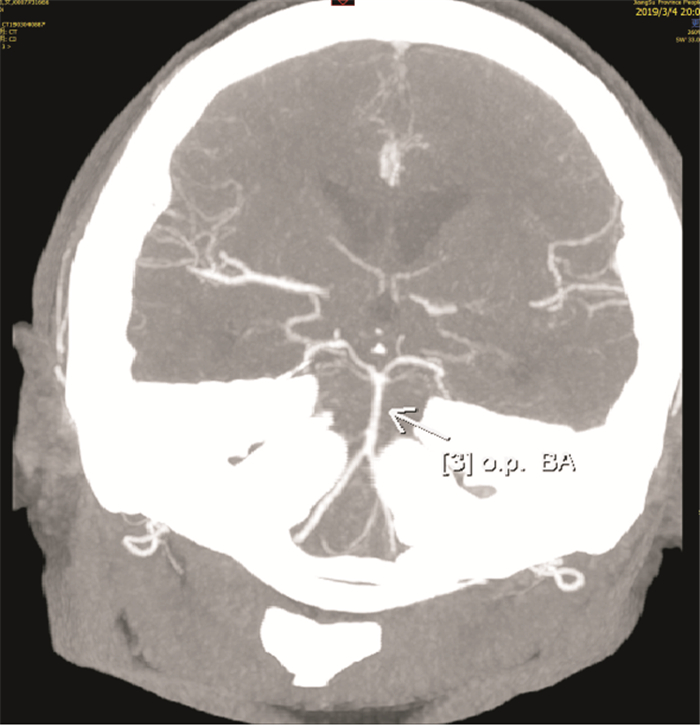
结合患者影像学及临床表现,考虑RCVS可能,加用“尼莫地平”治疗,1周后头痛缓解,肢体活动不灵逐渐恢复。2019年3月4日复查头颅CTA:R-V4段纤细,L-V4段局部闭塞,余颅内血管“串珠样”改变消失(图 7)。2019年3月8日出院,肌力5级,头痛基本消失,出院后继用“尼莫地平30 mg,每天3次,口服”3月。2019年5月28日复查CTA示:颅内血管通畅,L-V4恢复通畅(图 8)。
|
| 图 7 2019年3月4日复查头颅CTA示基底动脉“串珠样”改变消失 |

|
| 注:A、B示颅内外血管未见闭塞狭窄(箭头所示) 图 8 2019年5月28日复查CTA所示 |
RCVS由Call等[2]第1次报道,2007年由Calabrese等[3]提出诊断标准:①影像学检查证实串珠样脑血管收缩;②除外动脉瘤性SAH;③严重、剧烈头痛,伴或不伴神经功能缺损症状或体征;④脑脊液无明显特殊改变;⑤3个月后颅内血管串珠样改变减轻或者完全缓解。本例患者发作性头痛起病,DSA、脑脊液及免疫学检查排除颅内其他疾病,TCD表现符合大动脉痉挛的特点,应用相关药物症状好转,3月后复查颅内外血管管腔通畅,RCVS诊断明确,患者起病初期伴血压增高,考虑与头痛所致交感神经兴奋相关[4]。有研究[5]发现,54%的RCVS患者可出现脑梗死等脑损伤,本患CT显示急性脑梗死。
有研究显示,RCVS易继发于血管活血药物应用及产后1周[6]、嗜铬细胞瘤[7]、脑血管内皮功能障碍[4]后,少数继发于贫血、输血等情况[8],发病机制目前尚不明确。本例患者发病前流产已4月,无已知相关基础病及诱因,但该患者发病前有长期非规范应用雌孕激素史:2017年9月开始患者小剂量规律服用雌激素,随着药量逐渐增加及不规律应用,导致体内雌激素的不稳定波动,进而诱发RCVS[9]。研究表明[10],雌激素与紧张素系统(RAS)关系密切,其有两条途径发挥作用:①RAS两条关键轴ACE-AngII-AT1R与ACE2-Ang(1~7)-MasR的平衡是发挥其生理功能基础,研究示雌激素水平对不同疾病发生发展中RAS表达及AT1R/AT2R的比值有明显调控作用[11]。②雌激素可提高肾上腺髓质儿茶酚胺的合成与释放[12],儿茶酚胺释放过多导致血管调节功能异常,血管痉挛。但目前国内外对雌孕激素与RCVS的相关研究较少,本例患者发病是否与雌孕激素滥用有关仍待进一步研究。
尼莫地平被证实为治疗RCVS有效的一线药物[13]。本例患者应用尼莫地平后症状明显好转。鉴于RCVS可逆性病理生理过程,临床医师对反复发作的头痛患者,应详细询问病史,并进行必要的检查,尽量减少不可逆神经系统损害的发生。
| [1] |
Skeik N, Porten BR, Kadkhodayan Y, et al. Postpartum reversible cerebral vasoconstriction syndrome: review and analysis of the current data[J]. Vasc Med, 2015, 20(3): 256-265. DOI:10.1177/1358863X14567976 |
| [2] |
Call GK, Fleming MC, Sealfon S, et al. Reversible cerebral segmental Vasoconstriction[J]. Stroke, 1988, 19(9): 1159-1170. DOI:10.1161/01.STR.19.9.1159 |
| [3] |
Calabrese LH, Dodick DW, Schwedt TJ, et al. Narrative review: reversible cerebral vasoconstriction syndromes[J]. Ann Intern Med, 2007, 146(1): 34-44. DOI:10.7326/0003-4819-146-1-200701020-00007 |
| [4] |
Shankar Kikkeri N, Nagarajan E, Premkumar K, et al. Reversible Cerebral Vasoconstriction Syndrome Due to Midodrine in a Patient with Autonomic Dysreflexia[J]. Cureus, 2019, 11(3): e4285. |
| [5] |
郭秀海, 林一聪, 魏岗之, 等. 缺铁性贫血合并可逆性脑血管收缩综合征一例[J]. 中国脑血管病杂志, 2013, 10(2): 92-94. DOI:10.3969/j.issn.1672-5921.2013.02.009 |
| [6] |
Ducros A. Reversible cerebral vasoconstriction syndrome[J]. Handb Clin Neurol, 2014, 121: 1725-1741. DOI:10.1016/B978-0-7020-4088-7.00111-5 |
| [7] |
Abruzzo T, Patino M, Leach J, et al. Cerebral vasoconstriction triggered by sympathomimetic drugs during intra-arterial chemotherapy[J]. Pediatr Neurol, 2013, 48(2): 139-142. DOI:10.1016/j.pediatrneurol.2012.10.005 |
| [8] |
王子高, 祖衡兵. 可逆性脑血管收缩综合征[J]. 中国神经精神疾病杂志, 2013, 39(5): 314-317. DOI:10.3969/j.issn.1002-0152.2013.05.015 |
| [9] |
刁晓君, 陈春富. 性激素对偏头痛的影响和机制[J]. 国际神经病学神经外科学杂志, 2015, 42(5): 471-474. |
| [10] |
Tazumi S, Yokota N, Kawakami M, et al. Effects of estrogen replacement on stress-induced cardiovascular responses via renin-angiotensin system in ovariectomized rats[J]. Am J Physiol Regul Integr Comp Physiol, 311(5): R898-R905. DOI:10.1152/ajpregu.00415.2015 |
| [11] |
Lee SH, Lee YH, Jung SW, et al. Sex-related differences in the intratubular renin-angiotensin system (RAS) in 2-kidney 1-clip hypertensive rats[J]. Am J Physiol Renal Physiol, 2019, 317(3): F670-F682. DOI:10.1152/ajprenal.00451.2018 |
| [12] |
Guil MJ, Schöller MI, Cassinotti LR, et al. Role of endothelin receptor type A on catecholamine regulation in the olfactory bulb of DOCA-salt hypertensive rats: Hemodynamic implications[J]. Biochim Biophys Acta Mol Basis Dis, 2019, 1865(11): 165527. DOI:10.1016/j.bbadis.2019.08.003 |
| [13] |
Cho S, Lee MJ, Chung CS. Effect of Nimodipine Treatment on the Clinical Course of Reversible Cerebral Vasoconstriction Syndrome[J]. Front Neurol, 2019, 10: 644. DOI:10.3389/fneur.2019.00644 |
 2019, Vol. 46
2019, Vol. 46




