扩展功能
文章信息
- 洪文明, 杨驰, 程宏伟, 王斌
- HONG Wen-Ming, YANG Chi, CHENG Hong-Wei, WANG Bin
- 神经内镜下经鼻蝶入路切除垂体腺瘤62例临床分析
- Resection of pituitary adenoma through neuroendoscopic endonasal transsphenoidal approach: A clinical analysis of 62 cases
- 国际神经病学神经外科学杂志, 2019, 46(6): 645-649
- Journal of International Neurology and Neurosurgery, 2019, 46(6): 645-649
-
文章历史
收稿日期: 2019-10-20
修回日期: 2019-11-29
显微镜经鼻蝶切除垂体腺瘤是较常用的治疗方式,但对于微腺瘤、复发垂体腺瘤或者侵袭性垂体腺瘤,仍有其治疗的缺陷。近年来随着神经内镜技术的推广应用,神经内镜下经鼻蝶入路切除垂体腺瘤逐渐为众多神经外科医师所采用[1-3]。临床上也有不少学者探讨了内镜在经鼻蝶切除垂体腺瘤中的优缺点,但对于其在微腺瘤、侵袭性垂体腺瘤等肿瘤的临床疗效探讨仍较少,这也是困扰神经外科医师的难点所在[4, 5]。笔者总结分析采用神经内镜下经鼻蝶窦入路切除各类垂体腺瘤62例,探讨其手术疗效,为垂体腺瘤外科治疗提供参考。
1 资料与方法 1.1 一般资料所有患者术前均考虑垂体腺瘤,其中首次诊断为垂体腺瘤52例,复发(或再生长)10例。男性30例,女性32例;年龄27~81岁,平均年龄52.6岁。
1.2 临床表现患者临床表现包括视力、视野障碍52例,其次为头痛18例。另外还包括肢端肥大症状11例,月经紊乱4例,库欣面容3例,泌乳2例。(注:这些症状能组合出现)。
1.3 内分泌及影像学检查根据2017年WHO分类,本组包括零细胞腺瘤40例;生长激素(growth hormone,GH)型腺瘤11例;泌乳素(prolactin,PRL)型腺瘤7例;促肾上腺皮质激素(adrenocorticotrophic hormone,ACTH)腺瘤3例,促甲状腺激素(thyroid stimulating hormone,TSH)腺瘤1例。患者术前均接受头颅薄层CT扫描和鞍区MRI平扫+增强扫描:其中微腺瘤10例,大腺瘤38例,巨大腺瘤14例。
1.4 手术方法及术后管理患者术前口服强的松5 mg/片,一日三次,一次一片;氯霉素眼药水滴鼻。术中患者取仰卧位,插管全麻,头稍后仰,轻度右偏。根据病变复杂程度,可准备导航。主刀医生位于患者右侧,在内镜引导下,将肾上腺素棉片填塞至蝶筛隐窝,收缩鼻腔粘膜5min后用将中、下鼻甲向外侧推开,扩大手术通道。对于微腺瘤,可通过假包膜技术对肿瘤进行剥除,但要操作轻柔,避免在剥离过程中鞍膈蛛网膜破裂造成脑脊液漏。而大腺瘤,可在瘤内减压后,再仔细寻找其外包膜,尽量争取假包膜切除。至于巨大腺瘤,因其常呈侵袭性生长,尤其是往两侧扩展,侵袭海绵窦,包绕颈内动脉,常需借助神经导航或超声探头对颈内动脉等结构确认保护。在保证安全的基础上,可扩大磨除鞍旁骨质,显露海绵窦内肿瘤。如果肿瘤与颈内动脉等粘连紧密,切除困难,不必强行追求全切。对于复发肿瘤,充分清除疤痕组织,利于肿瘤切除。术毕鞍内填入明胶海绵止血,并予人工脑膜等行颅底重建。如脑脊液渗漏严重,可予自体筋膜、脂肪及带蒂粘膜瓣修补。术后24小时复查全套激素、头颅CT,了解激素及颅内情况。
1.5 随访术后建议患者定期门诊随访。检查术前症状改善情况、激素水平、眼科检查及鞍区MRI。
2 结果 2.1 术后近期疗效本组62例垂体腺瘤内镜手术全切50例(80.6%),次全切9例(14.5 %)及大部切除3例(4.9%)。术后患者内分泌治愈率34.6 %(9/26),视力改善率92.3 % (48/52),头痛改善率83.3% (15/18)。
2.2 术后并发症术后短暂性尿崩12例(19.3%,12/62),无永久性尿崩。电解质紊乱5例(8.1%, 5/62),主要表现为钠、氯、钾紊乱,经补液对症处理后均恢复正常。短暂脑脊液鼻漏5例(8.1%,5/62),经保守治疗后痊愈。无永久性脑脊液鼻漏病例及手术干预修补病例。未见颅内感染、昏迷、植物生存等严重并发症及死亡病例。
2.3 术后病理术后病理检查显示零细胞腺瘤40例,GH型垂体腺瘤11例,PRL型垂体腺瘤7例,ACTH型垂体腺瘤3例,TSH型垂体腺瘤1例。
2.4 术后随访结果62例患者均门诊随访,随访时间1~34个月,随访中位时间为17个月。所有患者症状均有不同程度改善。随访期间,复发2例(2/62, 3.2%),复发患者再次入院接受二次手术。后期随访,均未见再复发或再生长病例。
2.5 典型病例病例1,29岁女性,因“闭经两年余”入院,头颅MRI提示垂体微瘤,激素检查发现PRL高,予以溴隐亭口服治疗,但无效。入院术前检查排除手术禁忌后,行内镜经鼻蝶垂体腺瘤切除术。术后病理提示为PRL型垂体腺瘤。术后复查头颅MRI,肿瘤切除满意,且患者PRL激素恢复正常。未出现任何并发症,安全出院。见图 1。
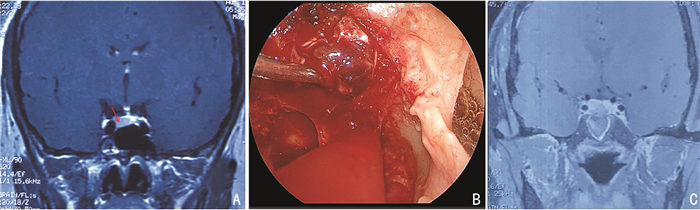
|
| A:患者术前头颅MRI提示垂体微腺瘤(红色箭头标记),肿瘤偏右,正常垂体被推向左侧,垂体柄偏移。B:术中通过假包膜技术,进行包膜外全切肿瘤。C:术后复查头颅MRI,提示肿瘤切除完全,正常垂体保护完好。 图 1 29岁女性患者手术前后头颅MRI |
病例2,32岁男性,因“持续头痛3天伴恶心”入院;专科查体:神志清楚,双瞳孔等大等圆,光敏,双眼视力下降,视野广泛缺损,四肢活动正常,肌力肌张力正常,病理征(-)。头颅MRI检查提示巨大垂体腺瘤。完善检查后行神经导航下内镜经鼻蝶巨大垂体腺瘤切除术,术后复查鞍区MRI提示肿瘤切除满意。见图 2。
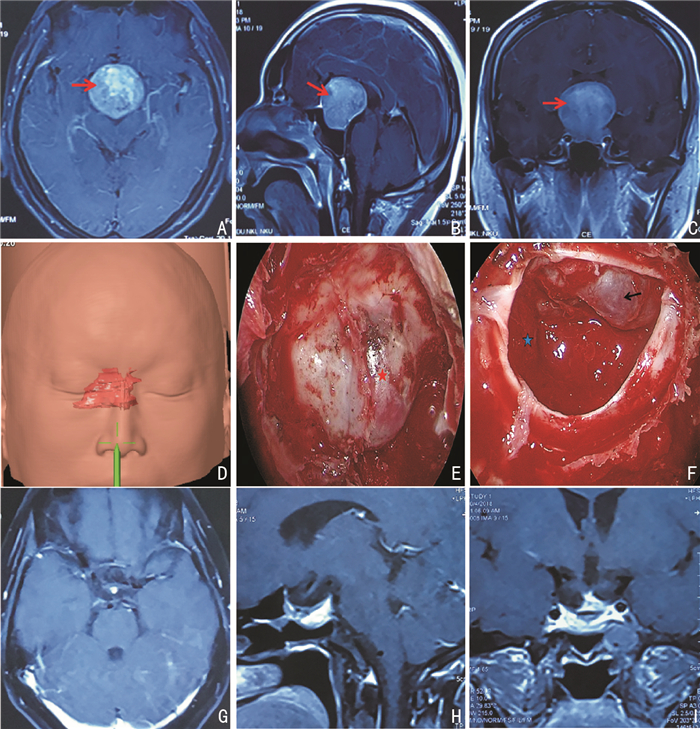
|
| A~C:患者术前鞍区MRI(轴、矢、冠状位片)提示鞍区占位,考虑巨大垂体腺瘤(肿瘤红色标记)。D~E:神经导航,勾画出肿瘤(红色),并于术中导航。E:术中充分显露鞍底(红星标记)。F:内镜下全切肿瘤,鞍隔蛛网膜塌陷(黑色箭头标记),颈内动脉保护完好(蓝星标记)。G~I:术后复查头颅MRI,提示肿瘤切除满意。 图 2 32岁男性患者手术前后资料 |
垂体腺瘤是颅内常见的肿瘤[6],其治疗方法包括手术治疗、药物治疗和放射治疗[5]。药物治疗包括PRL型垂体腺瘤,可首选多巴胺激动剂治疗;GH型垂体腺瘤可选用生长抑素治疗。但对于药物治疗无效的患者,手术仍然是其最主要的治疗方法。显微镜经鼻蝶切除垂体腺瘤受限于其管状视野等缺点,在侵袭性垂体腺瘤、微腺瘤切除中,容易因手术死角导致迷路及肿瘤残留,从而给患者带来肿瘤复发或再生长的危险[7]。因此如何提高垂体腺瘤全切率,同时又降低术后并发症,是临床关注的重点。近年来随着内镜技术的发展,可有效解决视野不足等问题,而成为垂体腺瘤经鼻蝶切除的新方法。本研究通过回顾性总结我院收治的内镜治疗的垂体腺瘤患者临床资料,以期为垂体腺瘤治疗提供一定的经验。
在垂体大腺瘤及巨大垂体腺瘤中,影响肿瘤全切的因素包括肿瘤质地、侵袭性程度等。Knosp 3 ~ 4级垂体腺瘤呈侵袭性生长,长入海绵窦,包绕颈内动脉,常被认为是手术禁区,手术风险巨大[8]。但近年来,不少学者对侵袭海绵窦、包绕颈内动脉的垂体腺瘤探讨总结,发现可通过扩大打开鞍旁骨质,进行海绵窦内肿瘤切除[9]。本组部分Knosp 4级垂体腺瘤,质地稀软,通过弯头吸引器等工具,在内镜抵近观察,有效显露的基础上,切除良好。且为了尽可能全切肿瘤的同时,保证手术安全,可借助神经导航及术中超声等技术确认颈内动脉等重要结构[10]。对本组复发或再生长病例总结,发现影响肿瘤全切的因素包括[11-13]:①术区显露不充分。尤其是显微镜手术,因其管状视野的限制,使得鞍底骨质磨除不够充分,肿瘤显露有限,导致术后肿瘤残留。而此次内镜手术,借助其鱼眼效应[14],清楚显露周边结构,充分磨除骨质,为手术提供良好的操作空间。本组中6例因显露不充分而再次接受手术的患者,此次均在内镜下全切肿瘤,显示了内镜的优势。②肿瘤质地坚韧。部分肿瘤质地较韧,受限于鼻腔有限的操作空间,存在器械“打架”的缺点,使得肿瘤将难以全切[11]。本组病例中,2例此类肿瘤,质地坚韧,难以全切。③肿瘤体积。巨大垂体腺瘤,多呈侵袭性生长,除包绕颈内动脉等重要结构外还常长入三脑室,导致切除困难或切除后出现严重的下丘脑反应,增加患者死亡等风险,而成为制约肿瘤全切的因素之一[15]。
垂体微腺瘤,随着MRI等技术的发展,其诊断率明显提高[16]。对于体检发现的无症状者,若激素无异常,可定期随访。若患者因头痛或激素紊乱就诊,手术是其首选治疗方式。显微镜下微腺瘤常难以寻找,而神经内镜可抵近观察,有效照明,基本都能确切寻找肿瘤。切除过程中,通过可尽量通过假包膜技术[17],行包膜外肿瘤切除。通过本组病例,笔者发现,微腺瘤并不因其肿瘤微小而降低手术难度。相反,其因肿瘤小,间窦多未被压闭,术中易出血,而影响肿瘤切除。另外,部分微腺瘤与鞍膈蛛网膜粘连紧密,剥除过程中容易导致蛛网膜破裂,发生脑脊液漏。这都是限制微腺瘤全切的因素。
垂体微腺瘤患者术前症状除内分泌症状外,也多因肿瘤压迫鞍膈,以头痛症状就诊。而大腺瘤和巨大垂体腺瘤,患者多已视力障碍就诊。而垂体腺瘤伴卒中的患者,多因突发头痛或者突发的视力明显下降就诊[18]。本研究中,术后患者视力及头痛症状改善明显,展现了内镜手术的有效性。对于GH、ACTH等功能性垂体腺瘤手术,除切除肿瘤外,还需追求内分泌学的治愈[19]。这对改善患者症状及生活质量至关重要。笔者研究中发现,GH垂体腺瘤患者术后激素水平基本都会有不同程度的下降,术后患者多主诉手脚涨感好转;而ACTH型垂体腺瘤患者满月脸、水牛背等Cushing症状不会立即改善,但在随访过程中,患者体重明显减轻,脸部痤疮消失。这些都显示了内镜在内分泌学治愈上的明显作用。
相对于显微镜,内镜可有效辨认正常垂体,进而加以保护,从而降低尿崩等并发症。而有效的颅底重建可减少脑脊液漏、颅内感染等术后并发症的同时,还可缩短住院时间,降低住院费用[20, 21]。本组病例术后最常见并发症是一过性尿崩,但通过垂体后叶素等对症处理,均改善,未见永久性尿崩。少数患者出现短暂性脑脊液漏、电解质紊乱,经对症治疗后均恢复正常。未见颅内感染、出血、梗塞等严重并发症。
综上所述,内镜凭借其广视角、双通道四手操作、手术器械灵活等优点,在垂体腺瘤经鼻蝶切除中可获得良好疗效。患者术后并发症低、恢复快,证明它是一种安全、有效的手术方式。
| [1] |
白吉伟, 李储忠, 桂松柏, 等. 内镜与显微镜经鼻腔蝶窦入路切除垂体腺瘤疗效比较的前瞻性研究[J]. 中华神经外科杂志, 2015, 31(4): 325-328. DOI:10.3760/cma.j.issn.1001-2346.2015.04.001 |
| [2] |
赵鹏, 赵亮, 刘晓杨, 等. 经鼻蝶神经内镜和显微镜垂体瘤切除术的疗效对比分析[J]. 国际神经病学神经外科学杂志, 2018, 45(6): 27-30. |
| [3] |
张亚卓, 桂松柏. 内镜神经外科手术技术百年应用与研究进展[J]. 交通医学, 2014, 28(1): 1-4. |
| [4] |
Yang JH, Huang GD, Tao J, et al. Endoscopic endonasal surgery treatment strategies for invasive pituitary adenoma:analysis of four approaches[J]. World Neurosurg, 2018, 115: 5-13. DOI:10.1016/j.wneu.2018.02.162 |
| [5] |
Fraioli MF, Umana G, Pagano A, et al. Prolactin Secreting Pituitary Microadenoma:Results of Transsphenoidal Surgery After Medical Therapy With Dopamine Agonist[J]. J Craniofac Surg, 2017, 28(4): 1. |
| [6] |
Zhan X, Wang X, Cheng T. Human Pituitary Adenoma Proteomics:New Progresses and Perspectives[J]. Front Endocrinol, 2016, 7(6): 1-11. |
| [7] |
毛建辉, 郭洪, 魏建辉, 等. 神经内镜与显微镜经鼻蝶窦入路切除垂体瘤及对激素水平的影响[J]. 中国内镜杂志, 2017, 23(23): 31. |
| [8] |
Mooney MA, Hardesty DA, Sheehy JP, et al. Interrater and intrarater reliability of the Knosp scale for pituitary adenoma grading[J]. J Neurosurg, 2017, 126(5): 1714-1719. DOI:10.3171/2016.3.JNS153044 |
| [9] |
Sanmillán JL, Torresdiaz A, Sanchezfernández JJ, et al. Radiological Predictors for Extent of Resection in Pituitary Adenoma Surgery. A Single-center study[J]. World Neurosurg, 2017, 108: 436-446. DOI:10.1016/j.wneu.2017.09.017 |
| [10] |
位振清, 王任直, 姚勇, 等. 多技术辅助神经内镜下侵袭海绵窦的垂体腺瘤的治疗[J]. 中国医学科学院学报, 2014, 36(2): 189-193. DOI:10.3881/j.issn.1000-503X.2014.02.014 |
| [11] |
Akbari H, Malek M, Ghorbani M, et al. Clinical outcomes of endoscopic versus microscopic trans-sphenoidal surgery for large pituitary adenoma[J]. Br J Neurosurg, 2018, 32(2): 206-209. DOI:10.1080/02688697.2018.1429569 |
| [12] |
谢森, 孟祥辉, 缪国专, 等. 术中磁共振成像在内镜经鼻蝶手术治疗复发性垂体腺瘤中的应用[J]. 中华神经外科杂志, 2019, 35(2): 161-165. DOI:10.3760/cma.j.issn.1001-2346.2019.02.013 |
| [13] |
宋启星, 常佳怡, 刘保国, 等. 垂体瘤性质的影像学研究及手术入路选择[J]. 中国医药科学, 2017(20): 183-185. DOI:10.3969/j.issn.2095-0616.2017.20.056 |
| [14] |
王斌, 徐培坤, 程宏伟, 等. 内镜下经鼻蝶入路切除垂体大腺瘤:附78例报告[J]. 中华显微外科杂志, 2015, 38(4): 319-322. DOI:10.3760/cma.j.issn.1001-2036.2015.04.003 |
| [15] |
Yano S, Hide T, Shinojima N. Efficacy and Complications of Endoscopic Skull Base Surgery for Giant Pituitary Adenomas[J]. World Neurosurg, 2017, 99: 533-542. DOI:10.1016/j.wneu.2016.12.068 |
| [16] |
Wang H, Hou B, Lu L, et al. PET/MR imaging in the diagnosis of hormone-producing pituitary micro-adenoma:a prospective pilot study[J]. J Nucl Med, 2018, 59(3): 523-528. DOI:10.2967/jnumed.117.191916 |
| [17] |
王志刚, 洪涛, 杨玄勇, 等. 神经内镜经双鼻孔入路假包膜外切除垂体腺瘤[J]. 中华神经外科杂志, 2018, 34(6): 554-558. DOI:10.3760/cma.j.issn.1001-2346.2018.06.004 |
| [18] |
Pyrgelis ES, Mavridis I, Meliou M. Presenting Symptoms of Pituitary Apoplexy[J]. J Neurol Surg A Cent Eur Neurosurg, 2017, 79(1): 52-59. |
| [19] |
Nagata Y, Takeuchi K, Yamamoto T, et al. Peel-off resection of the pituitary gland for functional pituitary adenomas:pathological significance and impact on pituitary function[J]. Pituitary, 2019, 22(5): 507-513. DOI:10.1007/s11102-019-00980-w |
| [20] |
Li A, Liu W, Cao P, Zheng Y, et al. Endoscopic Versus Microscopic Transsphenoidal Surgery in the Treatment of Pituitary Adenoma:A Systematic Review and Meta-Analysis[J]. World Neurosurg, 2017, 101: 236-246. DOI:10.1016/j.wneu.2017.01.022 |
| [21] |
白志强, 金涌. 显微镜和内镜辅助下经蝶垂体瘤切除术式的对比研究[J]. 国际神经病学神经外科学杂志, 2012, 39(5): 406-409. |
 2019, Vol. 46
2019, Vol. 46




