扩展功能
文章信息
- 库洪彬, 薛振生, 孟志勇, 张卫民, 张颜礼, 张兰, 刘艳红, 李国锋, 孙鑫晔
- KU Hong-Bin, XUE Zhen-Sheng, MENG Zhi-Yong, ZHANG Wei-Min, ZHANG Yan-Li, ZHANG Lan, LIU Yan-Hong, LI Guo-Feng, SUN Xin-Ye
- CT血管成像和CT灌注点征的联合应用在选择中等量脑出血超早期手术方式中的价值
- Value of the spot sign on computed tomography angiography and computed tomography perfusion in selecting ultra-early surgical procedure for patients with moderate cerebral hemorrhage
- 国际神经病学神经外科学杂志, 2019, 46(6): 632-635
- Journal of International Neurology and Neurosurgery, 2019, 46(6): 632-635
-
文章历史
收稿日期: 2019-09-28
修回日期: 2019-12-20
脑出血是一种致残、致死率极高的卒中类型,其预后与多因素有关[1]。高血压脑出血的出血部位绝大多数位于基底节区,对于血肿量中等,能耐受手术的患者,手术方式主要有两类, 一类是全麻下开颅手术,另一类是局麻下抽吸术。两种术式各有优缺点,目前术式的选择尚无客观标准,且存在争议。本研究通过对照观察,发现通过联合应用颅脑CTA、CTP点征选择超早期手术方式可明显改善中等量基底节脑出血预后。
1 资料与方法 1.1 研究对象选择2016年4月~2019年4月入院的中等量基底节脑出血患者221例。发病后入院时间0.5~5.2 h,出血量30~60 ml,年龄27~79岁。纳入标准:①既往无脑血管病史的自发性脑出血患者,血肿量30~60ml。②出血部位仅局限于基底节区,或虽然破入脑室,但无梗阻性脑积水。③无其他神经系统功能障碍,影响评估疗效者。排除标准:①合并严重多系统疾病,或年龄≥80岁不能耐受手术者。②存在凝血功能障碍,有手术禁忌症者。③经检查证实出血原因为血管畸形、颅内动脉瘤及肿瘤卒中者。
根据患者家属是否同意颅脑CTA、CTP检查分为研究组(同意检查者),和对照组(不同意检查者),研究组根据CTA、CTP检查结果,任意1项点征阳性者行开颅手术,2项点征均为阴性者行引流手术,对照组根据患者方面的知情同意情况,实施开颅或引流手术。两组基线资料详见下表。
| 组别 | 例数 | 年龄(岁) | 发病时间(h) | 出血量(ml) | GCS评分 | |
| 研究组 | 开颅亚组 | 32 | 54.2±5.2 | 2.8±1.4 | 41.9±5.2 | 11.1±1.4 |
| 抽吸亚组 | 73 | 56.3±3.5 | 2.5±1.7 | 40.3±6.1 | 10.7±2.1 | |
| 对照组 | 开颅亚组 | 39 | 54.7±5.6 | 2.6±1.5 | 39. 2±8.7 | 11.5±1.3 |
| 抽吸亚组 | 77 | 54.9±4.4 | 2.4±1.6 | 41. 4±5.5 | 11±1.7 | |
两组抽吸亚组患者,入院后立即给与超早期血肿抽吸术。术后12 h复查颅脑CT,如无血肿增多,通过引流管给予血肿腔注入尿激酶溶液纤溶治疗。如有血肿增多,根据情况暂不给予纤溶治疗,待血肿稳定12 h以上再给予尿激酶纤溶治疗,或改为开颅手术治疗。拔除引流管指征:颅内残余血肿量<15 ml。
两组开颅手术亚组患者,入院后立即给予显微镜下开颅血肿清除术,术中清除血肿同时探查寻找出血血管,电凝止血。
两组患者手术后根据病情需要均给予止血、降压、脱水降颅压、营养支持、预防各系统并发症等一般治疗。
1.3 观察与评价两组患者均于术后第28天行治疗效果评定。根据Rankin分级[2]对患者的生存质量进行评估:日常生活活动能力评分1~4级计为有效,5级为无效。
两组患者均于术后12小时内复查颅脑CT,评估有无术后颅内血肿增大。术后颅内血肿增大评估标准:术后12小时复查CT,颅内血肿量大于原血肿量+6 ml或+33%[3]。
1.4 统计学方法采用SPSS 20.0统计软件,计量资料用x ± s表示,计数资料采用χ2检验, P < 0.05为差异有显著性意义。
2 结果 2.1 两组治疗结果比较| 组别 | 1级 | 2级 | 3级 | 4级 | 5级 | |
| 研究组 | 开颅亚组 | 2 | 10 | 8 | 1 | 10 |
| 抽吸亚组 | 8 | 31 | 15 | 6 | 10 | |
| 对照组 | 开颅亚组 | 3 | 9 | 9 | 1 | 16 |
| 抽吸亚组 | 3 | 18 | 13 | 5 | 21 | |
| 组别 | 治疗有效 | 血肿增大 | 病死 | 颅内感染 | |
| 研究组 | 开颅亚组 | 21(65.6) | 1(3.1) | 1(3.0) | 1(3.0) |
| 抽吸亚组 | 60(82.2) | 3(4.1) | 3(4.1) | 2(2.7) | |
| 共计 | 81(77.1)* | 4(3.8)* | 4(3.8)* | 3(2.9)* | |
| 对照组 | 开颅亚组 | 22(56.4) | 1(2.6) | 1(2.6) | 1(2.6) |
| 抽吸亚组 | 39(50.6) | 20(26) | 17(22.1) | 13(15.6) | |
| 共计 | 61(52.6)* | 21(18.1)* | 18(15.6)* | 14(12.1)* | |
| 注:与对照组比较,*P < 0.05。 | |||||
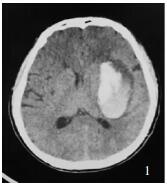
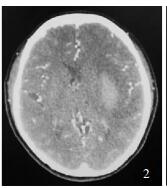
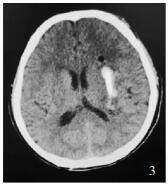
研究组患者男性,65岁,术前左侧基底节血肿约50 ml,CTA原图点征阴性,术后首次CT血肿明显减少(图 1-3)。
|
| 图 1 研究组术前CT |
|
| 图 2 术前CTP原图 |
|
| 图 3 术后首次CT |
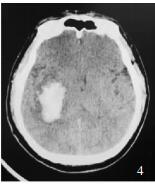
对照组患者男性,61岁,术前右侧基底节血肿约35 ml,术后首次CT血肿增多为42 ml,中线移位(图 4-5))。
|
| 图 4 术前CT |
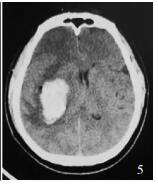
|
| 图 5 术后首次CT |
有学者认为,高血压性脑出血中,早期将有约20%的患者会出现活动性出血,血肿扩大,导致病情恶化,预后不良[4]。目前,国内外学者进行了大量的通过不同方式预测脑出血后再出血的风险并指导治疗方案选择的研究,比较公认的观点是颅脑CTA、CTP点征可作为独立的放射学因素预测再出血。Brouwers等[5]认为颅脑CTA原图上的点征,代表着造影剂的外渗,说明仍存在血管破口及活动性出血。Dowlatshahi、Wang等[6, 7]认为,早期出现的CTA、CTP点征预测活动性出血的准确性较高。文献报导[8],颅内血肿体积>30 ml时,点征的准确性可达85.7%。本研究中,所有的病例发病距CTA、CTP检查时间在6小时以内,颅内血肿量为30~60 ml,因此CTA、CTP点征的准确性比较高。Koculym等[9]通过大样本对比研究发现,由于CTA检查只能发现动脉期点征,稍晚出现的点征会漏诊,CTP可发现不同时刻出现的点征,因而在时间窗方面更具优势。但是由于CTP扫描空间范围有限,而CTA可发现CTP扫描因空间因素漏诊的点征。本研究联合应用CTA、CTP检查的目的在于可在时间及空间因素上相互补充,减少点征的漏诊率,提高诊断的正确性。
目前对于未发生脑疝的中等量脑出血患者手术时机,手术方式的选择及手术安全性争议较大。一般认为脑出血外科治疗根据手术时机选择可分为3种:超早期(6 h内)手术、早期手术(6 h-3 d)及延期(3 d以上)手术[10]。有研究[11]发现:脑出血后6 h血肿周围脑细胞开始出现不可逆性损伤。有学者[12]认为超早期手术能明显改善脑出血患者预后。而另有学者[13]则认为超早期钻孔抽吸手术可能增加脑出血术后血肿扩大的风险。也有学者认为[14]穿刺抽吸术后患者恢复情况明显高于开颅手术患者。本研究中研究组治疗总有效率、术后血肿扩大率、病死率、颅内感染率分别为77.1%、3.8%、3.8%、2.9%, 对照组分别为52.6%、18.1%、15.6%、12.1%,2组差异有统计学意义(P < 0.05),说明通过联合应用CTA、CTP点征预测再出血的风险,选择适当方式超早期手术可以在脑出血后脑细胞不可逆损伤产生之前清除血肿,但不增加术后血肿增加的风险、同时降低死亡率、颅内感染率而改善患者预后。对于凝血功能正常患者的术后再次出血,与手术方式的选择有直接关系。本研究中开颅手术组的患者由于术中对活动出血的血管直接处理,术后血肿扩大率极低。研究组抽吸亚组术后再出血率明显低于对照组抽吸亚组(P < 0.05),而且死亡率、颅内感染率也明显低于对照组抽吸亚组(P < 0.05),说明对于拟行抽吸手术的患者,术前CTA、CTP点征的筛选作用尤为重要,如出现点征阳性,考虑有活动性出血,而抽吸手术不能术中止血,因此不应行钻孔手术,而应改为开颅手术,这样可明显降低术后再出血风险,从而降低死亡率和颅内感染率,改善患者预后。
本研究对联合应用CTA、CTP点征预测脑出血后再出血的风险,并指导脑出血超早期手术方式的选择进行了一定程度的探讨,相对于单一因素预测脑出血后再出血的方式准确性将明显提高。目前已有学者通过联合应用CTA点征与CT混杂密度征来预测脑出血后活动性出血及血肿增大的风险,并用于指导临床治疗的研究[15]。通过引入其他更多的预测手段综合评估,及继续扩大样本例数,本研究结果将更加准确。
| [1] |
Chen Y, Godage IS, Sengupta S, et al. MR conditional steerable needle robot for intracerebral hemorrhage removal[J]. Int J Comput Assist Radiol Surg, 2019, 14(1): 105-115. DOI:10.1007/s11548-018-1854-z |
| [2] |
Wufuer A, Wubuli A, Mijiti P, et al. Impact of collateral circulation status on favorable outcomes in thrombolysis treatment:a systematic review and meta analysi[J]. Exp Ther Med, 2018, 15(1): 707-718. |
| [3] |
Morotti A, Dowlatshahi D, Boulouis G, et al. Predicting intracerebral hemorrhage expansion with noncontrast computed tomography:the bat score[J]. Stroke, 2018, 49(5): 1163-1169. DOI:10.1161/STROKEAHA.117.020138 |
| [4] |
Brouwers HB, Chang Y, Falcone GJ, et al. Predicting hematoma expansion after primary intracerebral hemorrhage[J]. JAMANeurol, 2014, 71(2): 158-164. |
| [5] |
Brouwers HB, Raffeld MR, van Nieuwenhuizen KM, et al. CT angiography spot sign in intracerebral hemorrhage predicts active bleeding during surgery[J]. Neurology, 2014, 83(3): 883-889. |
| [6] |
Dowlatshahi D, Brouwers HB, Demchuk AM, et al. Predicting intracerebal hemorrhasge growth with the spot sign:the effect of onset-to-scant time[J]. Stroke, 2016, 47(3): 695-700. DOI:10.1161/STROKEAHA.115.012012 |
| [7] |
Wang B, Yan S, Xu M, et al. Timing of occurrence is the most important characteristic of spot sign[J]. Stroke, 2016, 47(5): 1233-1238. DOI:10.1161/STROKEAHA.116.012697 |
| [8] |
Wang YH, Fan JY, Luo GD, et al. Hematoma volume affects the accu-racy of computed tomographic angiography 'spot sign' in predicting hematoma expansion after acute intracerebral hemorrhage[J]. Eur Neurol, 2011, 65(3): 150-155. DOI:10.1159/000324153 |
| [9] |
Koculym A, Huynh TJ, Jakubovic R, et al. CT perfusion spot sign improves sensitivity for prediction of outcome compared withCTA and postcontrast CT[J]. Neuroradiol, 2013, 34(5): 965-970. DOI:10.3174/ajnr.A3338 |
| [10] |
Basile JN, Bloch MJ. Analysis of recent papers in hypertension treatment of hypertension in the setting of acute intracerebral hemorrhage:still no clear answer on the best BP level to intervene or what BP goal to achieve[J]. Clin Hypertens, 2014, 16(1): 1-3. |
| [11] |
Hersh EH, Gologorsky Y, Chartrain AG, et al. Minimally Invasive Surgery for Intracerebral Hemorrhage[J]. Stroke, 2018, 18(6): 34-37. |
| [12] |
Scaggiante J, Zhang X, Mocco J, et al. Minimally invasive surgery for intracerebral hemorrhage[J]. Stroke, 2018, 49(11): 2612-2620. DOI:10.1161/STROKEAHA.118.020688 |
| [13] |
Fu C, Wang N, Chen B, et al. Surgical management of moderate basal ganglia intracerebral hemorrhage:comparison of safety and efficacy of endoscopic surgery, minimally invasive puncture and drainage, and craniotomy[J]. World Neurosurg, 2019, 122: e995-e1001. DOI:10.1016/j.wneu.2018.10.192 |
| [14] |
贺中正, 刘峰, 王安生, 等. 两种微创手术方法治疗基底节区中度脑出血临床疗效的比较研究[J]. 国际神经病学神经外科学杂志, 2019, 46(3): 237-239. |
| [15] |
Sporns PB, Schwake M, Schmidt R, et al. Computed tomographic blend sign is associated with computed tomographic angiography spot sign and predicts secondary neurological deterioration after intracerebral hemorrhage[J]. Stroke, 2017, 48(1): 131-133. DOI:10.1161/STROKEAHA.116.014068 |
 2019, Vol. 46
2019, Vol. 46


