扩展功能
文章信息
- 杨亮, 付俊, 宋佳, 庞咪, 李刚, 高鑫雅, 马明明
- YANG Liang, FU Jun, SONG Jia, PANG Mi, LI Gang, GAO Xin-Ya, MA Ming-Ming
- 抗核基质蛋白2抗体阳性炎性肌病临床及病理分析
- A clinicopathological analysis of inflammatory myopathy with anti-nuclear matrix protein 2 autoantibodies
- 国际神经病学神经外科学杂志, 2019, 46(6): 596-600
- Journal of International Neurology and Neurosurgery, 2019, 46(6): 596-600
-
文章历史
收稿日期: 2019-09-28
修回日期: 2019-11-26
特发性炎性肌病是一组以四肢近端肌肉无力为突出表现的异质性肌病,目前公认分为皮肌炎(dermatomyositis, DM)、多发性肌炎(polymyositis, PM)、免疫介导性坏死性肌病(immune-mediated necrotizing myopathy, IMNM)、散发性包涵体肌炎(sporadic inclusion body myositis, sIBM),其中以DM/PM最为常见[1]。肌炎特异性抗体广泛应用于炎性肌病的诊断中,不同抗体与不同临床表型密切相关,抗核基质蛋白2(nuclear matrix protein 2, NXP2)抗体主要见于DM,表现为对称性四肢近端无力,多伴有吞咽困难和肢体水肿,青少年易伴有皮下钙化,成人癌症风险增加[2]。目前国内仅有少数抗NXP2抗体阳性病例报道,其临床、病理特点有待进一步研究。我院神经内科自2018年1月至2018年12月收治4例抗NXP2抗体阳性炎性肌病患者,现回顾性分析其临床病理资料和治疗情况,并报道如下。
1 资料与方法 1.1 临床资料收集2018年1月至2018年12月就诊于我院神经内科抗NXP2抗体阳性的4例患者,总结其临床表现、血清肌酸激酶、肌电图、胸部CT、肌肉磁共振成像(MRI)等特点,其中肌肉MRI短时间反转恢复(STIR)序列观察水肿信号,T1序列观察肌肉有无脂肪浸润。
1.2 肌炎抗体谱检查用免疫印迹法(金域临床检验中心)测定患者血清中以下抗体:抗Mi-2a抗体、抗Mi-2β抗体、抗TIF1γ抗体、抗MDA5抗体、抗NXP2抗体、抗SAE1抗体、抗SRP抗体、抗Jo-1抗体、抗PL-7抗体、抗PL-12抗体、抗EJ抗体、抗OJ抗体、抗Ku抗体、抗PM-Scll00抗体、抗PM-Scl75抗体及抗Ro-52抗体。将患者外周血离心,取血清孵育经过预处理的检测膜条,清洗后经过酶结合物孵育及底物包被,干燥后使用EUROLineScan软件扫描,-为阴性、±为可疑、+为弱阳性、++为阳性,+++为强阳性。
1.3 肌肉病理检查取得患者或其家属同意后,4例患者治疗前均行肌肉活体组织检查(活检)。肌肉标本经异戊烷预冷后在液氮中冰冻固定,冷冻切片,片厚8 μm,行常规组织学和酶组织化学染色,包括苏木精―伊红染色(HE)、改良Gomori染色(MGT)、还原型辅酶I染色(NADH-TR)、琥珀酸脱氢酶染色(SDH)、三磷酸腺苷酶染色(ATPase)、酸性磷酸酶染色(ACP);免疫组织化学染色,包括:CD3、CD4、CD8、CD163、主要组织相容物复合物I(MHC-I)。
2 结果 2.1 临床特点4例患者中男2例,女2例;起病年龄4~59岁;病程20 d~8个月。4例均表现为四肢近端无力,2例伴皮疹(日光疹、Gottron丘疹),3例伴吞咽困难,2例伴肢体水肿。4例颈屈肌力2~4级(MRC肌力评分),四肢近端肌力2~4级,远端肌力5级(表 1)。血清肌酸激酶3例显著升高(1588~5628 U/L),1例正常(126 U/L)。4例肌电图均提示肌源性损害。4例肿瘤标志物阴性,胸部CT平扫、腹部超声均未见明显异常。2例(例1、例2)双下肢X线片未发现皮下钙化。
| 病例编号 | 性别 | 年龄(岁) | 病程 | 近端肌力 | 皮疹 | 水肿 | 吞咽困难 | CK (U/L) | 钙化 | 治疗 | 随访 | |||
| 上肢 | 下肢 | 上肢肌力 | 下肢肌力 | CK(U/L) | ||||||||||
| 1 | 女 | 4 | 4月 | 4 | 4 | 有 | 无 | 无 | 126 | 无 | 糖皮质激素 | 5 | 5 | 188 |
| 2 | 男 | 36 | 8月 | 4 | 4 | 有 | 无 | 有 | 2546 | 无 | 糖皮质激素 | 5 | 5 | 46 |
| 3 | 女 | 40 | 2月 | 3 | 2 | 无 | 有 | 有 | 1588 | 无 | 糖皮质激素;甲氨喋呤 | 4 | 4 | 569 |
| 4 | 男 | 59 | 20 d | 4 | 4 | 无 | 有 | 有 | 5628 | 无 | 糖皮质激素 | - | - | - |
4例患者大小腿肌肉MRI在STIR序列可见部分肌群、筋膜、皮下组织水肿信号(图 1)。3例(例1、例2、例3)大腿前后肌群广泛水肿,1例(例4)以股外侧肌水肿为主。3例(例1、例2、例3)小腿肌群水肿以前群及深部肌群为主,后群相对不受累,1例(例4)小腿后肌群水肿,胫骨前肌相对不受累。4例T1序列均未见肌肉脂肪浸润。
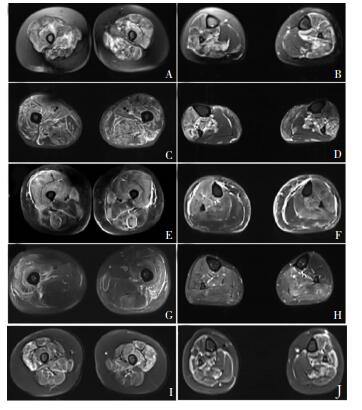
|
| 注:A:例1大腿MRI;B:例1小腿MRI;C:例2大腿MRI;D:例2小腿MRI;E:例3大腿MRI;F:例3小腿MRI;G:例4大腿MRI;H:例4小腿MRI。I:例1大腿MRI(复查);J:例1小腿MRI(复查)。 图 1 4例患者双下肢MRI STIR像 |
4例患者血清均检测到抗NXP2抗体强阳性(+++);1例(例4)患者抗Ro-52强阳性(+++)。
2.3 肌肉病理结果3例患者(例1、例2、例3)肌肉病理显示肌纤维大小不等,以束周萎缩为主,散在肌纤维坏死、再生,血管周围和肌束膜炎细胞浸润。1例患者(例4)肌肉病理大致正常,未见束周萎缩及炎细胞浸润(图 2)。3例患者(例1、例2、例3)萎缩肌纤维区肌内衣可见较多CD3+、CD4+及CD163+细胞浸润、个别CD8+细胞浸润,例4免疫组织化学染色未见明显异常。
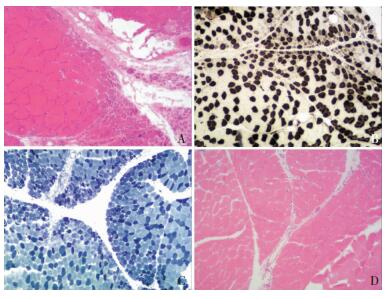
|
| 注:A:例2 HE染色;B:例1 ATP 10.4染色;C:例3 NADH染色;D:例4 HE染色。A、B、C均显示束周肌纤维萎缩,D未见明显异常。 图 2 4例患者肌肉病理检查结果(×40) |
结合患者临床表现、实验室检查以及骨骼肌病理检查,根据2004年ENMC对于特发性炎性肌病的诊断标准[1],本组患者最终2例(例1、例2)诊断为确诊DM,1例(例3)为可疑无皮炎性皮肌炎,1例(例4)为非特异性肌炎。
2.5 治疗及随访4例患者均给予糖皮质激素治疗,其中3例(例1、例2、例4)给予糖皮质激素(甲泼尼龙240 mg/d×3 d+120 mg/d×3 d)静脉治疗,后改为口服强的松(每日1 mg/kg)治疗;1例(例3)口服强的松(每日60 mg)联合甲氨喋呤(初始每周7.5 mg,逐渐加量至每周15 mg)治疗。出院后强的松规律减量,3个月后随访评估患者症状、肌力、血清肌酸激酶、下肢肌肉MRI变化。
随访3个月时,例1和例2四肢无力恢复正常;例3吞咽困难好转,肢体水肿消失,四肢肌力较前好转。3例患者肌酸激酶下降至46~569 U/L(表 1)。例1复查肌肉MRI,STIR序列水肿信号较前减弱。例4于出院1月后于当地医院死亡,具体不详。
3 讨论Oddis等学者于1997年在青少年皮肌炎患者中发现一种抗体,将其命名为抗MJ抗体,直到2007年Targoff等[3]明确其靶抗原为核基质蛋白2(NXP2),故将该抗体命名为抗NXP2抗体。随后研究发现抗NXP2抗体在成人患者也可出现[2]。抗NXP2抗体在特发性炎性肌病阳性率差异很大,报道范围在1.6%~25%[2, 4]。
本组4例抗NXP2抗体阳性患者,2例(50%)为女性,和文献报道57%[5]接近,也有报道女性患者占70%[6]。4例患者急性起病,均表现为四肢近端对称性肌无力,为炎性肌病典型表现。抗NXP2抗体为肌炎特异性抗体,多出现在皮肌炎患者[5],故也称为皮肌炎相关抗体。目前公认的皮肌炎相关抗体有Mi-2抗体、MDA5抗体、SAE抗体、TIF1-γ抗体[14]。这些抗体阳性常伴有典型皮肌炎皮疹,包括日光疹、Gottron征,本组2例患者出现皮疹,符合典型皮肌炎表现。与其他皮肌炎相关抗体阳性患者相比,抗NXP2抗体阳性患者易伴有吞咽困难和肢体水肿[2, 5, 6],本组3例出现吞咽困难,2例出现肢体水肿。文献报道皮下钙化与抗NXP2抗体相关,皮下钙化在青少年抗NXP2抗体阳性炎性肌病中出现率为31%~54%[4, 6],在成人患者出现率为14%~30%[5, 7],本组患者均无皮下钙化,可能与样本量小或随访时间短有关。炎性肌病常常合并间质性肺病,特别是抗MDA5抗体阳性患者常伴有严重间质性肺病[14],但文献报道抗NXP2抗体阳性患者较少出现间质性肺病[8, 9],本组4例患者均无间质性肺病。皮肌炎患者常伴发肿瘤,特别是抗TIF1-γ抗体阳性的患者[18],但是抗NXP2抗体阳性患者与肿瘤的关系尚不明确。Ichimura等[2]报道8例成人抗NXP2抗体阳性患者,3年内有4人(50%)发现恶性肿瘤;Albayda等[8]对235例皮肌炎患者检测发现,在56例抗NXP2抗体阳性患者中5例(9%)合并肿瘤,179例抗体阴性患者中14例(8%)出现肿瘤,两组肿瘤发生风险无明显差异,但较正常人群肿瘤发生风险增加3.68倍。本组4例患者未发现肿瘤,对其随访中仍应关注有无肿瘤发生。
肌肉MRI改变特点有助于特发性炎性肌病的诊断、亚型分类及随访评估。STIR序列上肌群高信号提示肌肉水肿改变,是诊断炎性肌病的重要线索。MRI受累模式不同有助于区分不同的炎性肌病亚型:多发性肌炎多表现弥漫性肌肉水肿而无皮下水肿,常以双侧大腿或大腿后群肌肉受累为主;皮肌炎多表现为斑片状肌肉水肿以及皮下组织和筋膜水肿[10];免疫介导坏死性肌病多表现为股外侧肌水肿,股中间肌常不受累,且容易合并大腿后群肌肉脂肪浸润[11];包涵体肌炎常以大腿前群肌肉受累为主,且多不对称,可伴肌肉脂肪浸润[10, 12]。本组4例患者下肢MRI出现肌群及筋膜水肿信号,提示皮肌炎;3例患者大腿前后肌群广泛水肿,1例以股外侧肌水肿为主,小腿肌群水肿以前群及深部肌群为主,后群相对不受累;目前尚未见抗NXP2抗体阳性炎性肌病肌肉MRI改变的报道,本组患者肌肉MRI改变是否具有特异性有待大样本量进一步研究。治疗后肌肉MRI水肿信号较前减弱,临床症状好转,提示MRI水肿信号有助于随访评估[13]。
肌肉病理出现束周肌纤维萎缩,对皮肌炎诊断具有较高的特异性[14, 15],本组3例患者肌肉活检可见束周肌纤维萎缩,血管周围和肌束膜炎性细胞浸润,诊断为皮肌炎,其中2例患者具有皮肌炎典型皮疹,诊断为确诊的皮肌炎,1例患者无皮疹,诊断为可疑的无皮炎性皮肌炎。例4下肢MRI出现肌肉及筋膜水肿信号,肌肉病理大致正常,未发现炎细胞浸润及其他炎性肌病病理改变,诊断为非特异性肌炎,由于取材部位不同可能影响肌肉病理结果[16],例4非特异性病理改变可能与取材部位有关。
抗NXP2抗体阳性患者,治疗效果较好[7]。本组3例患者对糖皮质激素反应良好,随访3个月时,临床症状好转,肌酸激酶不同程度降低,肌肉MRI水肿信号较前减弱。抗NXP2抗体阳性患者可伴有皮下钙化,对于这类患者,单纯药物治疗对皮下钙化无效[17],手术切除治疗可使部分患者完全缓解,但部分患者可出现钙化复发。
总之,抗NXP2抗体阳性炎性肌病患者以皮肌炎为主要表现,常伴有肢体水肿、吞咽困难,下肢MRI提示肌肉和筋膜水肿。骨骼肌病理以束周肌纤维萎缩为主。该病对糖皮质激素治疗较为敏感,预后较好。
| [1] |
Hoogendijk JE, Amato AA, Lecky BR, et al. 119th ENMC international workshop:trial design in adult idiopathic inflammatory myopathies, with the exception of inclusion body myositis, 10-12 October 2003, Naarden, The Netherlands[J]. Neuromuscul Disord, 2004, 14(5): 337-345. DOI:10.1016/j.nmd.2004.02.006 |
| [2] |
Ichimura Y, Matsushita T, Hamaguchi Y, et al. Anti-NXP2 autoantibodies in adult patients with idiopathic inflammatory myopathies:possible association with malignancy[J]. Ann Rheum Dis, 2012, 71(5): 710-713. DOI:10.1136/annrheumdis-2011-200697 |
| [3] |
Targoff I, Trieu E, Levy-Neto M, et al. Sera with Autoantibodies to the MJ Antigen React with NXP2[J]. Arthritis Rheum, 2007, 56: S787. |
| [4] |
Espada G, Maldonado Cocco JA, Fertig N, et al. Clinical and serologic characterization of an Argentine pediatric myositis cohort:identification of a novel autoantibody (anti-MJ) to a 142-kDa protein[J]. J Rheumatol, 2009, 36(11): 2547-2551. DOI:10.3899/jrheum.090461 |
| [5] |
陈智勇, 胡伟, 郭子维, 等. 抗核基质蛋白2抗体阳性多发性肌炎/皮肌炎七例临床分析并文献复习[J]. 中华风湿病学杂志, 2014, 18(12): 810-814. DOI:10.3760/cma.j.issn.1007-7480.2014.12.005 |
| [6] |
Gunawardena H, Wedderburn LR, Chinoy H, et al. Autoantibodies to a 140-kd protein in juvenile dermatomyositis are associated with calcinosis[J]. Arthritis Rheum, 2009, 60(6): 1807-1814. DOI:10.1002/art.24547 |
| [7] |
Ceribelli A, Fredi M, Taraborelli M, et al. Anti-MJ/NXP-2 autoantibody specificity in a cohort of adult Italian patients with polymyositis/dermatomyositis[J]. Arthritis Res Ther, 2012, 14(2): 1-6. |
| [8] |
Albayda J, Pinal-Fernandez I, Huang W, et al. Dermatomyositis Patients with Anti-Nuclear Matrix Protein-2 Autoantibodies Have More Edema, More Severe Muscle Disease, and Increased Malignancy Risk[J]. Arthritis Care Res (Hoboken), 2017, 69(11): 1771-1776. DOI:10.1002/acr.23188 |
| [9] |
Yang H, Lu X, Peng Q, et al. Differential Clinical Associations of Anti-Nuclear Matrix Protein 2 Autoantibodies in Patients With Idiopathic Inflammatory Myopathies[J]. Arthritis Rheumatol, 2018, 70(8): 1288-1297. DOI:10.1002/art.40491 |
| [10] |
Cantwell C, Ryan M, O'Connell M, et al. A comparison of inflammatory myopathies at whole-body turbo STIR MRI[J]. Clin Radiol, 2005, 60(2): 261-267. DOI:10.1016/j.crad.2004.06.027 |
| [11] |
Zheng Y, Liu L, Wang L, et al. Magnetic resonance imaging changes of thigh muscles in myopathy with antibodies to signal recognition particle[J]. Rheumatology (Oxford), 2015, 54(6): 1017-1024. DOI:10.1093/rheumatology/keu422 |
| [12] |
Dion E, Cherin P, Payan C, et al. Magnetic resonance imaging criteria for distinguishing between inclusion body myositis and polymyositis[J]. J Rheumatol, 2002, 29(9): 1897-1906. |
| [13] |
Day J, Patel S, Limaye V. The role of magnetic resonance imaging techniques in evaluation and management of the idiopathic inflammatory myopathies[J]. Semin Arthritis Rheum, 2017, 46(5): 642-649. DOI:10.1016/j.semarthrit.2016.11.001 |
| [14] |
Allenbach Y, Benveniste O, Goebel HH, et al. Review:Integrated classification of inflammatory myopathies[J]. Neuropathol Appl Neurobiol, 2017, 43(1): 62-81. DOI:10.1111/nan.12380 |
| [15] |
Pinalfernandez I, Casciolarosen LA, Christopherstine L, et al. The Prevalence of Individual Histopathologic Features Varies according to Autoantibody Status in Muscle Biopsies from Patients with Dermatomyositis[J]. J Rheumatol, 2015, 42(8): 1448-1454. DOI:10.3899/jrheum.141443 |
| [16] |
张羽彤, 蒲传强, 班瑞, 等. 肌肉病患者56例重复肌肉活体组织检查分析[J]. 中华神经科杂志, 2016, 49(8): 620-624. DOI:10.3760/cma.j.issn.1006-7876.2016.08.008 |
| [17] |
Fredi M, Bartoli F, Cavazzana I, et al. Calcinosis in poly-dermatomyositis:clinical and laboratory predictors and treatment options[J]. Clin Exp Rheumatol, 2017, 35(2): 303-308. |
| [18] |
Masiak A, Kulczycka J, Czuszyńska Z, et al. Clinical characteristics of patients with anti-TIF1-γ antibodies[J]. Reumatologia, 2016, 54(1): 14-18. |
 2019, Vol. 46
2019, Vol. 46




