扩展功能
文章信息
- 袁雄, 曾而明
- 液体活检技术在中枢神经系统肿瘤中的应用
- 国际神经病学神经外科学杂志, 2019, 46(4): 469-472
-
文章历史
收稿日期: 2019-04-11
修回日期: 2019-07-22
目前,肿瘤的研究和治疗正进入精准医学时代,这需要更好的生物标志物和更多的检测手段,以提高诊断疾病、评估治疗反应和预测患者预后的能力。近年来的研究表明,肿瘤相关遗传物质可在患者体液中检测到,这些遗传物质可作为生物标志物,用来监测早期肿瘤,并有助于肿瘤的个体化治疗。液体活检作为一种方便、快捷、非侵入性、可多次取样、能动态反映肿瘤基因表达谱变化的病理检测方法,在精准医学的大背景下应运而生,与传统的检查方法相比有其优势[11]。
1 传统检查方法的局限性 1.1 影像学方面磁共振技术(Magnetic Resonance Imaging,MRI)、磁共振波普分析(Magnetic Resonance Popper Analysis,MRS)、脑功能成像(functional magnetic resonance imaging, fMRI)、SPET-CT、PET-CT等在诊断疾病,评估治疗效果和疾病监测等方面发挥了重要作用。然而其缺点也不容忽视,一方面由于肿瘤细胞大小是10μm量级,需要经过20轮的指数生长后,才可被检测到。所以一些微小的肿瘤原发灶或者复发灶难以被发现,导致丧失了可能有效的新靶向治疗机会[8]。另一方面胶质瘤放、化疗后因局部血脑屏障的改变,可能导致对比度增加,通常称为假性进展。相反,抗血管生成剂可通过改变肿瘤脉管系统的通透性来降低对比度[13],称之为假性消退。故MRI无法区分肿瘤消退、进展、复发或者是治疗后反应[15],导致许多患者进行不必要的重复手术。
1.2 传统组织活检即:通过从患者体内钳取或穿刺等获得病变组织,进行病理学检查的技术。但它存在许多缺点。1)作为一种侵入性的技术,活检操作后可产生如下并发症:头痛、头晕,出血,水肿(5%~8%),癫痫,转移(通过穿刺通道),甚至死亡(1%)等[8]。2)有些部位例如脑干不适合活检。3)通常原发性中枢神经系统淋巴瘤患者使用皮质类固醇类药物来减轻症状,然而因药物的作用导致更难以获得有限的病变组织用于活检[17],假阴性结果的可能性增加。4)对于转移瘤也基本无法获取所有部位标本,然而由于肿瘤的异质性,各个部位肿瘤性质往往不一样[19, 7]。5)在疾病的治疗及后续演变中为了明确是否复发或者治疗后反应也不便反复多次活检。
1.3 细胞学和流式细胞术脑脊液(CSF)和玻璃体液的细胞学或流式细胞术可用于中枢神经系统淋巴瘤的诊断[16]。相对于活检,它是一种非侵入性手段。然而只有当淋巴瘤侵犯软脑膜或眼部时才能发现淋巴细胞群,另外细胞学和流式细胞术分析诊断灵敏度低[2]。
2 小分子物质及其在神经系统肿瘤中的价值 2.1 循环肿瘤细胞(Circulating Tumor Cell,CTC) 2.1.1 CTC定义,检测及获取技术CTC即循环肿瘤细胞,它是从肿瘤起源部位或转移性沉积物中脱落的细胞,然后转移至全身体液循环中[13]。CTC在体液中含量少,为了富集CTC,一些新技术应运而生。如利用分子表面标志物的cell search技术、免疫磁性标记技术、物理分离技术(根据细胞体积大小)、聚合酶链式反应(PCR)技术[20]、CTC-芯片技术(根据细胞变形差异)等[4]。另外有研究人员使用物理分离技术和免疫荧光技术联合更多中枢神经系统特异性标志物如GFAP和Nestin来鉴定胶质瘤患者的CTC [3]。
2.1.2 CTC的应用诊断方面:Nayak等首次证明了在软脑膜转移(leptomeningeal metastasis,LM)的诊断中,脑脊液CTC比常规影像学手段和脑脊液细胞学方法灵敏度和特异性更高[21]。治疗方面:早期有数据表明脑脊液中CTC负荷与临床症状严重程度和治疗相关。一项对中枢神经系统转移瘤患者的小型研究表明:如果脑脊液中CTC数量> 104,头痛,恶心,呕吐等症状明显。对7名乳腺癌脑转移患者进行连续脑脊液分析发现,所有患者在治疗后CTC数量下降[21]。预后方面:由于在放疗前可检测到一定水平的CTC,因此对CTC的连续监测可以检测是否复发[21]。
2.2 循环肿瘤DNA (Circulating Tumor DNA,ctDNA) 2.2.1 ctDNA的定义、检测及获取技术1994年发现一小部分循环DNA片段与患者肿瘤DNA具有相同的突变,此种循环DNA称之为循环肿瘤DNA(Circulating Tumor DNA,ctDNA)[21]。血清中ctDNA的数量与疾病阶段和肿瘤负荷量有关,百分比范围为1%至超过10%[3]。目前用于检测ctDNA的技术包括:数字PCR(digital polymerase chain reaction,dPCR),BEAMing技术,同步热梯度电泳和大规模并行测序[5]。
2.2.2 ct-DNA的应用神经系统恶性肿瘤外周血中可检测出ctDNA,尽管灵敏度低于非中枢神经系统恶性肿瘤[22]。作者认为可以用血脑屏障或涂有粘蛋白的器官阻碍ctDNA释放到循环中来解释[20]。
神经系统恶性肿瘤脑脊液中可检测出ctDNA。研究表明任何残留或复发肿瘤的ctDNA可通过手术产生的通道进入脑脊液。即使没有手术,绝大多数成神经管细胞瘤和室管膜瘤也会出现脑室内或与脑室相通,这非常适合在脑脊液中检测ctDNA[21]。另外一些研究表明,除非存在明显的全身性疾病,否则中枢神经系统恶性肿瘤患者脑脊液中ctDNA可能比外周血具有更高的诊断率[21]。所有神经管细胞瘤,室管膜瘤和脑室旁的高级别胶质瘤均可检测到CSF-tDNA,而与脑脊液未直接相邻的肿瘤未检测到CSF-tDNA。并且高级别(WHO Ⅲ级和Ⅳ级)肿瘤比低级别更能检测到CSF-tDNA(P=0.004)[21]。CSF中ctDNA的可检测性(最低可检测水平)与人口统计学特征、症状持续时间、是否有脑积水、MRI是否有强化、突变类型无关与肿瘤在颅脑中的部位相关[21]。
通过分析ct-DNA可发现基因突变[23]。如在胶质瘤患者血浆循环DNA片段中,可以检测出高度特异性的IDH1突变[18],并且可以对血浆样本进行重复分析[5]。分析ct-DNA可发现体细胞突变。新兴研究已经证明了使用PCR技术(定量PCR,数字PCR)和基于NGS的技术(例如SafeSeq,CAPP-Seq,TAMSeq)可发现肿瘤ctDNA的体细胞突变。该研究发现43%的GBM患者ctDNA在21个基因检测中至少有一个体细胞改变,最常见的突变是TP53[1, 24]。
ct-DNA可指导治疗和评估预后。研究得出:通过影像学和临床检查发现,与非甲基化MGMTctDNA相比,甲基化MGMT ctDNA的患者对BCNU(卡氮芥)治疗的反应显著升高[12]。此外尽管不同癌症患者的ctDNA水平差异很大,但同一患者的ctDNA水平与肿瘤负荷相关。因此通过连续测试的ctDNA水平可以监测肿瘤进展,药物效果和疾病复发[3]。
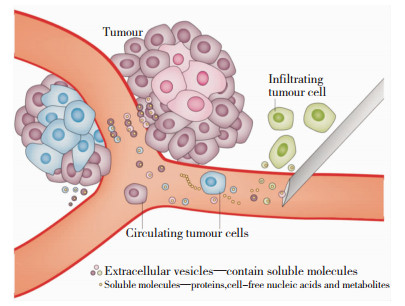
2.3 细胞外囊泡(Extracellular Vesicle,EV) 2.3.1 EV的定义及检测技术外泌体(Exosomes, EV):是细胞内的多泡体和细胞膜融合后主动分泌到外界的一种大小为30~100 nm,具有脂质双分子层膜结构的小囊泡,包含蛋白质、mRNA及微小RNA(microRNA, miRNA)(见图 1)[5, 9]。由于分子小,EV的分析带来了重大的技术挑战。通过流式细胞术可以分析大型EV(> 300 nm)。新一代细胞仪器,包括Apogee流动系统,Gallios(Beckman Coulter)和BD-Influx(Becton Dickinson)可用于分析 < 200nm的EV。
2.3.2 EV的应用研究表明外泌体中的RNA相当稳定并且可以通过血脑屏障使其成为分子诊断的宝贵来源[14, 3]。EV中miRNA是小的(约21~24个核苷酸)非编码RNA分子。一项原发性中枢神经系统淋巴瘤研究中指出:外泌体在许多细胞途径中起关键作用,并且miRNA的功能障碍被发现是恶性肿瘤的特征[8]。miRNA有助于诊断。miRNA差异表达可以用来区分胶质母细胞瘤患者和健康患者[24]。另外越来越多的证据表明某些脑脊液miRNA是中枢神经系统恶性肿瘤所独有的,例如miR-15和miR-21具有神经胶质瘤的特异性而miR-19,miR-21和miR-92的组合对于原发性中枢神经系统淋巴瘤具有高度诊断性[21]。miRNA可影响疾病的发生发展、评估病情、指导治疗和反映预后。miR-10b和miR-21可反映原发性和继发性脑肿瘤的疾病活动。另一项研究指出miR-21是胶质母细胞瘤细胞系中的抗凋亡因子并且与健康患者相比在组织中始终上调[21]。miR130a被发现与替莫唑胺反应呈正相关,与MGMT甲基化状态无关[20]。miR603是MGMT的一种调节因子,可以补充对MGMT甲基化评估。在一项研究中得出胶质母细胞瘤亚型特异性miRNA谱对评估预后具有价值[21],但与ctDNA一样需要前瞻性纵向研究明确定义miRNA的作用[20]。
EV所覆盖的遗传信息中可发现BRAF,KRAS或EGFR突变[5, 12, 6],它们在多种原发性肿瘤中具有高度敏感性和特异性。通过检测EV中的基因突变有助于诊断、反应治疗及监测疾病等。
3 局限性 3.1 检测技术方面RT-PCR和qPCR目前被广泛用作CTC的鉴定,但是在污染细胞存在的情况下具有很强的假阳性[4]。应用Cell-search技术检查CTC所需要的标志物在中枢神经系统肿瘤中很少表达。新二代测序(NGS)检测CSF-ctDNA的灵敏度有限[10],此外全基因组测序(WGS)或全外显子组测序(WES)费用过于昂贵[3]。
EV检测方面:由于非肿瘤细胞也分泌EV并且这些细胞超过肿瘤细胞几个数量级,因此肿瘤特异性EV在临床样品中仍然很少见[21]。此外生物流体具有动态性质,它的含量受到很多因素影响[9]。此外目前mi-RNA的提取,纯化,分析和定量方法没有实现标准化和可重复性[5]。
3.2 临床应用方面CTC的分离通常需要新鲜血液样品或相对能够立即处理的样品,并要求短时间内对其分析,这可能限制了CTC的应用。
EV的应用方面:外泌体中的分子物质是选择性组装的,因此释放的miRNA仅代表部分亚群,另外活动性炎症的存在也会干扰检测结果[5]。此外所有研究中仅仅只有几种miRNA被成功利用, 而且只有少数研究使用了共同的miRNA,有些研究甚至得出关于生存预测完全相反的结论[21]。与其他系统肿瘤不同,胶质瘤的循环生物标志物仍在定义中,并且尚未在临床实践中使用。每一种方法都有其独特的优势与局限性,因此到目前为止,关于取哪种样本(DNA或者RNA),使用哪种分析技术可以实现液体活检价值最大化,还无定论[5]。
4 总结与未来展望液体活检技术是一项新兴技术,最近已被MIT Technology Review评选为2015年10大技术突破之一。目前研究表明脑脊液中ctDNA、miRNA包含丰富的基因信息,可辅助肿瘤的诊断,反应治疗效果,评估预后等。近年来液体活检的研究取得了快速的进展,但在临床应用前仍存在许多问题。相信随着科技的发展和医学的进步,在当今精准医学的要求下,液体活检技术将逐渐被重视,其有广泛的应用前景和广阔的发展空间。
| [1] |
Wang Y, Springer S, Zhang M, et al. Detection of tumor-derived DNA in cerebrospinal fluid of patients with primary tumors of the brain and spinal cord[J]. Proc Natl Acad Sci USA, 2015, 112(31): 9704-9709. DOI:10.1073/pnas.1511694112 |
| [2] |
杨凌舸, 罗鹏, 陈士奇. 液体活检技术在肿瘤中的研究与应用进展[J]. 肿瘤, 2018, 38(11): 1090-1096. |
| [3] |
Ca ix, Janku F, Zhan Q, et al. Accessing Genetic Information with Liquid Biopsies[J]. Trends Genet, 2015, 31(10): 564-575. DOI:10.1016/j.tig.2015.06.001 |
| [4] |
Adamczyk LA, Williams H, Frankow A, et al. Current Understanding of Circulating Tumor Cells-Potential Value in Malignancies of the Central Nervous System[J]. Front Neurol, 2015, 6: 174. |
| [5] |
Westphal M, Lamszus K. Circulating biomarkers for gliomas[J]. Nat Rev Neurol, 2015, 11(10): 556-66. DOI:10.1038/nrneurol.2015.171 |
| [6] |
Rennert RC, Hochberg FH, Carter BS. ExRNA in biofluids as biomarkers for brain tumors[J]. Cell Mol Neurobiol, 2016, 36(3): 353-360. DOI:10.1007/s10571-015-0284-5 |
| [7] |
Schwaederle M, Husain H, Fanta PT, et al. Detection rate of actionable mutations in diverse cancers using a biopsy-free (blood) circulating tumor cell DNA assay[J]. Oncotarget, 2016, 7(9): 9707-9717. |
| [8] |
van Westrhenen A, Smidt LCA, Seute T, et al. Diagnostic markers for CNS lymphoma in blood and cerebrospinal fluid:a systematic review[J]. Br J Haematol, 2018, 182(3): 384-403. DOI:10.1111/bjh.15410 |
| [9] |
Santiago-Dieppa DR, Steinberg J, Gonda D, et al. Extracellular vesicles as a platform for 'liquid biopsy' in glioblastoma patients[J]. Expert Rev Mol Diagn, 2014, 14(7): 819-825. DOI:10.1586/14737159.2014.943193 |
| [10] |
Ballester LY, Glitza Oliva IC, Douse DY, et al. Evaluating circulating tumor DNA from the cerebrospinal fluid of patients with melanoma and leptomeningeal disease[J]. J Neuropathol Exp Neurol, 2018, 77(7): 628-635. DOI:10.1093/jnen/nly046 |
| [11] |
王曼.液体活检在胶质瘤研究中的概况[D].河北医科大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10089-1018859191.htm
|
| [12] |
Best MG, Sol N, Zijl S, et al. Liquid biopsies in patients with diffuse glioma[J]. Acta Neuropathol, 2015, 129(6): 849-865. DOI:10.1007/s00401-015-1399-y |
| [13] |
Shankar GM, Balaj L, Stott SL, et al. Liquid biopsy for brain tumors[J]. Expert Rev Mol Diagn, 2017, 17(10): 943-947. DOI:10.1080/14737159.2017.1374854 |
| [14] |
Fontanilles M, Duran-Peña A, Idbaih A. Liquid Biopsy in Primary Brain Tumors:Looking for Stardust![J]. Curr Neurol Neurosci Rep, 2018, 18(3): 13. DOI:10.1007/s11910-018-0820-z |
| [15] |
Zachariah MA, Oliveira-Costa JP, Carter BS, et al. Blood-based biomarkers for the diagnosis and monitoring of gliomas[J]. NeuroOncol, 2018, 20(9): 1155-1161. |
| [16] |
Royer-Perron L, Hoang-Xuan K, Alentorn A. Primary central nervous system lymphoma:time for diagnostic biomarkers and biotherapies?[J]. Curr Opin Neurol, 2017, 30(6): 669-676. DOI:10.1097/WCO.0000000000000492 |
| [17] |
Hiemcke-Jiwa LS, Leguit RJ, Snijders TJ, et al. Molecular analysis in liquid biopsies for diagnostics of primary central nervous system lymphoma:Review of literature and future opportunities[J]. Crit Rev Oncol Hematol, 2018, 127: 56-65. DOI:10.1016/j.critrevonc.2018.05.010 |
| [18] |
Verduin M, Compter I, Steijvers D, et al. Noninvasive glioblastoma testing:multimodal approach to monitoring and predicting treatment response[J]. Dis Markers, 2018, 2018: 2908609. |
| [19] |
Fontanilles M, Marguet F, Bohers É, et al. Non-invasive detection of somatic mutations using next-generation sequencing in primary central nervous system lymphoma[J]. Oncotarget, 2017, 8(29): 48157-48168. |
| [20] |
Connolly ID, Li Y, Gephart MH, et al. The"Liquid Biopsy":the Role of Circulating DNA and RNA in Central Nervous System Tumors[J]. Curr Neurol Neurosci Rep, 2016, 16(3): 25. DOI:10.1007/s11910-016-0629-6 |
| [21] |
Nevel KS, Wilcox JA, Robell LJ, et al. The Utility of Liquid Biopsy in Central Nervous System Malignancies[J]. Curr Oncol Rep, 2018, 20(8): 60. DOI:10.1007/s11912-018-0706-x |
| [22] |
Stewart CM, Kothari PD, Mouliere F, et al. The value of cell-free DNA for molecular pathology[J]. J Pathol, 2018, 244(5): 616-627. DOI:10.1002/path.5048 |
| [23] |
Wang J, Bettegowda C. Applications of DNA-Based Liquid Biopsy for Central Nervous System Neoplasms[J]. J Mol Diagn, 2017, 19(1): 24-34. DOI:10.1016/j.jmoldx.2016.08.007 |
| [24] |
Touat M, Duran-Peña A, Alentorn A, et al. Emerging circulating biomarkers in glioblastoma:promises and challenges[J]. Expert Rev Mol Diagn, 2015, 15(10): 1311-1323. DOI:10.1586/14737159.2015.1087315 |
 2019, Vol. 46
2019, Vol. 46