扩展功能
文章信息
- 李雪峰, 胡观成, 李飞扬, 梅苑, 张世阳, 王建村
- LI Xue-Feng, HU Guan-Cheng, LI Fei-Yang, MEI Yuan, ZHANG Shi-Yang, WANG Jian-Cun
- 动脉瘤性蛛网膜下腔出血后低血钾对短期预后的影响分析
- An analysis of the effect of hypokalemia after aneurysmal subarachnoid hemorrhage on short-term prognosis
- 国际神经病学神经外科学杂志, 2019, 46(4): 416-421
- Journal of International Neurology and Neurosurgery, 2019, 46(4): 416-421
-
文章历史
收稿日期: 2019-04-25
修回日期: 2019-07-22
2. 湖南师范大学附属张家界市人民医院神经外科, 湖南省张家界市 427000
2. Department of neurosurgery, Zhangjiajie People's Hospital Affiliated to Hunan Normal University, Zhangjiajie, Hunan 427000, China
动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage, aSAH)是对人类健康有严重危害的一类脑血管疾病,其发病率占自发性蛛网膜下腔出血(subarachnoid hemorrhage, SAH)的85%左右[1, 2]。随着诊疗技术的进步,该病在发达国家的病死率逐年下降[3],但残留的神经功能障碍仍不能得到良好解决。近年来有不少研究提出低钠血症与动脉瘤性蛛网膜下腔出血预后有一定关联,但关于低钾血症研究偏少[4]。该研究通过单中心回顾性分析符合纳入标准的103例患者,揭示影响动脉瘤性蛛网膜下腔出血短期预后的危险因素,以及入院时血钾水平与短期预后的关系。
1 资料与方法 1.1 资料回顾性纳入张家界市人民医院神经外科自2014年1月至2018年6月期间收治的aSAH患者病历资料进行分析研究。根据纳入排除标准筛得有效病例共103例,符合要求患者中男28例(27.2%), 女75例(72.8%); 年龄35~80岁, 平均(56.20±8.92)岁。年龄分组:35~50岁30例(29.1%);51~65岁55例(53.4%);66~80岁18例(17.5%);土家族有82例(79.6%),汉族13例(12.6%),其他民族(苗族、白族)7例(6.8%)。
1.2 纳入及排除标准纳入标准:(1)首次发病,自发起病;(2)发病后72小时内到达医院治疗;(3)年龄在35~80岁之间;(4)经CT血管造影(CT angiography,CTA)或数字减影血管造影(digital subtraction angiography,DSA)证实为动脉瘤性蛛网膜下腔出血;(5)均行开颅手术治疗。排除标准:(1)病例资料缺失观察指标项;(2)排除动静脉畸形、烟雾病、血管炎、颅内静脉系统血栓形成等其他疾病引起自发性蛛网膜下腔出血。(3)排除其他可导致低钾血症的疾病如低钾性周期性麻痹、碱中毒等。
1.3 方法患者入院后根据动脉瘤性蛛网膜下腔出血的治疗指南(ASA/AHA 2012版)分析影像学检查、临床表现,确诊为动脉瘤性蛛网膜下腔出血。据CTA或DSA将动脉瘤的部位划分为前交通动脉、后交通动脉、大脑中动脉及其他部位(颈内动脉、眼动脉、椎动脉、小脑后下动脉等);收集其年龄、性别、民族、Hunt-hess分级等一般情况,入院时(术前)血钾、血常规、血气分析等指标,记录患者住院时间(length of stay,LOS)。以血钾水平分为两组,低血钾组(0~3.5mmol/L),正常血钾组(3.5~5.5mmol/L);患者均行开颅手术治疗,术后2周,以改良Rankin量表(modified rankin scale,mRS)进行分组[5],其中0~2分归为短期预后良好,3~5分为短期预后不良,6分为死亡。评估血钾水平及其他影响因素对短期预后的影响。
1.4 统计学处理采用SPSS 20.0统计软件分析相关数据, 计数资料以例数和百分率(%)表示, 14天的改良Rankin评分为因变量,对自变量进行单因素有序Logistic回归检验,纳入P < 0.05的自变量,或根据临床意义放宽纳入多因素有序回归的标准[6],将所得变量进行有序多项Logistic回归,以P < 0.05为差异有统计学意义。
2 结果 2.1 一般结果根据患者术后的14天时mRS评分,将其分为短期预后良好60例(58.25%),短期预后不良42例(40.78%),死亡1例(0.97%)。将符合条件的自变量纳入多因素方程中。通过患者影像资料,查看有无脑室或脑实质出血,将患者分为二者均无、仅有其一和二者均有组。
2.2 影响短期预后的单因素有序回归见表 1。
| 短期预后良好(n=60) | 短期预后不良(n=42) | 死亡(n=1) | P值 | |
| 年龄 | ||||
| 35~50岁 | 21(70.0) | 9(30.0) | - | 0.091 |
| 51~65岁 | 31(56.2) | 24(43.6) | - | 0.293 |
| 66~80岁 | 8(44.5) | 9(50.0) | 1(5.6) | - |
| 性别 | ||||
| 男 | 15(53.5) | 12(42.8) | 1(3.6) | 0.22 |
| 女 | 45(60.0) | 30(49.0) | - | - |
| 民族 | ||||
| 土家族 | 44(53.0) | 38(45.8) | 1(1.2) | 0.738 |
| 汉族 | 10(76.9) | 3(23.1) | - | 0.951 |
| 其他民族a | 5(71.5) | 2(28.6) | - | - |
| 呕吐史 | ||||
| 无 | 21(54.8) | 18(46.1) | - | 0.906 |
| 有 | 39(60.9) | 24(37.5) | 1(1.6) | - |
| 血钾水平 | ||||
| 低血钾 | 21(53.8) | 17(43.6) | 1(2.6) | 0.049 |
| 正常血钾 | 39(61.0) | 25(39.1) | - | - |
| 白细胞计数 | ||||
| 白细胞偏低 | - | 1(100%) | - | 0.793 |
| 白细胞正常 | 27(65.8) | 13(31.7) | 1(2.4) | 0.012 |
| 白细胞偏高 | 33(54.1) | 28(45.8) | - | |
| 动脉瘤部位 | ||||
| 前交通动脉 | 25(67.5) | 12(32.4) | - | 0.005 |
| 后交通动脉 | 25(61.7) | 12(28.2) | 1(2.6) | 0.003 |
| 大脑中动脉 | 8(47.1) | 9(52.9) | - | 0.273 |
| 其他部位b | 2(18.2) | 9(81.9) | - | - |
| PCO2 | ||||
| PCO2偏低 | 54(58.7) | 37(40.2) | 1(1.1) | 0.140 |
| PCO2正常 | 5(55.6) | 4(44.4) | - | 0.187 |
| PCO2偏高 | 1(25.0) | 3(75.0) | - | - |
| 脑室或脑实质出血 | ||||
| 二者均无 | 32(60.4) | 21(39.6) | - | 0.028 |
| 仅有其一 | 24(66.7) | 11(28.2) | 1(2.8) | 0.091 |
| 二者均有 | 4(28.6) | 10(71.4) | - | - |
| Hunt-hess分级 | ||||
| Ⅰ级 | 2(100.0) | - | - | 0.007 |
| Ⅱ级 | 18(64.3) | 10(35.7) | - | 0.144 |
| Ⅲ级 | 33(58.9) | 22(39.3) | 1(1.8) | 0.334 |
| Ⅳ级 | 5(35.7) | 9(64.3) | - | 0.564 |
| Ⅴ级 | - | 1(1.0) | - | - |
| 住院时间 | ||||
| 15天及以下 | 10(62.5) | 5(31.3) | 1(6.3) | - |
| 16~30天 | 44(69.8) | 19(30.2) | - | - |
| 31~60天 | 10(52.6) | 9(47.4) | - | - |
| 60天以上 | 2(40.0) | 3(60.0) | - | - |
| 注:其他民族a:苗族、白族等;其他部位b:如颈内动脉、眼动脉、椎动脉、小脑后下动脉等 | ||||
见表 2。
| 参数 | B | 标准误 | Wald | Df | P值 | OR值 | 95% C.I. for Exp(B) | |
| 下限 | 上限 | |||||||
| 血钾水平(mmol/L) | ||||||||
| 3.5~5.5 | -2.925 | 0.6654 | 19.321 | 1 | 0.000 | 0.054 | 0.015 | 0.198 |
| 0~2.9 | -5.982 | 1.5622 | 14.662 | 1 | 0.000 | 0.003 | 0 | 0.054 |
| 2.9~3.1 | -3.543 | 0.978 | 13.125 | 1 | 0.000 | 0.029 | 0.004 | 0.197 |
| 3.1~3.3 | -1.947 | 0.8118 | 5.753 | 1 | 0.016 | 0.143 | 0.029 | 0.7 |
| 3.3~3.5 | 0a | . | . | . | . | 1 | . | . |
| 趋势检验 | 0.013 | |||||||
| Hunt-hess分级 | ||||||||
| Ⅰ级 | -6.407 | 2.2668 | 7.99 | 1 | 0.005 | 0.002 | 1.94E-05 | 0.14 |
| Ⅱ级 | -4.068 | 1.7537 | 5.381 | 1 | 0.020 | 0.017 | 0.001 | 0.532 |
| Ⅲ级 | -3.589 | 1.7407 | 4.252 | 1 | 0.039 | 0.028 | 0.001 | 0.837 |
| 动脉瘤部位 | ||||||||
| 前交通动脉 | -1.776 | 0.7432 | 5.714 | 1 | 0.017 | 0.169 | 0.039 | 0.726 |
| 后交通动脉 | -2.666 | 0.7687 | 12.034 | 1 | 0.001 | 0.069 | 0.015 | 0.314 |
| 白细胞计数 | ||||||||
| 白细胞偏低 | -1.564 | 1.7828 | 0.77 | 1 | 0.380 | 0.209 | 0.006 | 6.89 |
| 白细胞正常 | -1.488 | 0.4588 | 10.517 | 1 | 0.001 | 0.226 | 0.092 | 0.555 |
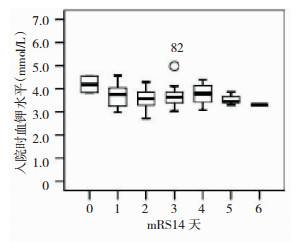
|
| 图 1 mRS14天各组间血钾的分布情况 |
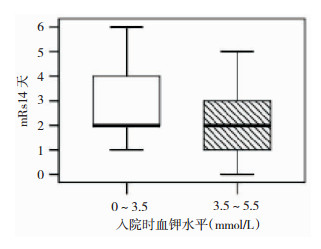
|
| 图 2 血钾水平各组间mRS14天的分布情况 |
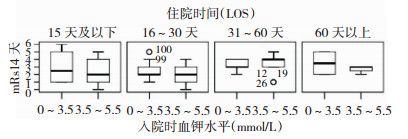
|
| 图 3 4组LOS中血钾水平的分布情况 |
电解质失衡被认为是动脉瘤性蛛网膜下腔出血后不良预后的主要非神经源因素[7, 8],很多学者认为血钠平衡失调是该病最常见的电解质紊乱,并且可以导致LOS的延迟以及影响预后[7, 9-12]。2016年,Chen等[4]根据对113名患者的回顾性研究提出低钾血症可能才是蛛网膜下腔出血患者中最常见的电解质失衡,这一观点得到许多研究支持[13, 14]。
由表 1可得低血钾出现的概率约为38%,且在短期预后不良组中低血钾发生率为68%,较预后良好组中的54%明显增加;动脉瘤位于前、后交通动脉上的预后不良发病率明显低于位于大脑中动脉及其他动脉,Sharma等人[15]发现后交通部位动脉瘤是影响aSAH预后不良的因素之一;脑室或脑实质内出血的严重程度是短期预后不良的危险因素,作为Fisher分级的划分指标之一,已被证实为该病预后不良的独立危险因素[16]。经过多因素有序回归的分析(表 2):血钾水平、Hunt-hess分级、动脉瘤部位、白细胞计数是影响动脉瘤性蛛网膜下腔出血短期预后不良的危险因素。Vellimana等人[13]证明在SAH后血钾水平的变化会影响预后,与本次结果一致;血钾水平为3.1~3.3mmol/L,0~2.9mmol/L,2.9~3.1mmol/L,3.5~5.5mmol/L, P值均 < 0.001,且相关系数为负数,表示血钾水平与预后成负相关,趋势P值< 0.05,说明血钾水平越低,短期预后不良的风险越高;Zhao等[14]对血管内治疗术前低级别aSAH患者的预后分析中提到术前Hunt-Hess分级对预后有统计学意义(P < 0.0 001);后交通部位动脉瘤被广泛认为是影响aSAH预后不良的危险因素之一[15, 16]。通过箱线图(图 1~3)分析:各个短期预后组的血钾随着评分的增高呈下降趋势,低血钾组总体预后较正常血钾组更差;在LOS的分组中,每组低血钾及正常血钾患者在短期预后评分的范围,低血钾组在短期预后较正常血钾组更差,具体表现在LOS为15天及以下、16~30天、60天以上组内低钾组的中位预后评分均大于或等于正常血钾组,30~60天考虑样本量较少,体现不明显。有研究证明脑出血的并发症的确可能造成LOS的延长[17]。
血钾影响短期预后可能的机制为:(1)Na+ -K+ -ATP酶:人体中98%左右的K+存在于细胞内,尽管细胞外K+的分布仅有2%,但仍对内环境有着重要的作用,SAH后产生的某类激素,比如儿茶酚胺(包括肾上腺素和去甲肾上腺素)刺激β受体及细胞膜上的Na+ -K+ -ATP酶,导致细胞外液中血钾离子向内迁移,引起低钾血症[18-20],Deryagin等人[21]在对大鼠进行缺血前预处理时,线粒体三磷酸腺苷敏感性钾通道(mito KATP)早期可引发脑保护机制,随疾病演变,最终会造成线粒体障碍和ATP的耗竭,从而导致细胞毒性水肿,造成短期预后不良;(2)皮质扩散去极化(cortical spreading depolarization, CSD):是离子稳态的传播损失和电活动在皮质的抑制[22]。Bosche [23]提出SAH造成的脑损伤与CSD引起的氧供应紊乱有关,并支持血钾水平是影响该过程的主要原因。Kramer等人[22]通过实验发现血钾变化是皮质扩散去极化的发病原因,且aSAH的微环境变化造成大脑的早期损害[24]。(3)其他并发症:持续的去极化可以引起离子稳态的破坏和细胞毒性水肿[25, 26];同时血钾变化、皮质扩散去极化还可导致延迟性脑缺血(delay cerebral ischemia, DCI)的发生[27];SAH后的QT间期延长常为严重室性心律失常发生的前兆,而低钾血症被证明是SAH患者发生心电图异常的独立危险因素[28, 29]。
综上所述,低血钾是影响aSAH患者短期预后的危险因素,且血钾可能通过某种机制导致mRS评分升高,预后不良的风险增加,LOS延长。其他影响预后的危险因素还有Hunt-hess分级为Ⅰ级、Ⅱ级、Ⅲ级,动脉瘤位于前交通动脉与后交通动脉,白细胞计数正常。因本研究纳入病例较少、单中心分析易出现偏倚、其他原因造成一过性低血钾、仅收集入院时血钾水平而非规律监测等均可影响结果。目前研究血钾水平与动脉瘤性蛛网膜下腔出血预后之间关系文章较少,尚需多中心、大样本的研究支撑。
| [1] |
黄海清, 杨鹏飞. 中国动脉瘤性蛛网膜下腔出血诊疗指导规范[J]. 中国脑血管病杂志, 2016, 13(7): 384-392. DOI:10.3969/j.issn.1672-5921.2016.07.012 |
| [2] |
van Gijn J, Kerr RS, Rinkel GJ. Subarachnoid haemorrhage[J]. The Lancet, 2007, 369(9558): 306-318. DOI:10.1016/S0140-6736(07)60153-6 |
| [3] |
Macdonald RL. Delayed neurological deterioration after subarachnoid haemorrhage[J]. Nat Rev Neurol, 2014, 10(1): 44-58. |
| [4] |
Chen I, Mitchell P. Serum potassium and sodium levels after subarachnoid haemorrhage[J]. Br J Neurosurg, 2016, 30(5): 554-559. DOI:10.1080/02688697.2016.1181151 |
| [5] |
张世文. 急性缺血性脑卒中患者血白细胞计数对短期预后的预测价值[J]. 中国医学创新, 2017, 14(24): 117-120. DOI:10.3969/j.issn.1674-4985.2017.24.035 |
| [6] |
许汝福. Logistic回归变量筛选及回归方法选择实例分析[J]. 中国循证医学杂志, 2016, 16(11): 1360-1364. DOI:10.7507/1672-2531.20160205 |
| [7] |
Alimohamadi M, Saghafinia M, Alikhani F, et al. Impact of electrolyte imbalances on the outcome of aneurysmal subarachnoid hemorrhage:A prospective study[J]. Asian J Neurosurg, 2016, 11(1): 29-33. DOI:10.4103/1793-5482.154978 |
| [8] |
Na MK, Won YD, Kim CH, et al. Early variations of laboratory parameters predicting shunt-dependent hydrocephalus after subarachnoid hemorrhage[J]. PLoS One, 2017, 12(12): e0189499. DOI:10.1371/journal.pone.0189499 |
| [9] |
Sherlock M, O'Sullivan E, Agha A, et al. The incidence and pathophysiology of hyponatraemia after subarachnoid haemorrhage[J]. Clin Endocrinol (Oxf), 2006, 64(3): 250-254. DOI:10.1111/j.1365-2265.2006.02432.x |
| [10] |
Fisher LA, Ko N, Miss J, et al. Hypernatremia predicts adverse cardiovascular and neurological outcomes after SAH[J]. Neurocrit Care, 2006, 5(3): 180-185. DOI:10.1385/NCC:5:3:180 |
| [11] |
Beseoglu K, Etminan N, Steiger HJ, et al. The relation of early hypernatremia with clinical outcome in patients suffering from aneurysmal subarachnoid hemorrhage[J]. Clin Neurol Neurosurg, 2014, 123: 164-168. DOI:10.1016/j.clineuro.2014.05.022 |
| [12] |
高志强. 低钠血症与继发于动脉瘤性蛛网膜下腔出血的脑缺血有关[J]. 国外医学神经病学神经外科学分册, 1991, 18(2): 104-105. |
| [13] |
Vellimana AK. Potential implications of HCN channel dysfunction after subarachnoid hemorrhage[J]. J Neurosci, 2012, 32(27): 9117-9118. DOI:10.1523/JNEUROSCI.2064-12.2012 |
| [14] |
Zhao B, Yang H, Zheng K, et al. Preoperative and postoperative predictors of long-term outcome after endovascular treatment of poor-grade aneurysmal subarachnoid hemorrhage[J]. J Neurosurg, 2017, 126(6): 1764-1771. |
| [15] |
Sharma P, Mehrotra A, Das KK, et al. Factors Predicting Poor Outcome in a Surgically Managed Series of Multiple Intracranial Aneurysms[J]. World Neurosurg, 2016, 90: 29-37. DOI:10.1016/j.wneu.2016.02.058 |
| [16] |
Zhang F, Li P, Zhang C, et al. The Prognosis Factors for Endovascular Coiling of Aneurysm in Patients With Ruptured Intracranial Aneurysm[J]. J Craniofac Surg, 2017, 28(6): e535-e539. DOI:10.1097/SCS.0000000000003818 |
| [17] |
Naidech AM, Bendok BR, Tamul P, et al. Medical complications drive length of stay after brain hemorrhage:a cohort study[J]. Neurocrit Care, 2009, 10(1): 11-19. DOI:10.1007/s12028-008-9148-x |
| [18] |
Brown MJ, Brown DC, Murphy MB. Hypokalemia from beta2-receptor stimulation by circulating epinephrine[J]. N Engl J Med, 1983, 309(23): 1414-1419. DOI:10.1056/NEJM198312083092303 |
| [19] |
Kuroda Y. Neurocritical care update[J]. J Intensive Care, 2016, 4: 36. DOI:10.1186/s40560-016-0141-8 |
| [20] |
Nyberg C, Karlsson T, Hillered L, et al. The Early Endocrine Stress Response in Experimental Subarachnoid Hemorrhage[J]. PLoS One, 2016, 11(3): e0151-457. |
| [21] |
Deryagin OG, Gavrilova SA, Gainutdinov KL, et al. Molecular Bases of Brain Preconditioning[J]. Front Neurosci, 2017, 11: 427. DOI:10.3389/fnins.2017.00427 |
| [22] |
Kramer DR, Fujii T, Ohiorhenuan I, et al. Cortical spreading depolarization:Pathophysiology, implications, and future directions[J]. J Clin Neurosci, 2016, 24: 22-27. DOI:10.1016/j.jocn.2015.08.004 |
| [23] |
Bosche B, Graf R, Ernestus RI, et al. Recurrent spreading depolarizations after subarachnoid hemorrhage decreases oxygen availability in human cerebral cortex[J]. Ann Neurol, 2010, 67(5): 607-617. DOI:10.1002/ana.21943 |
| [24] |
Hertelendy P, Varga DP, Menyhárt Á, et al. Susceptibility of the cerebral cortex to spreading depolarization in neurological disease states:The impact of aging[J]. Neurochem Int, 2019, 127: 125-136. DOI:10.1016/j.neuint.2018.10.010 |
| [25] |
Hartings JA, Shuttleworth CW, Kirov SA, et al. The continuum of spreading depolarizations in acute cortical lesion development:Examining Leao's legacy[J]. J Cereb Blood Flow Metab, 2017, 37(5): 1571-1594. DOI:10.1177/0271678X16654495 |
| [26] |
邹长林, 李明昌. 炎症在蛛网膜下腔出血中的作用及机制研究进展[J]. 国际神经病学神经外科学杂志, 2017, 44(1): 83-86. |
| [27] |
Petzold GC, Haack S, von Bohlen Und Halbach O, et al. Nitric oxide modulates spreading depolarization threshold in the human and rodent cortex[J]. Stroke, 2008, 39(4): 1292-1299. DOI:10.1161/STROKEAHA.107.500710 |
| [28] |
Fukui S, Katoh H, Tsuzuki N, et al. Multivariate analysis of risk factors for QT prolongation following subarachnoid hemorrhage[J]. Crit Care, 2003, 7(3): R7-R12. DOI:10.1186/cc2160 |
| [29] |
Katsanos AH, Korantzopoulos P, Tsivgoulis G, et al. Electrocardiographic abnormalities and cardiac arrhythmias in structural brain lesions[J]. Int J Cardiol, 2013, 167(2): 328-334. DOI:10.1016/j.ijcard.2012.06.107 |
 2019, Vol. 46
2019, Vol. 46




