扩展功能
文章信息
- 李宣朋, 丁鹏, 王波, 牟临杰, 施春福, 李玉
- LI Xuan-Peng, DING Peng, WANG Bo, MU Lin-Jie, SHI Chun-Fu, LI Yu
- CXCR4在胶质瘤细胞中的表达及对迁移的影响
- CXCR4 expression in glioma cells and its effect on migration
- 国际神经病学神经外科学杂志, 2019, 46(4): 406-410
- Journal of International Neurology and Neurosurgery, 2019, 46(4): 406-410
-
文章历史
收稿日期: 2019-04-11
修回日期: 2019-07-22
2. 昆明医科大学第一附属医院神经外一科, 云南省昆明市 650032
2. Department of Neurosurgery, First Affiliated Hospital of Kunming Medical College, Kun'ming, Yunnan 650032, China
胶质瘤是中枢系统最常见的肿瘤[1]。据报道[2, 3],即使通过综合治疗,胶质瘤平均生存期也只有17个月。刘志强等[4]研究指出,胶质瘤1年、2年、3年、4年生存率仅为56.5%、35.9%、30.4%、25.4%。它的侵袭、散播等特性导致治疗后复发,是其预后差的主要原因[5]。CXCR4是胶质瘤细胞侵袭迁移的一个重要因素[6, 7]。
基于CXCR4与恶性行为的关系,我们首先应用免疫荧光法检测CXCR4在胶质瘤细胞U251的表达,再利用流式细胞术检测CXCR4在不同级别胶质瘤中的表达差异。应用琼脂糖下细胞迁移试验(under-agarose cell migration assay)观察并描述了CXCL12对U251的定向迁移作用。该方法具有价格低廉,易于模型建立及操作等优点。
1 材料与方法 1.1 材料U251细胞由昆明医学院第三附属医院肿瘤研究所惠赠,见表 1。
| 试剂 | 来源 |
| DMEM/F12 | 赛默飞世尔生物化学制品有限公司 |
| 趋化因子 SDF-1 |
Sigma |
| CXCR4抗体 Anti-CD184/CXC-R4 |
博奥森 |
| 二抗羊抗兔 Ig/Tritc |
中衫金桥 |
| 琼脂糖 | 基因科技(上海)股份有限公司 |
| 培养皿 | 康宁公司 |
U251细胞复苏与培养:液氮中取出U251细胞冻存管,接种于培养瓶中,加培养液,放入培养箱,换液。胰酶消化传代。
U251表达趋化因子受体CXCR4免疫荧光检测:U251细胞多聚甲醛固定,山羊封闭血清,加入兔抗CXCR4多克隆抗体(1 : 200),阴性对照以PBS液代替一抗,加入tritc标记的羊抗兔二抗(1 : 100)入37℃恒温培养箱中30 min,荧光显微镜下观察拍照。
趋化实验:①琼脂糖混合平皿板的制备:琼脂糖与去离子水制成琼脂糖悬液(浓度为4.8%(W/V))。悬液与培养基1 : 1混合,5 ml倒入直径35 mm培养皿,琼脂糖板厚度为5.04 mm。室温冷却后置于4℃ 30 min后打孔,孔径3.0 mm,间隔2.0 mm。②加液:中排孔滴入10μl含105/ml细胞的培养基;上排孔即实验组加入CXCL12,按100ng/ml、200ng/ml、300ng/ml、400ng/ml、500ng/ml浓度配制,逐孔滴入;下排孔即空白组加入PBS液。放入湿盒,37℃恒温细胞培养箱过夜。第二天荧光显微镜下观察拍照(×200)。测量细胞迁移距离:从细胞孔孔边到迁移最远的两个细胞间的距离。向上孔迁移距离为A,向下为B。趋化系数(chemotaxis coefficient CC)为A/B。
1.3 主要观察指标① CXCR4受体体内外表达情况;②荧光显微镜下观察拍照不同浓度下细胞迁移情况,测量细胞迁移距离;③统计迁移距离,计算趋化系数CC。
1.4 统计学处理所得细胞迁移值以x±s表示,应用SPSS 17.0软件包对细胞迁移距离进行方差分析。P < 0.05,结果有统计学意义。
2 结果 2.1 光镜下U251细胞倒置显微镜下可见U251细胞贴壁生长,呈梭形或多形性,典型细胞发出“突触”,见图 1。

|
| 图 1 U251细胞(×200) |
CXCR4主要表达于U251细胞的胞膜,见图 2。空白对照未见阳性着色。

|
| 图 2 免疫荧光检测CXCR4在U251细胞表达(×200) |
术中取胶质瘤标本,定级后FCM测定CXCR4的表达率。FCM检测结果显示,CXCR4表达率随肿瘤级别升高而增加(图 3)。统计数据结果显示Ⅰ、Ⅱ、Ⅲ及Ⅳ级胶质瘤细胞上CXCR4表达比较均有统计学意义(P<0.05),Ⅳ级表达最高,Ⅰ级表达最低(表 2)。

|
| A:Ⅰ级胶质瘤CXCR4阳性率;B: Ⅱ级胶质瘤CXCR4阳性率;C: Ⅲ级胶质瘤CXCR4阳性率;D:Ⅳ级胶质瘤CXCR4阳性率 图 3 不同级别胶质瘤CXCR4阳性率 |
细胞培养箱过夜后,空白组无明显的细胞迁移现象。实验组,浓度为100~500ng/ml时,随趋化因子浓度升高,细胞迁移数及距离增加。肿瘤细胞迁移时,细胞形态发生变化,细胞以变形虫样在近似圆形的形态下发生运动。箭头所指为大量细胞聚集在孔边。(图 4)

|
| a:50 ng/ml;b:100 ng/ml;c:200 ng/ml;d:300 ng/ml;e:400 ng/ml;f:500 ng/ml。二脒基苯基吲哚(diamidino-phenyl-indole, DAPI)染色细胞迁移免疫荧光图像(×200) 图 4 不同趋化因子浓度下,细胞趋化迁移现象 |
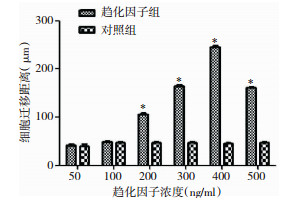
荧光镜下测定细胞迁移距离(表 3)。从细胞孔边到迁移细胞间(>2个细胞)的距离。经统计学分析,与空白组及组间对比,趋化因子浓度为200ng/ml~500ng/ml(P < 0.05)时,细胞迁移距离与其它孔相比有明显统计学差异,这几个浓度的因子有明显的趋化迁移作用(图 5)。500ng/ml时细胞迁移距离减小。
| 因子浓度 (ng/ml) |
100 | 200 | 300 | 400 | 500 |
| 迁移距离 (μm) |
49±2.26 | 105.6±3.82 | 165.3±3.89 | 245.4±5.94 | 161.45±3.18 |
|
| 统计结果:*P < 0.05与对照组及组间相比 图 5 不同因子浓度的细胞迁移距离 |
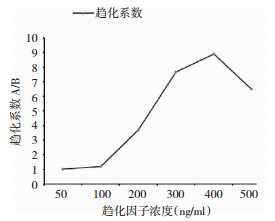
为排除非趋化因素还计算了趋化系数(CC):向上孔迁移距离为A,向下孔迁移距离为B,A/B。从趋化系数趋势图(图 6)可以看出400ng/ml的因子浓度对U251细胞迁移能力最强,之后减弱。
|
| 图 6 不同趋化因子浓度的细胞趋化系数 |
CXCR4表达于多种细胞,如淋巴细胞、内皮细胞及造血干细胞等,并参与免疫反应及生殖细胞形成等[8]。有研究通过mRNA水平的检测,描述了CXCR4在胶质瘤上的表达[9]。阻断CXCR4在胶质瘤中的表达,可明显抑制肿瘤的发展及侵袭[10, 11, 12]。表明CXCR4在胶质瘤治疗中的重要意义。例如将CXCR4作为治疗胶质瘤或其他癌症的靶向目标[13, 14]。
本次研究,我们利用免疫荧光法检测了CXCR4在人胶质瘤细胞U251的表达(图 2)。通过流式细胞术,检测了CXCR4在不同级别胶质瘤中的表达情况。另外,我们进一步指出CXCR4高表达于高级别胶质瘤。
趋化迁移是细胞的一种基本行为。CXCR4在器官发生、血管生成等生理过程以及肿瘤转移等病理过程中尤为重要[15]。表达CXCR4的细胞可被CXCL12吸引发生定向迁移[16, 17, 18]。有学者发现,分泌CXCL12的胶质瘤细胞可诱导表达CXCR4的间充值干细胞(mesenchymal stem cells,MSCs)迁移,并在体内引起肿瘤发展[19]。CXCL12/CXCR4生物轴在肿瘤的增殖、血管生成、转移等几个关键步骤中发挥重要作用[20, 21, 22]。如果降低CXCR4的转录,便可以抑制胶质瘤细胞的侵袭迁移[23]。我们通过琼脂糖下迁移试验观察了不同浓度下CXCL12的趋化作用(图 4)。实验发现随着因子浓度升高,细胞迁移数量及距离逐渐增加。200ng/ml~500ng/ml因子浓度细胞迁移距离大,与空白组及组间相比有明显统计学差异(P < 0.05)(图 5)。500ng/ml的CXCL12的趋化能力有所下降。根据趋化系数趋势图也可以看到,400ng/ml浓度时,趋化系数最大,此浓度趋化力最强(图 6)。我们根据实验初步推断:因子浓度与趋化作用并不是持续的正相关,当因子浓度达到一定数值(400ng/ml)时,随浓度升高其迁移作用降低。我们的实验结论阐述了趋化因子迁移能力与其浓度的关系,也证实CXCL12/CXCR4生物学轴是诱导胶质瘤细胞迁移的重要因素,为进一步研究CXCL12/CXCR4通路参与胶质瘤体内迁移奠定了基础。许多研究在探索细胞迁移和侵袭能力的方法,以了解癌细胞如何传播。如Transwell(侵袭小室),但Transwell是一种终点分析,只能在试验终点记录迁移,且由于孔大小不一致而存在内置误差[24]。Scratch assays(划痕试验)也是一种研究方法,但存在划痕边缘不规则等缺点[25]。Boyden Chamber(Boyden室法)存在测定难度大、耗时长等缺点[26]。且上述方法都不能直观地表现出细胞运动的方向性及趋化性,不能持续保持趋化因子浓度梯度。这些缺点都对趋化物的化学激活、趋化能力产生影响。在琼脂糖下试验中,可以保持趋化物的浓度梯度。在平面空间上细胞保持其运动方向,也更利于观察者成像和分析[27]。细胞为与环境相容,细胞支架结构发生重新分布,这更接近体内环境[28]。Brazill也指出,由于其简单性和灵活性,琼脂糖下趋化试验对于测量各种不同细胞类型的趋化性是非常适用的[29]。上述都为该试验提供了依据。
通过研究得出以下结论:胶质瘤细胞U251表达CXCR4,胶质瘤的病理级别越高CXCR4的阳性率越高。成功建立了胶质瘤细胞琼脂糖下侵袭模型,为研究肿瘤细胞迁移提供新的方法。CXCL12对胶质瘤有明显的趋化作用,肿瘤细胞顺因子浓度梯度定向迁移。
| [1] |
Gao W, Wang X, Li F, et al. Cho/Cr ratio at MR spectroscopy as a biomarker for cellular proliferation activity and prognosis in glioma:correlation with the expression of minichromosome maintenance protein 2[J]. Acta Radiol, 2019, 60(1): 106-112. DOI:10.1177/0284185118770899 |
| [2] |
Carter TC, Medina-Flores R, Lawler BE. et al. Glioblastoma treatment with temozolomide and bevacizumab and overall survival in a rural tertiary healthcare practice[J]. Biomed Res Int.2018, 2018: 6204676.
|
| [3] |
曹明, 徐培坤. 不同化疗药物及方案对于胶质瘤治疗的影响[J]. 国际神经病学神经外科学杂志, 2019, 46(2): 226-229. |
| [4] |
刘志强, 方薪淇, 宋涛, 等. 92例高级别胶质瘤患者术后生存分析[J]. 国际神经病学神经外科学杂志, 2018, 45(6): 577-581. |
| [5] |
Marra JS, Mendes GP, Yoshinari GH, et al. Survival after radiation therapy for high-grade glioma[J]. Rep Pract Oncol Radiother, 2019, 24(1): 35-40. DOI:10.1016/j.rpor.2018.09.003 |
| [6] |
Richardson PJ. CXCR4 and glioblastoma[J]. Anticancer Agents Med Chem, 2016, 16(1): 59-74. |
| [7] |
Yadav VN, Zamler D, Baker GJ, et al. CXCR4 increases in-vivo glioma perivascular invasion, and reduces radiation induced apoptosis:A genetic knockdown study[J]. Oncotarget, 2016, 7(50): 701-719. |
| [8] |
Nazari A, Khorramdelazad H, Hassanshahi G. Biological/pathological functions of the CXCL12/CXCR4/CXCR7 axes in the pathogenesis of bladder cancer[J]. Int J Clin Oncol, 2018, 23(4): 799. DOI:10.1007/s10147-018-1257-8 |
| [9] |
Flüh C, Hattermann K, Mehdorn HM, et al. Differential expression of CXCR4 and CXCR7 with various stem cell markers in paired human primary and recurrent glioblastomas[J]. Int J Oncol, 2016, 48(4): 1408-1416. DOI:10.3892/ijo.2016.3354 |
| [10] |
Gagner JP, Sarfraz Y, Ortenzi V, et al. Multifaceted C-X-C Chemokine Receptor 4 Inhibition Interferes with Anti-Vascular Endothelial Growth Factor Therapy-Induced Glioma Dissemination[J]. Am J Pathol, 2017, 187(9): 2080-2094. DOI:10.1016/j.ajpath.2017.04.020 |
| [11] |
Mercurio L, Cecchetti S, Ricci A, et al. Phosphatidylcholine-specific phospholipase C inhibition down-regulates CXCR4 expression and interferes with proliferation, invasion and glycolysis in glioma cells[J]. Plos One, 2017, 12(4): 1-19. |
| [12] |
Yang Q, Wu H, Wang H, et al. N-terminal polypeptide derived from vMIP-Ⅱ exerts its antitumor activity by inhibiting the CXCR4 pathway in human glioma[J]. Int J Oncol, 2017, 50(4): 1160-1174. DOI:10.3892/ijo.2017.3906 |
| [13] |
Dey M, Yu D, Kanojia D, et al. Intranasal Oncolytic Virotherapy with CXCR4-Enhanced Stem Cells Extends Survival in Mouse Model of Glioma[J]. Stem Cell Reports, 2016, 7(3): 471-482. DOI:10.1016/j.stemcr.2016.07.024 |
| [14] |
Li X, Bu W, Meng L, et al. CXCL12/CXCR4 pathway orchestrates CSC-like properties by CAF recruited tumor associated macrophage in OSCC[J]. Exp Cell Res, 2019, 378(2): 131-138. DOI:10.1016/j.yexcr.2019.03.013 |
| [15] |
Coly PM, Perzo N, Le Joncour V, et al. Chemotactic G protein-coupled receptors control cell migration by repressing autophagosome biogenesis[J]. Autophagy, 2016, 12(12): 2344-2362. DOI:10.1080/15548627.2016.1235125 |
| [16] |
Ferretti E, Ponzoni M, Doglioni C, et al. IL-17 superfamily cytokines modulate normal germinal center B cell migration[J]. J Leukoc Biol, 2016, 100(5): 913-918. DOI:10.1189/jlb.1VMR0216-096RR |
| [17] |
Kajikhina K, Tsuneto M, Melchers F. B-Lymphopoiesis in Fetal Liver, Guided by Chemokines[J]. Adv Immunol, 2016, 132: 71-89. DOI:10.1016/bs.ai.2016.07.002 |
| [18] |
Arnò B, Grassivaro F, Rossi C, et al. Neural progenitor cells orchestrate microglia migration and positioning into the developing cortex[J]. Nat Commun, 2014, 5(5): 6-11. |
| [19] |
Pavon LF, Sibov TT, de Souza AV, et al. Tropism of mesenchymal stem cell toward CD133+ stem cell of glioblastoma in vitro and promote tumor proliferation in vivo[J]. Stem Cell Res Ther, 2018, 9(1): 310-322. |
| [20] |
Jiang C, Ma S, Hu R, et al. Effect of CXCR4 on apoptosis in osteosarcoma cells via the PI3K/Akt/NF-kappabeta signaling pathway[J]. Cell Physiol Biochem, 2018, 46(6): 2250-2260. DOI:10.1159/000489593 |
| [21] |
Choi HS, Lee K, Kim MK, et al. DSGOST inhibits tumor growth by blocking VEGF/VEGFR2-activated angiogenesis[J]. Oncotarget, 2016, 21(6): 21775-21785. |
| [22] |
Fontanella R, Pelagalli A, Nardelli A, et al. A novel antagonist of CXCR4 prevents bone marrow-derived mesenchymal stem cell-mediated osteosarcoma and hepatocellular carcinoma cell migration and invasion[J]. Cancer Lett, 2016, 370(1): 100-107. DOI:10.1016/j.canlet.2015.10.018 |
| [23] |
Liu Y, Wei SZ, Zou Q, et al. Stachydrine suppresses viability & migration of astrocytoma cells via CXCR4/ERK & CXCR4/Akt pathway activity[J]. Future Oncol, 2018, 14(15): 1443-1459. DOI:10.2217/fon-2017-0562 |
| [24] |
Zhang CT, Barrios MP, Alani RM, et al. A microfluidic Transwell to study chemotaxis[J]. Exp Cell Res, 2016, 342(2): 159-165. DOI:10.1016/j.yexcr.2016.03.010 |
| [25] |
Bobadilla AVP, Arévalo J, Sarró E, et al. In vitro cell migration quantification method for scratch assays[J]. J R Soc Interface, 2019, 16(51): 20180709. |
| [26] |
Guy JB, Espenel S, Vallard A, et al. Evaluation of the Cell Invasion and Migration Process:A Comparison of the Video Microscope-based Scratch Wound Assay and the Boyden Chamber Assay[J]. J Vis Exp, 2017, 129: 1-7. |
| [27] |
Bell GRR, Natwick DE, Collins SR. Parallel High-Resolution Imaging of Leukocyte Chemotaxis Under Agarose with Rho-Family GTPase Biosensors[J]. Methods Mol Biol, 2018, 1821: 71-85. |
| [28] |
Wiggins H, Rappoport J. An agarose spot assay for chemotactic invasion[J]. Biotechniques, 2010, 48(2): 121-124. DOI:10.2144/000113353 |
| [29] |
Brazill D. Chemotaxis:Under Agarose Assay[J]. Methods Mol Biol, 2016, 1365: 339-346. |
 2019, Vol. 46
2019, Vol. 46




