扩展功能
文章信息
- 田径, 罗晓光
- TIAN Jing, LUO Xiao-Guang
- 左旋多巴治疗帕金森病发生剂末现象的相关因素
- Related factors for levodopa-related wearing-off in Parkinson's disease
- 国际神经病学神经外科学杂志, 2019, 46(4): 387-390
- Journal of International Neurology and Neurosurgery, 2019, 46(4): 387-390
-
文章历史
收稿日期: 2019-03-18
修回日期: 2019-07-22
2. 暨南大学附属第二医院/深圳市人民医院, 广东省深圳市 518020
2. Department of Parkinson's disease and Dyskinesia disease, People's Hospital of Shenzhen Affiliated to Jinan University, Shenzhen, Guangdong 518020, China
左旋多巴(levodopa, LD)是目前治疗帕金森病(Parkinson disease, PD)最有效的药物。然而长期应用LD治疗会出现运动并发症,剂末现象(wearing-off, WO)可能是运动并发症发生的标志[1],它的定义是一种通常可以预见的运动并发症的再发,通常出现于下次预定给药之前,而且给予抗帕金森药物通常可以改善[2, 3]。剂末现象的病理生理学机制是多因素的,通常归因于黑质多巴胺能神经元变性丢失,导致多巴胺的储存能力丧失[12]。本研究收集使用LD的PD患者,随访终点对每例患者疾病情况评估,筛选出剂末现象发生的危险因素,为临床预防发生剂末现象和治疗方案调整提供更好的依据。
1 对象与方法 1.1 研究对象纳入标准及排除标准收集来自中国医科大学附属第一医院门诊及病房诊断为原发性PD,且使用LD患者63例。入组标准:符合英国脑库PD诊断标准,且服用LD≥6个月。排除标准:帕金森症(如多系统萎缩、进行性核上性麻痹、路易体痴呆、皮质基底神经节变性等)。
1.2 剂末现象的评定对入组患者以WOQ-9项问卷进行WO的评定,即运动症状≥1项在服用抗帕金森药物后可得到改善,评定结果筛选出临床定义的WO阳性(+)32例,WO阴性(-)31例。
1.3 汉密尔顿焦虑评分、Hoehn-Yahr分期、统一帕金森病评分量表第三部分评分汉密尔顿焦虑评分(Hamilton Anxiety Scale, HAMA)能较好的反映焦虑症状的严重程度,按照我国量表协作组提供的资料:以≥14分为界,分为有焦虑和无焦虑。以Hoehn-Yahr分期(H & Y分期)对PD患者病情进展阶段分级,早期为I、II期,中晚期为III-V期。以统一帕金森病评分量表第三部分(Unified Parkinson’s Disease Rating Scale III, UPDRSIII)评分评定患者运动部分严重程度。
1.4 研究方法记录患者的基本临床资料(姓名、年龄、体重、毒药物接触史、教育年限、是否高蛋白饮食、吸烟饮酒史、脑血管病史),疾病情况(起病年龄、病程、随访终点H & Y分期、UPDRSIII评分、HAMA评分),用药情况(LD起始剂量、服药时间、是否存在WO),开始口服LD至出现WO的间隔时间,随访终点为发生WO,未发生WO的患者随访终点截止至2016年1月。
1.5 统计学分析方法本研究采用IBM SPSS 21.0统计软件对数据进行分析。计量资料以均数±标准差(x±s)表示;计数资料以百分比(%)表示。WO(+)和WO(-)两组临床资料的比较应用Mann-Whitney U检验,WO(+)组和WO(-)组组间有差异的变量以多因素logistic回归分析,是否出现WO作为因变量Y,两组间有差异的因素定义为自变量X,筛选出WO发生的独立影响因素。以受试者工作特征曲线(ROC曲线)评估每个自变量预测的敏感度和特异性。以开始口服LD至出现WO间隔时间作为生存时间,通过生存分析比较不同因素发生WO的风险。63例患者中应用左旋多巴制剂基本为美多巴或息宁,左旋多巴换算如下:美多巴=200 mg,息宁=150 mg。以P < 0.05为差异具有统计学意义。
2 结果 2.1 基本资料分析本研究收集的63例患者中,女性32例,男性31例,平均发病年龄60.2岁,平均病程7.2年。如表 1所示,通过对比WO(+)组和WO(-)组基本临床资料,提示性别、年龄、教育年限、体重、毒药物接触史、吸烟史、饮酒史、高蛋白饮食、脑血管病史组间差异无统计学意义(P>0.05)。WO(+)组较WO(-)组发病年龄早、病程长、LD起始剂量高、LD终点剂量高、口服LD时间长H & Y分期较高、UPDRS第III部分评分高、HAMA评分高组间差异有统计学意义(P < 0.05)。
| 因变量 | WO(+)组 | WO(-)组 | 检验方法 | P |
| 年龄(岁) | 66.2±1.5 | 68.8±1.0 | 1 | 0.205 |
| 性别(女) | 17(53.1) | 15(46.9) | 2 | 0.707 |
| 教育年限(年) | 9.2±0.7 | 11.2±0.6 | 1 | 0.105 |
| 体重(kg) | 62.4±2.0 | 59.4±1.3 | 1 | 0.333 |
| 发病年龄(岁) | 57.0±1.7 | 63.7±1.2 | 1 | 0.001 |
| 病程(年) | 9.2±0.7 | 5.2±0.6 | 1 | 0.000 |
| LD起始剂量(mg) | 289.0±25.6 | 217.7±16.8 | 1 | 0.038 |
| LD终点剂量(mg) | 553.1±38.0 | 342.7±24.8 | 1 | 0.000 |
| 口服 LD时间(年) |
7.0±0.6 | 3.2±0.5 | 1 | 0.000 |
| H & Y分期 | 2.9±0.2 | 1.8±0.1 | 1 | 0.000 |
| UPDRSIII(分) | 49.1±4.0 | 23.2±2.7 | 1 | 0.000 |
| HAMA评分(分) | 18.2±1.7 | 9.5±1.2 | 1 | 0.000 |
| 毒药物接触史 | 7(50) | 7(50) | 2 | 0.946 |
| 吸烟史 | 5(50) | 5(50) | 2 | 0.613 |
| 饮酒史 | 4(50) | 4(50) | 2 | 0.628 |
| 脑血管病史 | 3(33.3) | 6(76.7) | 2 | 0.258 |
| 高蛋白饮食 | 7(77.8) | 2(22.2) | 2 | 0.080 |
| 注:1:Mann-Whitney U检验;2:确切概率法Fisher检验 | ||||
将发病年龄、病程、LD起始剂量、LD终点剂量、口服LD时间、H & Y分期、UPDRSIII评分、HAMA评分8个因素在WO(+)组和WO(-)组组间有差异的U检验后具有统计学意义的变量带入多因素logistic回归分析,结果如表 2,提示发病年龄、LD起始剂量、H & Y分期、HAMA评分是发生WO的独立影响因素。
| 变量 | 回归系数 | P | OR | 95%CI |
| 发病年龄 | -2.085 | 0.026 | 0.124 | 0.020~0.775 |
| LD起始剂量 | 3.762 | 0.012 | 43.043 | 2.276~813.969 |
| H & Y分期 | 2.018 | 0.047 | 7.521 | 1.026~55.144 |
| HAMA评分 | 2.146 | 0.024 | 8.548 | 1.324~55.188 |
发生WO的独立影响因素的ROC曲线分析结果:曲线下面积由大到小分别为H & Y分期(80.9%)、焦虑(76.7%)、发病年龄(73.9%)、其中H & Y分期,即疾病的进展阶段,其诊断效能较其他因素高,敏感度为68.8%、特异度为80.9%。见图 1、图 2及表 3。
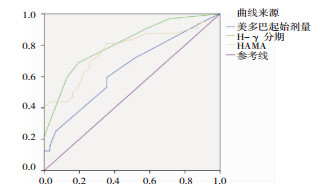
|
| 图 1 LD起始剂量、H & Y分期、HAMA评分的ROC曲线图 |
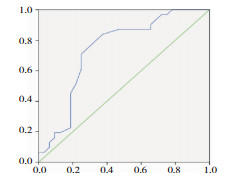
|
| 图 2 发病年龄与剂末现象的ROC曲线图 |
| 因素 | 曲线下面积 | P | 敏感度 | 特异度 | 尤登指数 |
| H & Y分期 | 80.9% | 0.000 | 68.8% | 80.6% | 49.4% |
| 焦虑评分 | 76.7% | 0.000 | 81.3% | 64.5% | 45.8% |
| 发病年龄 | 73.9% | 0.001 | 83.9% | 63.5% | 47.4% |
| LD起始剂量 | 64.7% | 0.045 | 59.4% | 64.5% | 23.9% |
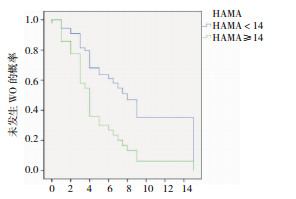
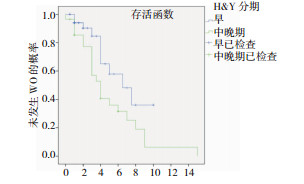
以单因素生存分析得出,随着口服LD时间增长,发生WO的风险增高(图 3)。疾病中晚期PD患者发生WO的风险明显高于早期患者(表 4及图 5)。图 4及表 5表明焦虑组发生WO风险高,但焦虑与WO的因果关系尚不明确,可能是前者影响后者的风险大,也可能是后者影响前者风险大。
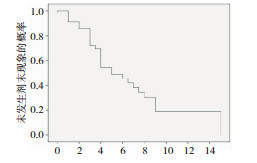
|
| 图 3 随口服LD时间增长,发生WO风险增加 |
|
| 图 4 口服LD时间 |
| 时间 | 状态 | WO的发生率(%) | P(Log Rank) |
| H & Y分期 | |||
| 早期 | 是 | 28.6 | 0.039 |
| 中晚期 | 是 | 78.6 | |
| HAMA | |||
| < 14 | 是 | 30.3 | 0.007 |
| ≥14 | 是 | 73.3 | |
| 口服 LD时间 |
|||
| 1 | 是 | 9.9 | |
| 5 | 是 | 54 | |
| 9 | 是 | 84.3 | |
| 15 | 是 | 100 |
|
| 图 5 口服LD时间 |
左旋多巴作为目前临床治疗帕金森病最有效的药物,其最常见的运动并发症是剂末现象,降低了患者的生活质量,也增加了治疗帕金森病的难度。Benbir等[13]研究结果显示,性别与WO发生无关。本研究结果显示,性别与WO发生无关。然而,Sato等[4]研究结果提示,女性患者的病情进展较男性更快。所以,性别作为WO发生的预测因素结论并不一致。Barichella等[11]和韩明等[14]研究结果显示,PD患者早午餐摄入低蛋白产物(< 10 g蛋白)有助于改善运动并发症。我们的研究结果与上述文献并不一致,由于本研究样本量较小,无法测量患者每日摄入蛋白量,故需要更大规模的多中心的临床试验。Schrag等[5]研究指出,病程是WO发生的预测因素,本研究WO(+)组病程长,但不是WO发生的独立影响及预测因素。Golbe[6]的报告提出发病年龄与WO的发生有关,青年PD患者几乎100%出现。本研究中结果提示WO(+)组发病年龄早,且发病年龄是WO的独立影响因素,其中发病年龄小于50岁的患者WO的发生率为100%,与相关文献报道相似,这提醒我们对于发病年龄较早的PD患者,选择LD治疗时一定要谨慎。Benbir等[13]的研究指出,应用LD治疗5年以内的PD患者WO发生率约26.6%,10年以上约96.8%。Ahlskog和Muenter[15]的研究指出,大约40%使用LD治疗的PD患者在治疗第5年会出现WO。与这些国外的研究报告相似,本研究WO(+)组口服LD的时间长,LD治疗5年WO发生率为54%,9年可达84.3%。许多国外研究[7, 8]同样显示疾病的严重程度与WO的发生密切相关。Sato等[4]研究结果示H & Y分期3期的患者比H-Y分期1~2期组更早出现运动并发症,强调了疾病严重程度是发生WO的危险因素。与相关的报道相似,本研究得出WO(+)组H & Y分期较高,且H & Y分期是发生WO的独立影响因素,早期PD患者发生WO的百分比仅28.6%,中晚期达78.6%,表明随疾病进展,WO发生风险增高。ELLDOPA的[9, 10]一项随机、双盲及安慰剂对照研究结果显示,LD日剂量最高组(600 mg/d)的WO发生率最高,我们的研究得出,WO(+)组LD起始剂量、终点剂量高,较高LD起始剂量是发生WO的独立危险因素,与上述报道相似。本研究以HAMA评分评估焦虑是否为发生WO的独立影响因素,研究结果显示,WO(+)组焦虑HAMA评分较高,且焦虑是WO发生独立影响因素,焦虑组患者发生WO风险高。但焦虑与WO的因果关系尚不明确,可能是前者影响后者的风险大,也可能是后者影响前者的风险大。综上所述,多种因素可影响左旋多巴临床治疗中发生剂末现象。但本研究有些因素的结果与其他研究的结果不一致,可能与本研究样本量小相关,需进一步扩大样本量的研究
| [1] |
Hauser RA, McDermott MP, Messing S. Factors associated with the development of motor fluctuations and dyskinesias in Parkinson disease[J]. Arch Neurol, 2006, 63(12): 1756-1760. DOI:10.1001/archneur.63.12.1756 |
| [2] |
Stacy M, Hauser R, Oertel W, et al. End of dose wearing-off in Parkinson's disease:a 9-question survey assessment[J]. Clin Neuropharmacol, 2006, 29(6): 312-321. DOI:10.1097/01.WNF.0000232277.68501.08 |
| [3] |
龙武, 杨期明, 蒋柏菊, 等. 普拉克索治疗帕金森病运动并发症的临床疗效观察[J]. 国际神经病学神经外科学杂志, 2013, 40(2): 121-122. |
| [4] |
Sato K, Hatano T, Yamashiro K, et al. Prognosis of Parkinson's disease:time to stage Ⅲ, IV, V, and to motor fluctuations[J]. Mov Disord, 2006, 21(9): 1384-1395. DOI:10.1002/mds.20993 |
| [5] |
Schrag A, Quinn N. Dyskinesias and motor fluctuations in Parkinson's disease. A community-based study[J]. Brain, 2000, 123(11): 2297-2305. DOI:10.1093/brain/123.11.2297 |
| [6] |
Golbe LI. Young-onset Parkinson's disease:a clinical review[J]. Neurology, 1991, 41(2, Pt 1): 168-173. DOI:10.1212/WNL.41.2_Part_1.168 |
| [7] |
Warren Olanow C, Kieburtz K, Rascol O, et al. Factors predictive of the development of Levodopa-induced dyskinesia and wearing-off in Parkinson's disease[J]. Mov Disord, 2013, 28(8): 1064-1071. DOI:10.1002/mds.25364 |
| [8] |
Kum WF, Gao J, Durairajan SS, et al. Risk factors in development of motor complications in Chinese patients with idiopathic Parkinson's disease[J]. J Clin Neurosci, 2009, 16(8): 1034-1037. DOI:10.1016/j.jocn.2008.10.015 |
| [9] |
Fahn S. A new look at levodopa based on the ELLDOPA study[J]. J Neural Transmv, 2006, suppl(70): 419-426. |
| [10] |
Fahn S. Parkinson disease, the effect of levodopa, and the ELLDOPA trial. Earlier vs Later L-DOPA (see comments)[J]. Arch Neurol, 1999, 56(5): 529-535. DOI:10.1001/archneur.56.5.529 |
| [11] |
Barichella M, Marczewska A, De Notaris R, et al. Special Low-Protein Foods Ameliorate Postprandial off in Patients with Advanced Parkinson's Disease[J]. Mov Disord, 2006, 21(10): 1682-1687. DOI:10.1002/mds.21003 |
| [12] |
Stocchi F. The levodopa wearing-off phenomenon in Parkinson's disease:pharmacokinetic considerations[J]. Exp Opin Pharmacother, 2006, 7(10): 1399-1407. DOI:10.1517/14656566.7.10.1399 |
| [13] |
Benbir G, özekmekçi S, Apaydin H, et al. A hospital-based study:risk factors in development of motor complications in 555 Parkinson's patients on levodopa therapy[J]. Clin Neurol Neurosurg, 2006, 108(8): 726-732. DOI:10.1016/j.clineuro.2006.02.002 |
| [14] |
韩明, 刘保群. 低蛋白饮食对帕金森病患者多巴制剂治疗的影响[J]. 临床神经病学杂志, 2010, 25(5): 383. |
| [15] |
Ahlskog JE, Muenter MD. Frequency of levodopa-related dyskinesias and motor fluctuations as estimated from the cumulative literature[J]. Mov Disord, 2001, 16(3): 448-458. DOI:10.1002/mds.1090 |
 2019, Vol. 46
2019, Vol. 46




