扩展功能
文章信息
- 徐晓娅, 郭晓聪, 邱涛, 黄琳明, 李作孝
- XU Xiao-Ya, GUO Xiao-Cong, QIU Tao, HUANG Lin-Ming, LI Zuo-Xiao
- 黏附分子CD44在实验性自身免疫性脑脊髓炎中的作用
- Role of the adhesion molecule CD44 in experimental autoimmune encephalomyelitis
- 国际神经病学神经外科学杂志, 2019, 46(4): 383-386
- Journal of International Neurology and Neurosurgery, 2019, 46(4): 383-386
-
文章历史
收稿日期: 2018-12-12
修回日期: 2019-07-24
2. 四川省自贡市第一人民医院检验科, 四川省自贡市 643000;
3. 泸州医学院附属医院神经内科, 四川省泸州市 646000
多发性硬化(multiple sclerosis, MS)被广泛认为是一累及中枢神经系统(central nervous system, CNS)白质的自身免疫性脱髓鞘性疾病。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)是公认的研究MS的理想动物模型。CD44是一种黏附性糖蛋白,主要参与细胞-细胞、细胞-基质之间的黏附。目前可见很多自身免疫性疾病中CD44表达增加的报道,如系统性红斑狼疮、银屑病、IgA肾病、溃疡性结肠炎、特发性血小板减少性紫癜等[1-5]。研究表明[6],在MS患者中骨桥蛋白(osteopontin, OPN)表达增高,其主要与CD44结合,促进IL-1、IL- 2、IL-12等的表达,抑制IL-4的表达,从而使免疫格局向Th1偏移,促进MS的发生发展,可见OPN是CD44表达的主要调控者。目前关于CD44分子在EAE中表达情况的研究报道较少。本实验通过制造EAE模型,测定正常对照组及EAE组大鼠脑和脊髓组织中CD44的含量,观察黏附分子CD44在EAE中的表达情况及初步探讨在其发病中的可能作用。
1 材料与方法 1.1 实验动物及试剂雄性Wister大鼠20只,6~8周龄,体重200~250 g;豚鼠4只,体重400~450 g,以上动物由西南医科大学实验动物科提供。主要实验试剂:氟氏完全佐剂(购自美国Sigma公司);兔抗大鼠CD44单克隆抗体(购自北京博奥森生物技术有限公司);中性甲醛固定液由病理教研室提供。
1.2 方法 1.2.1 大鼠分组及EAE模型的建立20只雄性大鼠随机分为正常对照组和EAE组,每组10只。将豚鼠处死后,在无菌操作下,迅速剥出脊髓,去掉马尾与脊膜,称重。加入生理盐水研磨成50%匀浆,与等量福氏完全佐剂混合,用注射器反复抽打成油包水乳液,即制得粗制碱性髓鞘蛋白(myelin basic protein, MBP)抗原。将MBP抗原注入EAE组大鼠双后肢足垫皮下,每只0.2 ml/100 g。
1.2.2 神经功能评分及评分标准[7]于建模后第1天开始(建模当天计为第1天),每日同一时段由同一人单盲观察发病情况,进行神经功能评分。0分:无明显异常;1分:后肢不完全瘫痪;2分:后肢完全瘫痪;3分:后肢全瘫伴前肢不全瘫;4分:四肢全瘫或死亡。症状介于两条标准之间者以±0.5分计。
1.2.3 试验终止EAE组连续3 d症状评分无加重或四肢瘫痪、死亡作为EAE发病高峰期,在高峰期处死大鼠;正常对照组4周后处死。
1.2.4 脑和脊髓组织病理观察脑和脊髓组织标本用中性甲醛固定后,在泸州医学院病理教研室作组织切片,常规脱水、透明、浸蜡、石蜡包埋和切片(8 μm厚)。切片后烘干、脱蜡和常规苏木素﹣伊红染色,光镜下观察病理改变。
1.2.5 CD44的测定采用免疫组织化学法检测脑和脊髓组织CD44的表达;操作严格按SP试剂盒提供的说明书进行。
1.2.6 结果判断免疫组化结果用美国Nikon Spot图像采集系统进行图像采集,用Image-Pro Plus Versi-on 5.1图像分析系统分析。包浆呈棕黄色至深棕黄色为CD44阳性染色细胞。每张大鼠脑组织切片于光镜下(×400)观察10个视野,计算CD44平均光密度(A)值。
1.3 统计学方法统计学处理由SPSS 16.0软件完成。所得数据以均数±标准差(x±s)表示,变量间相互关系采用Pearson直线相关分析,P < 0.05为差异有统计学意义。
2 结果 2.1 发病情况正常对照组大鼠未发病。EAE对照组均有不同程度的发病,发病率100%。发病动物表现为脱毛、食欲减退、体重下降显著,出现不同程度的肢体无力、共济失调、瘫痪等,部分动物伴尿便失禁。EAE组发病潜伏期为(11.6±2.5)d,进展期为(7.2±1.4)d,高峰期症状评分为(3.1±1.1)分。
2.2 病理学检查将大鼠的脑和脊髓切片经HE染色后,在光镜下观察显示:正常对照组大鼠脑和脊髓未见异常。EAE对照组大鼠发病高峰期可见脑及脊髓实质内小血管充血,脑组织疏松肿胀,血管周围主要是小静脉周围有大量炎性细胞浸润,主要为淋巴细胞及单核细胞,典型者形成“袖套”状改变,血管周围白质片状脱髓鞘改变。见图 1A、图 1B。
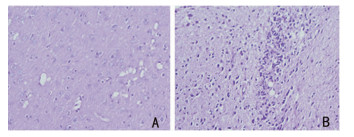
|
| 注:A:正常对照组;B:EAE组 图 1 切片经HE染色后,光镜下所见(HE×400) |
正常对照组大鼠CNS内未发现CD44阳性细胞。EAE对照组大鼠CNS白质及灰白质交界处可见大量CD44阳性细胞,主要分布在神经细胞胞浆,部分间质细胞亦有表达,呈棕黄色颗粒,染色深。CD44高表达部位的炎症表现较重。图像分析结果显示, EAE组CD44平均光密度值为0.28±0.006。见图 2A、图 2B。
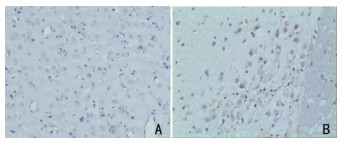
|
| 注:A:正常对照组;B:EAE组 图 2 两组脑组织中CD44表达的情况(×400) |
结果显示:EAE组发病高峰期CD44表达与发病潜伏期呈负相关(P < 0.01);与进展期呈正相关(P < 0.01);与发病高峰期神经功能障碍评分呈正相关(P < 0.01)。见表 1。
| 项目 | R | P |
| 潜伏期 | -0.889 | < 0.01 |
| 进展期 | 0.797 | < 0.01 |
| 神经功能障碍评分 | 0.772 | < 0.01 |
EAE作为一种中枢神经系统自身免疫性脱髓鞘病变模型,是世界公认的研究人类MS的动物模型。较多研究证实,EAE是细胞免疫及体液免疫均参与的错综复杂的病理免疫过程,以细胞免疫为主[8];自身免疫性T细胞从外周迁移CNS可以破坏生理性免疫豁免[9]。CD44分子是细胞表面跨膜蛋白多糖的一个家族,广泛表达于多种细胞上,包括B淋巴细胞、T淋巴细胞、单核巨噬细胞、内皮细胞及成纤维细胞等,主要参与细胞﹣细胞、细胞﹣基质之间的黏附。CD44分子的配体为细胞外基质,主要有透明质酸、层粘连蛋白、纤粘连蛋白和胶原蛋白等多种配体。T细胞上的CD44与其配体结合可促进T细胞的黏附,诱导IL-2产生,增加T细胞的活性;而单核细胞的CD44与配体结合则使IL-1释放增多,促进单核细胞的聚集,从而促进免疫反应。
目前可见多种自身免疫性疾病(如银屑病、系统性红斑狼疮等)CD44表达增加的报道。近年来国外已开始有关CD44在EAE中的研究。Kim等[10]经过对EAE大鼠脊髓进行研究发现,CD44在星形胶质细胞及炎性细胞中表达明显增加,促进EAE的发生发展。Garin等[11]通过向EAE大鼠体内接种CD44的干扰基因,抑制CD44的表达,发现EAE的严重程度明显减轻,其病理结果提示中枢神经系统损害明显减轻,浸润细胞凋亡增加。以上研究提示黏附分子CD44有促进EAE发生发展的作用。但目前CD44分子对EAE的作用机制尚不明确。Clemente等[12]研究发现,骨桥蛋白在EAE的复发中有重要的作用,其分子C端与黏附分子CD44结合,可下调IL-10的表达,抑制淋巴细胞的凋亡,故CD44分子有可能通过骨桥蛋白通路促进EAE复发。Chang等[13]研究表明,CD44、透明质酸及多功能蛋白聚糖等分子可能被白质的星型胶质细胞上调,这些分子形成络合物,抑制少突胶质细胞的成熟和髓鞘的再生,提示CD44可能通过皮层髓鞘再生减少而促进EAE发病。Chitrala等[14]通过将CD44基因敲除的老鼠的排泄物移入CD44野生型的EAE大鼠发现,EAE症状的明显减轻;经对肠道菌群高通量细菌16 S rRNA基因测序,EAE CD44基因敲除大鼠与CD44野生型EAE大鼠比较,显示出显著的多样性、丰富性和均匀性;故其研究结论认为CD44基因缺失的小鼠,可能通过改变肠道微生物群和不饱和短链脂肪酸而导致EAE的缓解,此研究为CD44在EAE中的作用机制提出了全新的观点。Winkler等[15]研究指出,中枢神经系统血管内皮细胞淋巴细胞溢出是炎性脱髓鞘疾病(包括MS及EAE)的关键步骤。葡糖胺聚糖透明质酸(glycosaminoglycan hyaluronan, HA)与其受体脑血管内皮细胞上的CD44分子结合,对于激活T细胞进入中枢神经系统至关重要,这也为CNS炎性脱髓鞘的机制提供了新的见解。上述研究均表明,CD44分子可能通过多种机制在EAE的发病中起着促进作用。
但同时,也有研究得出了相反的结论。Flynn等[16]通过研究却发现,CD44缺乏的EAE小鼠与野生型比较,其临床症状更重、中枢神经系统的免疫细胞数量及细胞因子含量更多,其研究结论认为CD44分子可能通过作用于细胞因子的产生、T细胞的分化,T细胞内皮细胞的相互作用、以及血脑屏障的完整性而发挥对EAE的保护作用。故目前CD44在EAE中的作用尚无一致定论。
本研究结果提示,EAE组大鼠经过一定潜伏期后均出现不同程度的EAE症状,且其神经组织病理切片检查证实存在脱髓鞘改变及炎性细胞浸润,符合EAE病理表现,提示造模成功;采用免疫组化技术对正常对照组、EAE组大鼠脑和脊髓白质组织表达CD44的阳性细胞进行了检测,结果显示正常对照组大鼠脑和脊髓白质组织未发现CD44表达的阳性细胞,EAE对照组大鼠脑和脊髓白质组织可见大量CD44表达的阳性细胞,主要分布在大脑、脑干、脊髓白质及灰白质交界的小血管周围。相关性分析显示,EAE对照组大鼠发病高峰期CD44表达量与EAE发病的潜伏期呈负相关,与进展期和高峰期神经功能障碍评分呈正相关。提示EAE大鼠中枢神经系统存在CD44分子的过度表达,且表达程度与EAE大鼠发生、发展及病情程度密切相关;此研究结果与之前大多数研究(认为CD44对EAE具有发病具有促进作用)相一致。但本研究只是对CD44在EAE中的表达情况进行了初步探索,尚未对其机制进行深入研究。总的来说,目前CD44在EAE中的作用尚无定论,且其机制尚不清楚,值得深入探讨。
| [1] |
Yoo SA, Leng L, Kim BJ, et al. MIF allele-dependent regulation of the MIF coreceptor CD44 and role in rheumatoid arthritis[J]. Proc Natl Acad Sci U.S.A, 2016, 113(49): E7917-E7926. DOI:10.1073/pnas.1612717113 |
| [2] |
Lindqvist U, Phil-Lundin I, Engstr? m-Laurent A. Dermal distribution of hyaluronan in psoriatic arthritis; coexistence of CD44, MMP3 and MMP9[J]. Acta Derm Venereol, 2012, 92(4): 372-377. DOI:10.2340/00015555-1286 |
| [3] |
Kim S, Kim YH, Choi KH, et al. Glomerular epithelial CD44 expression and segmental sclerosis in IgA nephropathy[J]. Clin Exp Nephrol, 2016, 20(6): 871-877. DOI:10.1007/s10157-015-1222-z |
| [4] |
AbdElazeem MA, El-Sayed M. The pattern of CD44 and matrix metalloproteinase 9 expression is a useful predictor of ulcerative colitis-associated dysplasia and neoplasia[J]. Ann Diagn Pathol, 2015, 19(6): 369-374. DOI:10.1016/j.anndiagpath.2015.08.004 |
| [5] |
Crow AR, Amash A, Lazarus AH, et al. CD44 antibody-mediated amelioration of murine immune thrombocytopenia (ITP):mouse background determines the effect of FcγRⅡb genetic disruption[J]. Transfusion, 2015, 55(6 Pt 2): 1492-1500. |
| [6] |
Comabella M, Pericot L, Goertsches R, et al. Plasma osteopontin levels in multiple sclerosis[J]. Neuroimmunol, 2005, 158(1/2): 231-239. |
| [7] |
Drew PD, Chavis JA, B hatt R. Sex steroid regulation of microglial cell activation:relevance to multiple sclerosis[J]. Ann N Y Acad Sci, 2003, 1007(1): 329-334. DOI:10.1196/annals.1286.031 |
| [8] |
Buntinx M, Ameloot M, Steds P, et al. Interferon-gamma-induced calcium influx in T lymphocytes of multiple sclerosis and rheumatoid arthritis patient:a complementary mechanism for T cell activation[J]. J Neuroimmunol, 2002, 124(1-2): 70-82. DOI:10.1016/S0165-5728(01)00495-7 |
| [9] |
彭永, 甘露, 李淑萍, 等. 髓鞘抗原特异性CD8+T细胞在MS/EAE脑组织免疫豁免中作用的研究进展[J]. 国际神经病学神经外科学杂志, 2018, 45(5): 532-535. |
| [10] |
Kim MD, Cho HJ, Shin T, et al. Expression of osteopontin and its ligand, CD44, in the spinal cords of Lewis rats with experimental autoimmune encephalomyelitis[J]. Neuroimmunol, 2004, 151(1-2): 78-84. DOI:10.1016/j.jneuroim.2004.02.014 |
| [11] |
Garin T, Rubinstein A, Grigoriadis N, et al. CD44 variant DNA vaccination with virtual lymph node ameliorates experimental autoimmune encephalomyelitis through the induction of apoptosis[J]. Neurol Sci, 2007, 258(1-2): 17-26. DOI:10.1016/j.jns.2007.01.079 |
| [12] |
Clemente N, Comi C, Raineri D, et al. Role of Anti-Osteopontin Antibodies in Multiple Sclerosis and Experimental Autoimmune Encephalomyelitis[J]. Front Immunol, 2017, 8(1): 321. |
| [13] |
Chang A, Staugaitis SM, Dutta R, et al. Cortical remyelination:a new target for repair therapies in multiple sclerosis[J]. Ann Neurol, 2012, 72(6): 918-926. DOI:10.1002/ana.23693 |
| [14] |
Chitrala KN, Guan H, Singh NP, et al. CD44 deletion leading to attenuation of experimental autoimmune encephalomyelitis results from alterations in gut microbiome in mice[J]. Eur J Immunol, 2017, 47(7): 1188-1199. DOI:10.1002/eji.201646792 |
| [15] |
Winkler CW, Foster SC, Matsumoto SG, et al. Hyaluronan anchored to activated CD44 on central nervous system vascular endothelial cells promotes lymphocyte extravasation in experimental autoimmune encephalomyelitis[J]. J Biol Chem, 2012, 287(40): 33237-33251. DOI:10.1074/jbc.M112.356287 |
| [16] |
Flynn KM, Michaud M, Madri JA, et al. CD44 deficiency contributes to enhanced experimental autoimmune encephalomyelitis:a role in immune cells and vascular cells of the blood-brain barrier[J]. Am J Pathol, 2013, 182(4): 1322-1336. DOI:10.1016/j.ajpath.2013.01.003 |
 2019, Vol. 46
2019, Vol. 46




