扩展功能
文章信息
- 朱勇, 卢军, 王琴, 周彬, 夏帅帅, 黄惠勇, 杨萍
- ZHU Yong, LU Jun, WANG Qin, ZHOU Bin, XIA Shuai-Shuai, HUANG Hui-Yong, YANG Ping
- 氟西汀对癫痫合并抑郁大鼠模型海马自噬的作用
- Effect of fluoxetine on autophagy in the hippocampus of rats with epilepsy accompanied by depression
- 国际神经病学神经外科学杂志, 2019, 46(4): 378-382
- Journal of International Neurology and Neurosurgery, 2019, 46(4): 378-382
-
文章历史
收稿日期: 2019-02-19
修回日期: 2019-07-23
2. 湖南中医药大学中医诊断学湖南省重点实验室, 湖南省长沙市 410208
癫痫患者在全球约有6.5千万[1]。据统计,我国癫痫患者数量已超过900万,并呈逐年上升的趋势[2]。癫痫合并抑郁是常见的神经精神疾病现象,发生率高达23.1%[3],且症状难以缓解。其发病机制不明确,治疗效果不佳,自杀风险高[4]。我们前期发现5-羟色胺(5-hydroxytryptamine, 5-HT)激动剂可通过改善癫痫合并抑郁大鼠海马神经再生障碍[5]。有文献报道,海马神经再生可能与细胞自噬相关[6]。细胞自噬是机体降解其过多或衰老的器官或蛋白的重要途径。哺乳动物雷帕霉素靶蛋白(mammalian traget of rapamycin, mTOR)是调控蛋白质翻译起始阶段的一种蛋白激酶。在体内可磷酸化S6K1、4EBP1等多种底物蛋白,影响细胞自噬、神经递质受体、离子通道表达等,发展为癫痫[7]。氟西汀属于5-羟色胺再摄取抑制剂类抗抑郁药,广泛用于焦虑症、抑郁障碍、强迫症等疾病[8],近年来已被用于癫痫合并抑郁的治疗[9]。但有关起效机制探讨甚少,有文献报告,氟西汀能通过调节5-HT2A受体表达改善慢性不可预知性应激大鼠自噬水平[10]。那么氟西汀是否可以通过调节自噬改善癫痫合并抑郁症状?
因此,我们采用癫痫合并抑郁模型来研究氟西汀对大鼠行为及海马齿状回beclin1、LC3I、mToR表达水平的影响,以期阐明氟西汀调节癫痫合并抑郁自噬机制。
1 材料与方法 1.1 实验动物成年雄性健康清洁级SD大鼠60只,重量为180~220 g,由湖南中医药大学实验动物中心提供(许可证编号:SYXK[湘]2016-0002),饲养环境温度22~25 ℃,相对湿度50%~70%,自由饮食进水,分笼喂养。随机选取12只为正常对照组,其余48只建立癫痫合并抑郁模型。
1.2 主要试剂及仪器匹罗卡品(ABCR公司,ab141301);氯化锂(sigma公司,1001011078);3-甲基腺嘌呤(3-methyladenine, 3-MA;sigma公司,M9281);盐酸氟西汀(苏州礼来制药有限公司,201608072);兔抗鼠beclin1(abcam公司,ab62557);兔抗鼠LC3-I (abcam公司,ab48394);兔抗鼠mToR(abcam公司,ab2732)。BX43型双目生物摄像显微镜(日本OLYMPUS);荧光定量PCR仪(美国BioRad公司)。
1.3 方法 1.3.1 建立癫痫合并抑郁模型 1.3.1.1 建立癫痫模型参照文献[11]腹腔注射氯化锂3 mEq/kg,18 h后再给予匹罗卡品35 mg/kg,在注射匹罗卡品前30 min注射阿托品1 mg/kg,以拮抗外周胆碱能作用,若30 min内无惊厥发作,可按每次10 mg/kg追加匹罗卡品,追加达4次仍未达到Ⅳ级发作的不再追加。对照组注入生理盐水10 mg/kg。操作完毕后使其采取侧卧位送回鼠笼。28 d后癫痫造模成功。
1.3.1.2 建立合并抑郁的模型在成功建立癫痫模型后,根据先前描述的方法诱导慢性不可预见性应激抑郁模型(CMS)[12]。CMS方案包括七种不同的应激源,连续14 d按随机顺序排列如下:倾斜鼠笼(45℃);17 h禁食、禁水20 h;湿笼(100 g锯屑垫料中加入200 ml水)21 h;禁水17 h;持续光照17 h;电击(30 v电压)足底5 s;夹尾1 min;行为限制2 h;4℃冰水游泳(水深15 cm,大鼠的后足尖刚能触及桶底)5 min。每种应激给予3~4次,连续两天不出现相同应激,使大鼠不能预料刺激的发生。造模结束后进行行为学测定。
1.3.2 药物干预方法对照组、模型组正常群养。氟西汀组于造模结束后给予氟西汀干预药(10 mg/kg,每日1次)腹腔注射;3-MA组给予3-MA(5 mg/kg,每日1次)腹腔注射。对照组、模型组同时给予同等量生理盐水。药物干预28 d,治疗结束后进行行为学测定。
1.3.3 行为学检测 1.3.3.1 体重及摄食量每日8:00加食物50 g,次日8:00称食物余量,在造模结束及治疗后进行摄食量测定,同时测定动物体重。
1.3.3.2 旷场实验[13]旷场实验(open-field test) 装置由不透明材料制成,大小为90 cm×90 cm×45 cm,等分为25个等边方格。将大鼠置于中心方格内,观察大鼠在3 min内水平运动次数(穿越外周格数和穿越中央格数)及垂直运动次数,其中,四只爪子均进入一格方可记录水平运动1次,两前爪腾空或攀附墙壁方可记录垂直运动1次。
1.3.4 免疫组化最后一次行为学测定后,每组取6只大鼠,将其麻醉处死,取出大鼠脑组织石蜡包埋后,进行冠状位切片,厚度约5 μm。经脱蜡、水化后,依次进行抗原修复、内源性过氧化物酶消除、非特异性蛋白封闭、4℃孵育兔抗鼠beclin1、LC3-I、mToR(1 : 100)过夜、室温孵育二抗2 h、酶联反应、DAB染色、苏木素复染、脱水透明、中性树胶封片,显微镜下观察组织染色情况,细胞呈现棕黄色染色者为阳性。染色强度使用IPP 6.0软件分析海马齿状回平均光密度。
1.3.5 RT-PCR最后一次行为学测定后,每组取6只大鼠,将其麻醉处死,取出新鲜大鼠海马齿状回部位组织。用Triziol法提取总RNA,用反转录酶将mRNA反转录为cDNA。构建聚合酶体系;Taq酶催化,热循环:95℃预热5 min,40个循环(94℃20 s,退火20 s,72℃30 s)。采用荧光实时定量PCR法,将阈值循环数(ct)值与不同浓度标准品的对数值拟合作图,得出校正曲线;通过2-△△ct法计算目的基因与内参物(β-actin)Ct值的差值,表示目的基因的相对表达水平。引物情况见表 1。
| 因子 | 上游引物 | 下游引物 |
| beclin1 | 5’ GGCCAATAAGA TGGGTCTGAA 3’ |
5’ GTACAACGGCAA CTCCTTAGAT 3’ |
| LC3-I | 5’ GAAGGTTTCTTGG GAGGCATAG 3’ |
5’ GCACAGCATGG TGAGTGTAT 3’ |
| mToR | 5’ CGGGACTACAG AGAGAAGAAGA 3’ |
5’ TCAGAGTCA GGTGGTCATAGT 3’ |
| β-actin | 5’ GTCGTACCACT GGCATTGTG 3’ |
5’ TCTCAGCTGT GGTGGTGAAG 3’ |
采用SPSS 24.0软件进行统计学分析。数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况48只造模大鼠中,6只大鼠未发生癫痫,故被排除在实验之外。癫痫合并抑郁造模成功42只,随机分为模型组、氟西汀组、3-MA组,每组14只。癫痫合并抑郁造模成功后,模型组在治疗第3天、第14天各死亡1只大鼠;氟西汀组在治疗第7天、第17天各死亡1只大鼠;3-MA组在治疗第9天、第15天各死亡1只大鼠。
2.2 各组大鼠抑郁行为学变化造模前各组抑郁行为学指标比较均无统计学意义(P>0.05)。造模后,模型组、氟西汀组、3-MA组体重、摄食量、垂直运动次数和水平运动次数明显低于对照组(P < 0.05或P < 0.01);药物治疗后,模型组以上指标仍低于对照组,差异有统计学意义(P < 0.01);氟西汀组、3-MA组以上指标明显高于模型组(P < 0.01或P < 0.05)。氟西汀组、3-MA组两组间相比差异无统计学意义(P>0.05)。见表 2、表 3。
| 组别 | 造模前 | 造模后 | 治疗后 | |||||
| 体重(g) | 摄食量(g) | 体重(g) | 摄食量(g) | 体重(g) | 摄食量(g) | |||
| 对照组 | 198.13±18.03 | 29.40±4.92 | 250.22±24.31 | 30.10±5.73 | 290.08±28.33 | 31.52±4.34 | ||
| 模型组 | 200.33±20.09 | 30.81±5.93 | 203.21±31.21* | 16.53±4.84** | 215.32±28.35** | 13.74±3.75** | ||
| 氟西汀组 | 196.28±17.17 | 30.33±4.52 | 211.32±28.08* | 17.14±3.84** | 253.42±22.54# | 20.39±4.54# | ||
| 3-MA组 | 202.43±18.87 | 28.73±5.63 | 208.21±26.15* | 16.23±3.55** | 242.32±27.31# | 18.53±3.83# | ||
| 注:*为与对照组相比,*P < 0.05,**P < 0.01;#为与模型组相比,#P < 0.05,##P < 0.01 | ||||||||
| 组别 | 造模前 | 造模后 | 治疗后 | |||||
| 垂直运动次数(次) | 水平运动次数(次) | 垂直运动次数(次) | 水平运动次数(次) | 垂直运动次数(次) | 水平运动次数(次) | |||
| 对照组 | 21.76±3.42 | 62.13±9.33 | 22.60±4.55 | 61.33±8.32 | 23.55±5.89 | 63.42±10.39 | ||
| 模型组 | 22.43±4.15 | 63.54±9.72 | 8.67±2.81** | 22.45±7.58** | 9.54±2.92** | 21.87±6.53** | ||
| 氟西汀组 | 22.54±3.81 | 63.12±10.73 | 8.34±2.57** | 23.66±6.41** | 14.60±3.28## | 45.64±8.95# | ||
| 3-MA组 | 21.82±5.87 | 61.32±9.44 | 7.83±2.45** | 23.81±7.65** | 15.67±3.33# | 39.51±9.37# | ||
| 注:*为与对照组相比,*P < 0.05,**P < 0.01;#为与模型组相比,#P < 0.05,##P < 0.01 | ||||||||
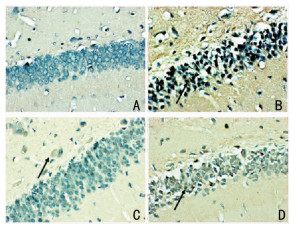
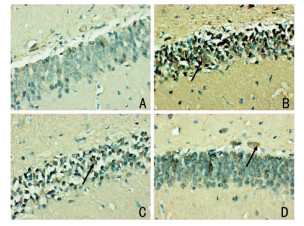
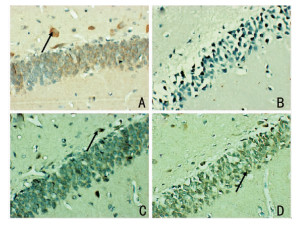
大鼠海马齿状回细胞质可以观察到棕黄色或者黄色颗粒,为Beclin1、LC3-I和mToR阳性表达。与对照组相比,模型组Beclin1和LC3-I阳性表达明显增加,mToR下降(P < 0.01)。与模型组比较,氟西汀组、3-MA组Beclin1和LC3-I阳性表达明显降低,mToR升高(P < 0.01)。而氟西汀组、3-MA组之间相比差异无统计学意义(P>0.05)。见图 1、图 2、图 3、表 4。
|
| 注:A:对照组;B:模型组;C:氟西汀组;D:3-MA组 图 1 beclin1蛋白表达(×400),黑色箭头代表阳性表达 |
|
| 注:A:对照组;B:模型组;C:氟西汀组;D:3-MA组 图 2 LC3-I蛋白表达(×400),黑色箭头代表阳性表达 |
|
| 注:A:对照组;B:模型组;C:氟西汀组;D:3-MA组 图 3 mToR蛋白表达(×400),黑色箭头代表阳性表达 |
| 组别 | beclin1 | LC3-I | mToR |
| 对照组 | 0.053±0.013 | 0.114±0.057 | 0.276±0.081 |
| 模型组 | 0.351±0.098** | 0.398±0.103** | 0.043±0.021** |
| 氟西汀组 | 0.176±0.073## | 0.220±0.085## | 0.125±0.065## |
| 3-MA组 | 0.193±0.086## | 0.238±0.095## | 0.118±0.054## |
| 注:*为与对照组相比,*P < 0.05,**P < 0.01;#为与模型组相比,#P < 0.05,##P < 0.01 | |||
与对照组相比,模型组beclin1、LC3-I mRNA表达显著升高,mToR mRNA表达下降,差异有统计学意义(P < 0.01)。氟西汀、3-MA组beclin1、LC3-I mRNA表达下降,mToR mRNA表达升高,与模型组相比差异有统计学意义(P < 0.01),而氟西汀、3-MA组以上指标相比差异无统计学意义(P>0.05)。见表 5。
| 组别 | beclin1 | LC3-I | mToR | |
| 对照组 | 0.058±0.007 | 0.079±0.011 | 0.010±0.004 | |
| 模型组 | 0.128±0.031** | 0.162±0.043** | 0.005±0.002** | |
| 氟西汀组 | 0.071±0.027## | 0.118±0.032## | 0.009±0.003## | |
| 3-MA组 | 0.078±0.022## | 0.109±0.056## | 0.008±0.003## | |
| 注:*为与对照组相比,*P < 0.05,**P < 0.01;#为与模型组相比,#P < 0.05,##P < 0.01 | ||||
本研究中我们发现氟西汀能改善锂﹣匹罗卡品+慢性不可预知性应激大鼠建立癫痫合并抑郁大鼠体重、摄食量、垂直运动次数及水平运动次数。说明氟西汀能改善癫痫合并抑郁大鼠的抑郁症状。目前研究多聚焦在氟西汀对其神经递质以及神经损伤方面研究,鲜少关注与自噬相关研究。近期研究发现氟西汀能抑制早期脑损伤自噬激活改善蛛网膜下腔出血炎症情况[14],因此氟西汀是否可以通过调节自噬改善该病症状?
有研究发现,过度的激活自噬可导致细胞死亡[15]。迟兆富等[16]通过电镜观察,发现在匹罗卡品诱导癫痫大鼠模型海马CA1区的一些细胞具有与垂死细胞一致的超微结构如许多破坏的线粒体、核固缩、受损的内质网和高尔基复合体以及电子致密物,同时在这些细胞内还观察到相对较多的自噬泡。mTOR是调节细胞自噬的关键蛋白,mTOR信号通路的激活对细胞自噬活性具有负性调节作用[17],p-mTOR表达升高提示mTOR信号通路高度激活,并会对自噬活性造成显著抑制[18]。beclin-1与bc l-2/bcl-xl解离与Ⅲ型P13K相结合可诱导细胞自噬发生[19]。自噬发生后,LC3的数量增高,因此,可通过检测细胞内LC3-I判断细胞自噬是否被激活。因此本研究通过检测beclin-1、LC3-I及mTOR表达观察癫痫合并抑郁大鼠自噬情况。
本研究中癫痫合并抑郁大鼠造模后免疫组化、RT-PCR结果均显示海马齿状回beclin-1、LC3-I表达升高及mTOR表达下降,说明癫痫合并抑郁存在细胞自噬。我们使用氟西汀、自噬抑制剂3-MA干预后beclin-1、LC3-I表达下降及mTOR表达升高。3-MA是选择性PI3K抑制剂,通过改善LC3、mTOR等自噬相关因子的表达,抑制自噬体的形成[20]。氟西汀与自噬抑制剂相比差异无统计学意义,说明氟西汀可以有效改善癫痫合并抑郁海马自噬。
综上所述,氟西汀可能通过改变海马区beclin1、LC3-I、mToR表达,抑制细胞自噬。改善其抑郁症状。以上相关机制的研究,为氟西汀抗癫痫合并抑郁的治疗提供了理论支持,为癫痫合并抑郁患者的预防和治疗提供了新的思路。
| [1] |
Bell GS, Neligan A, Sander JW. An unknown quantity-the worldwide prevalence of epilepsy[J]. Epilepsia, 2014, 55(7): 958-962. DOI:10.1111/epi.12605 |
| [2] |
Kui C, Yingfu P, Chenling X, et al. What are the predictors of major depression in adult patients with epilepsy?[J]. Epileptic Disord, 2014, 16(1): 74-79. |
| [3] |
Oh A, Thurman DJ, Kim Hl. Comorbidities and risk factors associated with newly diagnosed epilepsy in the U.S. pediatric population[J]. Epilepsy Behav, 2017, 75: 230-236. DOI:10.1016/j.yebeh.2017.07.040 |
| [4] |
Haile K, Awoke T, Ayano G, et al. Suicide ideation and attempts among people with epilepsy in Addis Ababa, Ethiopia[J]. Ann Gen Psychiatry, 2018, 17: 4. DOI:10.1186/s12991-018-0174-6 |
| [5] |
Yang P, Sun M, Li L, et al. 8-hydroxy-dipropylaminotetralin promotes neural plasticity in epileptic rats with depression[J]. Neural Regen Res, 2012, 7(8): 565-571. |
| [6] |
Bieri G, Lucin KM, O'Brien CE, et al. Proteolytic cleavage of Beclin 1 exacerbates neurodegeneration[J]. Mol Neurodegener, 2018, 13(1): 68. DOI:10.1186/s13024-018-0302-4 |
| [7] |
Lasarge CL, Danzer SC. Mechanisms regulating neuronal excitability and seizure development following mTOR pathway hyperactivation[J]. Front Mol Neurosci, 2014, 7: 18. |
| [8] |
Gemmel M, Hazlett M, B? gi E, et al. Perinatal fluoxetine effects on social play, the HPA system, and hippocampal plasticity in pre-adolescent male and female rats:Interactions with pre-gestational maternal stress[J]. Psychoneuroendocrinology, 2017, 84: 159-171. DOI:10.1016/j.psyneuen.2017.07.480 |
| [9] |
Sharma RK, Singh T, Mishra A, et al. Relative Safety of Different Antidepressants for Treatment of Depression in Chronic Epileptic Animals Associated with Depression[J]. J Epilepsy Res, 2017, 7(1): 25-32. DOI:10.14581/jer.17005 |
| [10] |
Yang Y, Hu Z, Du X, et al. miR-16 and Fluoxetine Both Reverse Autophagic and Apoptotic Change in Chronic Unpredictable Mild Stress Model Rats[J]. Front Neurosci, 2017, 11: 428. DOI:10.3389/fnins.2017.00428 |
| [11] |
张菲菲, 程艳伟, 于敏敏, 等. 大鼠癫痫持续状态后认知功能变化模式及海马脑红蛋白表达水平的实验研究[J]. 国际神经病学神经外科学杂志, 2017, 44(5): 501-506. |
| [12] |
Willner P, Moreau JL, Nielsen CK, et al. Decreased hedonic responsiveness following chronic mild stress is not secondary to loss of body weight[J]. Physiol Behav, 1996, 60(1): 129-134. DOI:10.1016/0031-9384(95)02256-2 |
| [13] |
凌佳, 吴梦瑶, 杨琴, 等. 下丘脑﹣垂体﹣肾上腺轴紊乱对焦虑性抑郁模型大鼠海马结构的影响[J]. 基础医学与临床, 2018, 38(9): 1231-1238. DOI:10.3969/j.issn.1001-6325.2018.09.004 |
| [14] |
Li JR, Xu HZ, Nie S, et al. Fluoxetine-enhanced autophagy ameliorates early brain injury via inhibition of NLRP3 inflammasome activation following subrachnoid hemorrhage in rats[J]. J Neuroinflammation, 2017, 14(1): 186. DOI:10.1186/s12974-017-0959-6 |
| [15] |
Sun D, Zhu L, Zhao Y, et al. Fluoxetine induces autophagic cell death via eEF2K-AMPK-mTOR-ULK complex axis in triple negative breast cancer[J]. Cell Prolif, 2018, 51(2): e12402. DOI:10.1111/cpr.12402 |
| [16] |
曹丽丽, 董艳, 迟兆富, 等. Wortmannin通过抑制癫痫大鼠海马自噬活性发挥神经保护作用[J]. 中国病理生理杂志, 2010, 26(8): 1584-1588. DOI:10.3969/j.issn.1000-4718.2010.026 |
| [17] |
Yang Y, Chen D, Liu H, et al. Increased expression of lncRNA CASC9 promotes tumor progression by suppressing autophagy-mediated cell apoptosis via the AKT/mTOR pathway in oral squamous cell carcinoma[J]. Cell Death Dis, 2019, 10(2): 41. DOI:10.1038/s41419-018-1280-8 |
| [18] |
Liang Q, Xiao Y, Liu K, et al. Cr(VI)-Induced Autophagy Protects L-02 Hepatocytes from Apoptosis Through the ROS-AKT-mTOR Pathway[J]. Cell Physiol Biochem, 2018, 51(4): 1863-1878. DOI:10.1159/000495713 |
| [19] |
Hussain A, Qazi AK, Mupparapu N, et al. A novel PI3K axis selective molecule exhibits potent tumor inhibition in colorectal carcinogenesis[J]. Mol Carcinog, 2016, 55(12): 2135-2155. DOI:10.1002/mc.22457 |
| [20] |
Qu L, Chen C, He W, et al. Glycyrrhizic acid ameliorates LPS-induced acute lung injury by regulating autophagy through the PI3K/AKT/mTOR pathway[J]. Am J Transl Res, 2019, 11(4): 2042-2055. |
 2019, Vol. 46
2019, Vol. 46




