扩展功能
文章信息
- 黄小冬, 王芳, 李柯麓, 吴崇民, 保健见, 刘彬, 徐忠, 杨兴隆, 任惠
- HUANG Xiao-Dong, WANG Fang, LI Ke-Lu, WU Chong-Ming, BAO Jian-Jian, LIU Bin, XU Zhong, YANG Xing-Long, REN Hui
- 伴与不伴快速眼动睡眠行为障碍帕金森病患者临床差异的meta分析
- Differences in clinical features between Parkinson's disease patients with and without rapid eye movement sleep behavior disorder: A meta-analysis
- 国际神经病学神经外科学杂志, 2019, 46(4): 368-373
- Journal of International Neurology and Neurosurgery, 2019, 46(4): 368-373
-
文章历史
收稿日期: 2018-12-25
修回日期: 2019-05-06
PD是一种中老年人常见的神经系统变性疾病,主要表现为静止性震颤、运动迟缓、肌强直和姿势步态异常等运动症状[1],此外还可伴有大量非运动症状,例如嗅觉减退、便秘、抑郁、睡眠障碍、认知功能障碍等[2]。Schenk等[3]在1986年首次提出快速眼动睡眠行为障碍(rapid eye movement sleep behavior disorder, RBD),其表现为在快速眼动睡眠期(rapid eye movement sleep, REM)正常的肌肉弛缓现象消失,并出现与梦境内容相关的暴力行为[4]。RBD发病机制尚不明确,Iranzo等[5]研究认为,RBD是由调节快速眼动期睡眠的脑干相关核团(蓝斑下核、脑桥被盖外侧部、背外侧核下部等)及其投射通路受损引起的。根据“Braak假说”[6],RBD可能是PD的前驱症状,PD患者伴发RBD与许多因素有关。目前有多项研究通过比较PD患者中伴与不伴RBD患者临床特征,然而各研究结果并不一致,分析原因可能是因为单个研究的样本量小及研究因素不同。本文通过meta分析对相关研究进行整合,通过扩大样本量,分析合并RBD对PD患者临床表现的影响。
1 研究资料和方法 1.1 文献纳入及排除标准纳入标准:①原始数据是公开发表的;②根据英国帕金森病协会脑库标准或其他标准确诊PD;③RBD诊断符合ICSD、ICSD-R或ICSD-2诊断标准;④关于PD患者中RBD发生的相关因素的病例对照研究;⑤原始数据提供各因素分析的病例组及对照组的人数、均数及标准差。
排除标准:①非病例对照研究;②重复报道;③资料不完整或无法取得补充数据的文献。
1.2 文献检索策略以“Parkinson’s disease”、“Parkinsons disease”、“Parkinson disease”、“PD”、“rapid eye movement”、“rem sleep behavior disorder”、“rapid eye movement sleep behavior disorder”、“RBD”为英文关键词检索PubMed、EMbase等外文数据库,以“帕金森病”、“快速眼动睡眠行为障碍”为关键词检索中国生物医学数据库(CMB)、中国知识基础设施工程(CNKI)、维普中文科技期刊全文数据库(VIP)、万方数据库等中文数据库,并追踪检索相关文献的参考文献。
1.3 资料提取由2名研究者独立进行文献检索,根据纳入、排除标准筛选文献,对结果进行交叉核对,如遇分歧,则咨询第3位研究者协助判断。
1.4 文献质量评价2名研究者独立采用纽卡斯尔﹣渥太华量表(the Newcastle-Ottawa Scale, NOS)对所纳入的研究进行质量评价,采用了星级系统的半量化原则,评价后星数越多质量越好,最高分为10颗星,其中≥5颗星视为高质量研究,可被纳入荟萃分析。如有分歧,则参考第3名研究者意见并协商解决。
1.5 统计学分析用Stata 12.0软件进行Meta分析。计数资料采用优势比(OR)作为效应量,计量资料以标准均数差(SWD)作为效应量,并计算95%置信区间(95%CI)。对同一相关因素,用Cochran’s Q检验及I2为指标评价各项纳入研究间的异质性,I2 < 25%提示无异质性,25%≤I2 < 50%为轻度异质性,50%≤I2 < 75%为中度异质性,I2≥75%为高度的异质性,当结果为无异质性或者轻度异质性采用固定效应模式进行meta分析,当结果为中度﹣高度异质性则使用随机效应模式进行meta分析,并进行亚组分析。漏斗图对称、Begg’s和Egger’s检验P>0.05均提示无明显的发表偏移。
2 结果 2.1 文献检索结果初检出文献1274篇,排除重复研究202篇,排除非病例对照及内容无关的研究文献958篇,研究对象不符合纳入标准、资料不完整文献97篇,最终纳入文献17篇(文献筛选流程详见图 1)。纳入的17项研究NOS评分最高为9分、最低为7分,说明纳入文献质量较好。
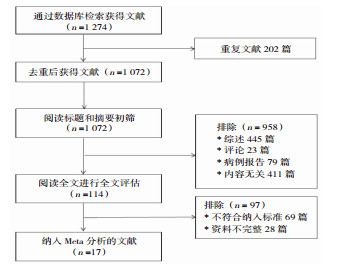
|
| 图 1 文献筛选流程图 |
共纳入17项病例对照研究[7-23],共有PD患者3006例,其中伴RBD的PD患者(PD-RBD组)1474例,不伴RBD的PD患者(PD-NRBD组)1532例。通过对各研究涉及的相关因素进行整理,筛选出PD患者性别、年龄、发病年龄、PD病程、Hoehn-Yahr分级、UPDRS-Ⅲ评分、左旋多巴剂量、症状波动、异动症、MMSE评分、幻觉等11个相关因素进行分析。见表 1。
| 作者 | 年份 | 国家 | RBD的诊断工具 | 例数(n) | PD+RBD组例数及男女比例n(M/F) | NOS评分(分) |
| Vendette[7] | 2007 | 加拿大 | ICSD-2 | 34 | 18(NR) | 7 |
| Gjerstad[8] | 2008 | 挪威 | ICSD | 231 | 34(25/9) | 7 |
| Yoritaka[9] | 2009 | 日本 | ICSD-R | 150 | 81(70/11) | 7 |
| Lee[10] | 2010 | 韩国 | ICSD-R | 447 | 164(79/85) | 7 |
| Sixel-Doring[11] | 2011 | 德国 | ICSD-2 | 457 | 210(130/80) | 9 |
| Vibha[12] | 2011 | 印度 | ICSD-R | 134 | 26(19/7) | 7 |
| Postuma[12] | 2012 | 加拿大 | ICSD-2 | 42 | 27(23/4) | 8 |
| Nomura[14] | 2013 | 日本 | ICSD-2 | 59 | 27(14/13) | 8 |
| Fabio[15] | 2013 | 瑞士 | ICSD-2 | 20 | 10(8/2) | 8 |
| Sorensen[16] | 2013 | 丹麦 | ICSD-2 | 23 | 10(7/3) | 7 |
| Gong[17] | 2014 | 中国 | ICSD-2 | 112 | 63(40/23) | 8 |
| Neikrug[17] | 2014 | 美国 | ICSD-2 | 62 | 36(25/11) | 7 |
| Kim[19] | 2014 | 韩国 | ICSD-R | 944 | 578(266/312) | 7 |
| Arnulf[20] | 2015 | 法国 | ICSD-2 | 114 | 78(56/22) | 7 |
| Zhang[21] | 2016 | 中国 | ICSD-2 | 46 | 35(30/5) | 7 |
| Lim[22] | 2016 | 韩国 | ICSD-2 | 38 | 24(12/12) | 9 |
| Jozwiak[23] | 2017 | 加拿大 | ICSD-2 | 93 | 53(40/13) | 8 |
共纳入10项研究,异质性检验显示各独立研究之间存在异质性(P=0.007, I2=60.2%),采用随机效应模型进行合并,结果表明组间差异有统计学意义(SMD=-0.23; 95%CI-0.40~-0.06; P=0.008),根据是否使用PSG进行亚组分析,使用PSG监测组(PSG+组)(SMD=-0.35; 95%CI-0.70~-0.00;P=0.05)与未使用PSG监测组(PSG-组)(SMD=-0.13;95%CI-0.23~-0.03;P=0.01)中RBD组与NRBD组之间的差异均具有统计学意义。见图 2。
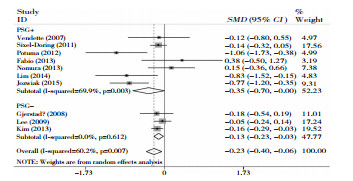
|
| 图 2 RBD组与非RBD组MMSE评分对比 |
PD患者性别、年龄、发病年龄、PD病程、Hoehn-Yahr分级、UPDRS-Ⅲ评分、左旋多巴剂量、症状波动、异动症、幻觉的分析显示:RBD组与NRBD组患者之间在年龄、发病年龄、PD病程、Hoehn-Yahr分级、UPDRS-Ⅲ评分、左旋多巴剂量、症状波动、异动症、幻觉相比较,差异均具有统计学意义;两组间在性别对比上差异无统计学意义。见表 2。
| 相关因素 | 效应量 | 95%CI | P | Begg’s 检验 |
Egger’s 检验 |
| 性别 | 1.15 | [0.99, 1.35] | 0.07 | 0.192 | 0.004 |
| 年龄 | 0.26 | [0.19, 0.34] | < 0.00 001 | 0.387 | 0.79 |
| 发病年龄 | 0.09 | [-0.01, 0.19] | 0.08 | 0.734 | 0.884 |
| PD病程 | 0.29 | [0.21, 0.37] | < 0.00 001 | 0.092 | 0.073 |
| Hoehn-Yahr分级 | 0.22 | [0.11, 0.33] | < 0.00 001 | 0.592 | 0.137 |
| UPDRS-Ⅲ评分 | 0.25 | [0.15, 0.36] | < 0.00 001 | 0.043 | 0.004 |
| 左旋多巴剂量 | 0.17 | [0.08, 0.26] | < 0.00 001 | 1.000 | 0.452 |
| 症状波动 | 1.65 | [1.34, 2.03] | < 0.00 001 | 0.296 | 0.245 |
| 异动症 | 2.24 | [1.74, 2.88] | < 0.00 001 | 0.734 | 0.588 |
| 幻觉 | 3.15 | [2.06, 4.80] | < 0.00 001 | 0.06 | 0.041 |
PD患者MMSE评分发表偏倚分析显示:漏斗图(略)对称、Begg’s检验(P=0.721)和Egger’s检验(P=0.316)均提示不存在发表偏移。见图 3。
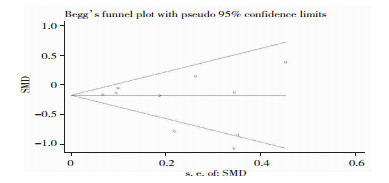
|
| 图 3 RBD组与非RBD组MMSE评分对比漏斗图 |
PD患者其他相关因素的发表偏倚分析显示:UPDRS-Ⅲ评分存在发表偏倚,性别、年龄、发病年龄、病程、Hoehn-Yahr分期、左旋多巴剂量、症状波动、异动症、幻觉的发表偏倚分析显示均不存在发表偏倚。见表 2。
2.5 敏感性分析敏感性分析显示,各项研究间稳定性好,Meta分析结果可靠。见图 4。
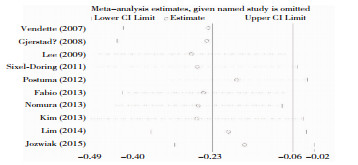
|
| 图 4 RBD组与非RBD组MMSE评分对比敏感性分析 |
本研究结果显示,与不伴RBD患者相比,伴RBD的PD患者具有以下特点:患者年龄更大、病程更长、Hoehn-Yahr分期更高、UPDRS-Ⅲ评分更高,需要更大的左旋多巴剂量、更易出现运动并发症,伴有更多的非运动症状,如认知功能损害、幻觉等,而两组患者性别及PD发病年龄无差异。
RBD在PD中的患病率为30%~41%,其中65%~75%伴RBD的PD患者为男性[24]。本研究显示RBD在PD患者中无明显性别差异,与Anne等[25]研究结论一致,但Anne等[25]发现在临床表现上有明显的性别差异:女性PD患者在梦中的打斗和攻击性行为明显减少,但睡眠障碍较多,而造成这种差异的机制尚不明确。本研究显示,RBD的发生与PD患者年龄、病程有关,与起病年龄无关。虽然两组患者Hoehn-Yahr分级及UPDRS-Ⅲ评分存在差异,但这种差异不能排外病程的影响,故RBD对PD患者病情严重程度的影响尚不能定论。本研究还显示,伴RBD的PD患者需要的左旋多巴剂量更大,可能与先前报道的伴RBD的PD患者左旋多巴敏感性较低有关[26]。本研究同时也发现,伴RBD的PD患者更易出现症状波动、异动症等运动并发症,这可能与这些患者接受较大剂量左旋多巴治疗有关。
认知障碍是PD常见的非运动症状之一,包括帕金森病轻度认知损害(PD with mild cognitive impairment, PD-MCI)和帕金森病痴呆(PD with dementia, PDD)[27],PD患者发生认知障碍的几率在24%~60%之间[28]。PD早期即可出现认知功能受损,多数PD患者晚期会进展为痴呆[29]。目前有研究[30]表明,RBD是PD患者发生认知损害的独立危险因素,本次研究亦显示伴RBD的PD患者MMSE评分更低,并且这种结果在PSG诊断组和非PSG诊断组中都是一致的。研究发现PD患者认知损害主要表现在执行功能、视空间、注意力、记忆和语言功能等领域[31],而PD合并RBD的患者则在执行功能、情景语言记忆、视觉空间能力和注意力方面下降[13, 21, 23]。
有研究发现,RBD与PD认知损害可能存在相同的病理损害基础,如Kotagal等[32]研究发现,伴RBD的PD患者新皮质、边缘皮质和丘脑胆碱能神经支配减少;Meyer等[33]研究发现,丘脑、中脑、脑桥、颞叶皮质、额顶叶皮质、海马和小脑等部位的乙酰胆碱受体的减少与PD患者认知损害严重程度相关。Rodrigues等[34]对原发性RBD患者研究显示,与认知功能正常患者相比,合并轻度认知障碍的患者在清醒和快速眼动睡眠期间,其中央和后部皮质区域的脑电图活动减慢。而Latreille等[35]的研究发现PDD的最佳预测因子是REM期间后部区域脑电图活动减慢、清醒时颞区脑电图活动减慢、枕部主导节律较低,这提示RBD患者与PD认知损害患者存在的共同电生理改变。此外,随着基因检测技术的发展,越来越多都表明葡萄糖脑苷脂酶(glucocerebrosidase, GBA)基因突变与RBD发生及PD患者认知损害有关。Gan-Or等[36]对265例原发性RBD患者和120例PD患者进行GBA基因检测发现,原发性RBD患者与PD患者均可携带GBA基因突变,PD患者中携带GBA基因突变者更有可能的伴发RBD。Thaler等[37]对1050例PD患者进行筛查,发现GBA纯合子或复合杂合子患者的RBD患病率高于GBA杂合子的患者。由此可见,GBA基因突变与RBD的发生密切相关。此外,Cilia等[38]研究发现,携带GBA基因突变PD患者较未携带GBA基因突变的PD患者更容易出现认知损害,且GBA基因突变程度越严重其痴呆的发生风险越高。上述研究表明GBA基因突变可能是PD认知损害与RBD的发生存在共同的遗传学机制。Huertas等[39]研究认为GBA基因突变可能是通过干扰额叶皮质纹状体区功能及其他非多巴胺能过程,从而影响认知功能。然而目前这方面的研究较少,仍需更多大样本研究证实。
Gibson等[40]研究发现PD患者中有30%~60%出现视幻觉。虽然PD患者出现幻觉的发病机制尚不明确,但Lenka等[41]指出多种因素,如年龄较大、PD的高分级阶段和症状严重程度、某些药物(如多巴胺受体激动剂和抗胆碱能药物)、视觉障碍、睡眠障碍、RBD和认知障碍被认为是PD患者出现视幻觉的危险因素,此外,海马及海马旁结构萎缩可能是RBD与视幻觉发生的共同结构基础,且伴RBD的PD患者与伴视幻觉的PD患者均存在胆碱能功能障碍。本次研究结果显示伴RBD的PD患者较不伴RBD的PD患者更易出现幻觉,但二者之间的确切关系仍需更多基础及临床研究来明确。
此外,本研究仍存在一些不足:首先,由于此类研究较少且研究因素不同,部分相关因素的研究存在发表偏倚,而且很多研究的样本量太小,直接影响到分析的准确性;其次,缺乏精神症状(焦虑、抑郁、淡漠等)、睡眠障碍、直立性低血压、便秘、嗅觉障碍等因素的研究数据。因此,在今后的研究设计中,通过不断增加有关研究,扩大样本量,使用统一的诊断标准以减少异质性、提高分析的准确度。
综上所述,伴与不伴RBD的PD患者之间存在临床差异,伴RBD的PD患者年龄更大、PD病程长、病情更严重,而需要更高的左旋多巴剂量,更易出现运动并发症及非运动症状,因此,临床上应重视伴发RBD的PD患者,及早识别并尽早对其影响因素进行干预,以延缓疾病进展、改善患者的生活质量、减轻家庭及社会的负担。
| [1] |
Queally JM, Abdulkarim A, Mulhall KJ. Total hip replacement in patients with neurological conditions[J]. J Bone Joint Surg Br, 2009, 91(10): 1267-1273. |
| [2] |
Munhoz RP, Moro A, Silveira-Moriyama L, et al. Non-motor signs in Parkinson's disease:a review[J]. Arq Neuropsiquiatr, 2015, 73(5): 454-462. DOI:10.1590/0004-282X20150029 |
| [3] |
Schenck CH, Bundlie SR, Ettinger M G, et a1. chronic behavioral disorders of human REM sleep:a new category of parasomnia[J]. Sleep, 1986, 9: 293-308. DOI:10.1093/sleep/9.2.293 |
| [4] |
Bassetti C, Bargiotas P. REM Sleep Behavior Disorder[J]. Front Neurol Neurosci, 2018, 41: 104-116. |
| [5] |
Iranzo A. The REM sleep circuit and how its impairment leads to REM sleep behavior disorder[J]. Cell Tissue Res, 2018, 373(1): 245-266. |
| [6] |
Braak H, Del Tredici K, Rub U, et al. Staging of brain pathology related to sporadic parkinson's disease[J]. Neurobiol Aging, 2003, 24(2): 197-211. DOI:10.1016/S0197-4580(02)00065-9 |
| [7] |
Vendette M, Gagnon JF, Decary A, et al. REM sleep behavior disorder predicts cognitive impairment in parkinson disease without dementia[J]. Neurology, 2007, 69(19): 1843-1849. DOI:10.1212/01.wnl.0000278114.14096.74 |
| [8] |
Gjerstad MD, Boeve B, Wentzel-Larsen T, et al. Occurrence and clinical correlates of rem sleep behaviour disorder in patients with parkinson's disease over time[J]. J Neurol Neurosurg Psychiatry, 2008, 79(4): 387-391. DOI:10.1136/jnnp.2007.116830 |
| [9] |
Yoritaka A, Ohizumi H, Tanaka S, et al. Parkinson's disease with and without rem sleep behaviour disorder:are there any clinical differences?[J]. Eur Neurol, 2009, 61(3): 164-170. DOI:10.1159/000189269 |
| [10] |
Lee JE, Kim KS, Shin HW, et al. Factors related to clinically probable rem sleep behavior disorder in Parkinson disease[J]. Parkinsonism Relat Disord, 2010, 16(2): 105-108. DOI:10.1016/j.parkreldis.2009.08.005 |
| [11] |
Sixel-Doring F, Trautmann E, Mollenhauer B, et al. Associated factors for rem sleep behavior disorder in Parkinson disease[J]. Neurology, 2011, 77(11): 1048-1054. DOI:10.1212/WNL.0b013e31822e560e |
| [12] |
Vibha D, Shukla G, Goyal V, et al. RBD in Parkinson's disease:a clinical case control study from north india[J]. Clin Neurol Neurosurg, 2011, 113(6): 472-476. DOI:10.1016/j.clineuro.2011.02.007 |
| [13] |
Postuma RB, Bertrand JA, Montplaisir J, et al. Rapid eye movement sleep behavior disorder and risk of dementia in Parkinson's disease:a prospective study[J]. Mov Disord, 2012, 27(6): 720-726. DOI:10.1002/mds.24939 |
| [14] |
Nomura T, Inoue Y, Kagimura T, et al. Clinical significance of REM sleep behavior disorder in Parkinson's disease[J]. Sleep Med, 2013, 14(2): 131-135. DOI:10.1016/j.sleep.2012.10.011 |
| [15] |
Sorensen GL, Mehlsen J, Jennum P. Reduced sympathetic activity in idiopathic rapid-eye-movement sleep behavior disorder and Parkinson's disease[J]. Auton Neurosci, 2013, 179(1-2): 138-141. DOI:10.1016/j.autneu.2013.08.067 |
| [16] |
Di Fabio N, Poryazova R, Oberholzer M, et al. Sleepwalking, REM sleep behaviour disorder and overlap parasomnia in patients with Parkinson's disease[J]. Eur Neurol, 2013, 70(5-6): 297-303. DOI:10.1159/000353378 |
| [17] |
Gong Y, Xiong KP, Mao CJ, et al. Clinical manifestations of Parkinson disease and the onset of rapid eye movement sleep behavior disorder[J]. Sleep Med, 2014, 15(6): 647-653. DOI:10.1016/j.sleep.2013.12.021 |
| [18] |
Neikrug AB, Avanzino JA, Liu L, et al. Parkinson's disease and REM sleep behavior disorder result in increased non-motor symptoms[J]. Sleep Med, 2014, 15(8): 959-966. DOI:10.1016/j.sleep.2014.04.009 |
| [19] |
Kim YE, Jeon BS, Yang HJ, et al. REM sleep behavior disorder:association with motor complications and impulse control disorders in Parkinson's disease[J]. Parkinsonism Relat Disord, 2014, 20(10): 1081-1084. DOI:10.1016/j.parkreldis.2014.03.022 |
| [20] |
Arnulf I, Neutel D, Herlin B, et al. Sleepiness in Idiopathic REM Sleep Behavior Disorder and Parkinson Disease[J]. Sleep, 2015, 38(10): 1529-1535. DOI:10.5665/sleep.5040 |
| [21] |
Zhang LY, Liu WY, Kang WY, et al. Association of rapid eye movement sleep behavior disorder with sleep-disordered breathing in Parkinson's disease[J]. Sleep Med, 2016, 20: 110-115. DOI:10.1016/j.sleep.2015.12.018 |
| [22] |
Lim JS, Shin SA, Lee JY, et al. Neural substrates of rapid eye movement sleep behavior disorder in Parkinson's disease[J]. Parkinsonism Relat Disord, 2016, 23: 31-36. DOI:10.1016/j.parkreldis.2015.11.027 |
| [23] |
Jozwiak N, Postuma RB, Montplaisir J, et al. REM Sleep Behavior Disorder and Cognitive Impairment in Parkinson's Disease[J]. Sleep, 2017, 40(8). DOI:10.1093/sleep/zsx101 |
| [24] |
Sixel-Doring F, Zimmermann J, Wegener A, et al. The Evolution of REM Sleep Behavior Disorder in Early Parkinson Disease[J]. Sleep, 2016, 39(9): 1737. DOI:10.5665/sleep.6102 |
| [25] |
Bj? rnar? KA, Dietrichs E, Toft M. REM sleep behavior disorder in Parkinson's disease-is there a gender difference?[J]. Parkinsonism Relat Disord, 2013, 19(1): 120-122. DOI:10.1016/j.parkreldis.2012.05.027 |
| [26] |
Postuma RB, Gagnon JF, Vendette M, et al. REM sleep behaviour disorder in Parkinson's disease is associated with specific motor features[J]. J Neurol Neurosurg Psychiatry, 2008, 79(10): 1117-1121. DOI:10.1136/jnnp.2008.149195 |
| [27] |
Litvan I, Goldman JG, Troster AI, et al. Diagnostic criteria for mild cognitive impairment in Parkinson's disease:movement disorder society task force guidelines[J]. Mov Disord, 2012, 27(3): 349-356. DOI:10.1002/mds.24893 |
| [28] |
Wu Q, Chen L, Zheng Y, et al. Cognitive impairment is common in parkinson's disease without dementia in the early and middle stages in a han chinese cohort[J]. Parkinsonism Relat Disord, 2012, 18(2): 161-165. DOI:10.1016/j.parkreldis.2011.09.009 |
| [29] |
Aarsland D, Bronnick K, Larsen JP, et al. Cognitive impairment in incident, untreated parkinson disease:the norwegian parkwest study[J]. Neurology, 2009, 72(13): 1121-1126. DOI:10.1212/01.wnl.0000338632.00552.cb |
| [30] |
Kim Y, Kim YE, Park EO, et al. REM sleep behavior disorder portends poor prognosis in Parkinson's disease:A systematic review[J]. J Clin Neurosci, 2018, 47: 6-13. DOI:10.1016/j.jocn.2017.09.019 |
| [31] |
Lin YQ, Chen SD. RBD:a red flag for cognitive impairment in Parkinson's disease?[J]. Sleep Med, 2018, 44: 38-44. DOI:10.1016/j.sleep.2018.01.006 |
| [32] |
Kotagal V, Muller ML, Kaufer DI, et al. Thalamic cholinergic innervation is spared in Alzheimer disease compared to parkinsonian disorders[J]. Neurosci Lett, 2012, 514(2): 169-172. DOI:10.1016/j.neulet.2012.02.083 |
| [33] |
Meyer PM, Strecker K, Kendziorra K, et al. Reduced alpha 4 beta 2*-nicotinic acetylcholine receptor binding and its relationship to mild cognitive and depressive symptoms in Parkinson disease[J]. Arch Gen Psychiatry, 2009, 66(8): 866-877. DOI:10.1001/archgenpsychiatry.2009.106 |
| [34] |
Rodrigues Brazete J, Montplaisir J, Petit D, et al. Electroencephalogram slowing in rapid eye movement sleep behavior disorder is associated with mild cognitive impairment[J]. Sleep Med, 2013, 14(11): 1059-1063. DOI:10.1016/j.sleep.2013.06.013 |
| [35] |
Latreille V, Carrier J, Gaudet-Fex B, et al. Electroencephalographic prodromal markers of dementia across conscious states in Parkinson's disease[J]. Brain, 2016, 139(Pt 4): 1189-1199. |
| [36] |
Gan-Or Z, Mirelman A, Postuma RB, et al. GBA mutations are associated with Rapid Eye Movement Sleep Behavior Disorder[J]. Ann Clin Transl Neurol, 2015, 2(9): 941-945. DOI:10.1002/acn3.228 |
| [37] |
Thaler A, Gurevich T, Bar Shira A, et al. A "dose" effect of mutations in the GBA gene on Parkinson's disease phenotype[J]. Parkinsonism Relat Disord, 2017, 36: 47-51. DOI:10.1016/j.parkreldis.2016.12.014 |
| [38] |
Cilia R, Tunesi S, Marotta G, et al. Survival and dementia in GBA-associated Parkinson's disease:The mutation matters[J]. Ann Neurol, 2016, 80(5): 662-673. DOI:10.1002/ana.24777 |
| [39] |
Huertas I, Jesus S, Garcia-Gomez FJ, et al. Genetic factors influencing frontostriatal dysfunction and the development of dementia in Parkinson's disease[J]. PLoS One, 2017, 12(4): e0175560. DOI:10.1371/journal.pone.0175560 |
| [40] |
Gibson G, Mottram PG, Burn DJ, et al. Frequency, prevalence, incidence and risk factors associated with visual hallucinations in a sample of patients with Parkinson's disease:a longitudinal 4-year study[J]. Int J Geriatr Psychiatry, 2013, 28(6): 626-631. DOI:10.1002/gps.3869 |
| [41] |
Lenka A, Hegde S, Jhunjhunwala KR, et al. Interactions of visual hallucinations, rapid eye movement sleep behavior disorder and cognitive impairment in Parkinson's disease:A review[J]. Parkinsonism Relat Disord, 2016, 22(12): 1-8. |
 2019, Vol. 46
2019, Vol. 46




