扩展功能
文章信息
- 杨华君, 赵洪鉴, 杨兴隆
- YANG Hua-Jun, ZHAO Hong-Jian, YANG Xing-Long
- 先天性肌强直一家系以及散发患者一例的临床、电生理、基因学研究
- Clinical, electrophysiological, and genetic studies of one family and one sporadic patient with congenital myotonia
- 国际神经病学神经外科学杂志, 2019, 46(4): 364-367
- Journal of International Neurology and Neurosurgery, 2019, 46(4): 364-367
-
文章历史
收稿日期: 2019-01-07
修回日期: 2019-05-03
2. 昆明医科大学第一附属医院老年神经内科, 云南省昆明市 650032
先天性肌强直(myotonia congenita, MC)是以非萎缩性肌肉肥大和强直为主要临床特征的遗传性疾病[1]。根据遗传类型可分为常染色体显性遗传的Thomsen病和常染色体隐性遗传的Becker病[1]。MC是由于氯离子通道蛋白1基因(chloride channel protein 1 gene, CLCN1)突变所引起,该基因位于7号染色体长臂35,编码骨骼肌的氯离子通道蛋白1(chloride channel 1, clc-1)。CLCN1的突变可能导致clc1的异常,进而引起骨骼肌细胞兴奋性升高,最终导致患者肌肉出现收缩后不易放松的症状。MC在国外报道较多[2],而在国内报道相对较少,但随着近些年基因检测技术的发展,临床上也有较多的报道[3-9]。在本文中,我们将对我们近期诊治的MC一家系以及一例散发性MC患者进行临床、电生理及基因分析报道。
1 对象与方法 1.1 研究对象 1.1.1 家系先证者:男,17岁,因“四肢僵直3年”。于2017年9月收住我科。患者于3年前发现双手握拳后不易放松,反复活动后症状可改善,下肢起步时肌肉稍感僵硬,步行一段距离后症状有所缓解。此后症状逐年渐有加重,自觉握拳后更不易放松,下肢肌肉僵直缓解需要步行更长的距离。并且出现用力咀嚼后张口有困难、用力闭眼后睁眼费力以及久坐后起立困难。
查体:神志清楚,高级功能检查正常。颅神经检查正常。四肢肌肉发育良好,双侧肱二头肌容积稍大,肌力、肌张力正常。大鱼际肌叩击可见肌球征象,腱反射正常、共济正常、病理征未引出。
辅助检查:CK正常;肌电图:可见强直电位。
家系调查:该家系三代有共计7名患者(家系的系谱图见图 1,家系的临床特征见表 1)。
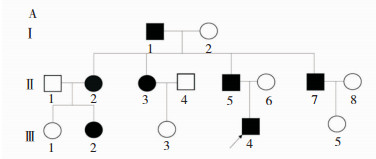
|
| 注:方框代表男性;圆形代表女性;黑色实心标记为患者;箭头所指为先证者。 图 1 MC家系的系谱图 |
| 指标 | 先证者 | Ⅰ1 | Ⅱ2 | Ⅱ3 | Ⅱ5 | Ⅱ7 | Ⅲ1 |
| 年龄 | 17 | 65 | 44 | 42 | 39 | 37 | 15 |
| 发病年龄 | 14 | 15 | 14 | 13 | 16 | 16 | 12 |
| 初始症状 | 握拳不易放松 | 下肢起步僵硬 | 下肢起步僵硬 | 握拳不易放松 | 握拳不易放松 | 握拳不易放松 | 下肢起步僵硬 |
| 诱发因素 | 运动 | 运动 | 运动 | 运动 | 运动 | 运动 | 运动 |
| 肌肉强直 | |||||||
| 眼肌 | + | + | 无 | 无 | + | 无 | + |
| 咀嚼肌 | + | + | - | + | - | - | + |
| 上肢 | + | + | + | + | + | + | + |
| 下肢 | + | + | + | + | + | + | + |
| 肌肉肥大 | + | - | + | + | + | + | + |
| 肌球症 | + | - | + | + | - | + | - |
| Warm现象 | + | + | + | + | + | + | + |
| EMG | 肌强直电位 | 未查 | 未查 | 肌强直电位 | 肌强直电位 | 未查 | 未查 |
男,26岁,因“肢体僵直10余年”于2017年12月收住我科。患者自2000年起逐渐发现打篮球等运动时出现肌肉不能立即放松、动作不灵活,休息后再运动症状更严重,反复运动后症状可减轻;自2004年后患者逐渐出现久坐后站立起步困难,行走时不能完全缓解。握拳后不能立即放松,咀嚼时,张口较困难。天气寒冷时可使症状稍加重。
查体:神志清楚,高级功能检查正常。颅神经检查正常。四肢肌肉发育良好,双侧肱二头肌容积稍大,肌力、肌张力正常。叩击未见肌球征象,腱反射正常、共济正常、病理征未引出。
辅助检查:CK正常;肌电图:可见强直电位。
1.2 方法 1.2.1 DNA提取采集家系中患者以及亲属的外周静脉血5 ml,采用传统的酚﹣氯仿法进行DNA提取基因组DNA。
1.2.2 CLCN1基因以及钠离子通道4A基因突变检测设计CLCN1基因及钠离子通道4A(sSodium channel protein type 4 subunit alpha, SCN4A)基因的引物,扩增片段包括CLCN1、SCN4A基因的所有外显子,引物由公司合成(北京空军航空医学研究所附属医院分子病理中心)。进一步进行PCR扩增。PCR扩增产物直接送北京空军航空医学研究所附属医院分子病理中心进行DNA纯化、测序(测序仪器为ABI PRISM 3730)。根据上下游引物与外显子之间的物理距离确定测序方向,为保证外显子序列测序完整,测序起始方向一侧的引物序列距外显子至少60 bp,突变热区外显子进行双向测序,用Chromas DNA序列图谱软件阅读测序彩图,用Word打开序列文件,通过NCBI Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对测序结果进行比对。
2 结果经过基因检测,家系中先证者的第8外显子存在c.892G>A(p.Ala298Thr, A298T)的错义杂合突变(图 1),编码氨基酸由丙氨酸(Ala)变为苏氨酸(Thr)。先证者的爷爷(Ⅰ1)父亲(Ⅱ5)和大伯(Ⅱ2)、二伯(Ⅱ3)、堂姐(Ⅲ1)也携带同样的突变(图 1)。先证者四叔有相似的症状,但不同意进行基因检测。先证者的堂姐为正常个体,未发现该突变。散发性患者的CLCN1基因17外显子发现c.2169C>A(p.Ser723Arg, S723R)错义杂合突变,其编码氨基酸由丝氨酸(Ser)变为精氨酸(Arg)。散发性患者的母亲该位点未发现突变,而父亲因拒绝行基因检查而未能进一步明确患者的突变系父亲遗传所致或系新生突变。经检索人类基因突变数据库(www.hgmd.org),A298T为已知突变而S723R为新报道突变。
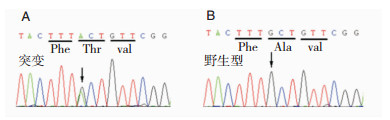
|
| 注:A:家系中患者携带的A298T突变(先证者Ⅲ4以及Ⅰ1、Ⅱ5、Ⅱ2、Ⅱ3、Ⅲ1);B:家系中无症状者(Ⅲ2)298位置为野生型 图 2 MC家系的基因检测结果 |
MC的患病率在不同的人种有着极大的不同,高加索人群中为0.2~0.9/10万,而在芬兰患病率则为7.5/10万[10]。对于先天性肌强直的遗传学研究显示隐性遗传的MC发病率较显性遗传的MC发病率要高。在德国的一项纳入143家系的研究中,显性遗传的患者占到了19%,而隐性遗传的患者占73%。而在另一项研究中也发现,20%为显性遗传。而在中国的一项研究中发现,常染色显性遗传患者占到了86.1%,但实际上该文献是居于家系分析而非基因学的分析,很多所谓“散发”的患者可能为携带复合杂合突变的常染色体隐性遗传而被忽略了[11]。而随后一项基于基因学的中国研究也发现,显性遗传的MC的比率为58.1%[8]。因此,这些差异可能和种族差异有关,当然基因检测的方法学也可能是另外一个重要的因素。通过联合检测CLCN1以及SCN4A两个基因能发现非萎缩肌强直患者的致病基因概率为93%,要远高于单纯检测CLCN1基因检出致病基因的概率(40%~75%)[12]。因此,我们的研究采用的检测就是联合检测CLCN1、SCN4A两个基因。
家系中,通过系谱分析发现该家系为常染色体显性遗传。连续两代均有患者。平均发病年龄为14岁。临床起病以握拳不易放松或者下肢起步时僵硬为特点,病情发展相对较慢。在本研究中我们在家系中发现了先证者携带A298T突变,随后在其家系成员中共分离出了该突变。因此,考虑A298T为该家系的致病突变。在较早的一项研究中,Gao等[13]首次在中国人群中报道了该突变。该突变的具体功能尚没有深入的研究。通过Mutation Taster、Polyphen 2等在线预测软件可得出该突变位点的功能为“致病性”,因此该突变可能为功能性突变。A298T突变位于clc-1蛋白的H和I结构域之间的螺旋。该区域是clc-1通道二聚体的接触面,而这个交叉点被认为是显性遗传较常见发生的区域。既往的研究曾报道紧邻A298T的F297S突变和显性MC相关。该突变能够使钠离子通道失活从而导致骨骼肌细胞形成显著地去极化电位。最终导致骨骼肌膜的兴奋性增加[14]。考虑到该两个突变位置的比邻,A298T极有可能有相似的作用。并且,该位点所在的8号外显子似乎也是MC患者致病突变好发的热点位置[14]。值得一提的是在此前,马腹蝉等[5]的研究也在一个常染色体显性遗传的MC中家系共分离出了A298T突变。陈挺枝等[7]发现的c.1024G>A突变也同样位于8号显子。此外,研究发现CLCN1除了影响clc-1蛋白的功能外,还能影响其表达水平,Raheem采用免疫组化染色以及Western-Blot的方法发现携带CLCN1突变的患者的肌膜clc-1蛋白表达显著地降低,因此这也可能是CLCN1突变致病的机制[15]。
在“散发”的患者中我们发现了其携带S723R错义杂合突变,该突变位于17号外显子,其编码氨基酸由丝氨酸变为精氨酸。该突变为既往没有报道过的突变,通过Mutation Taster以及polyphen 2预测其为“多态性”以及“良性”,因此该突变是否为该患者的致病突变需要进一步进行功能验证。
对于MC的治疗而言,美西律是一线用药,也是目前唯一具有循证医学证据的药物。最近的一项国际多中心的双盲安慰剂对照的研究中发现美西律治疗MC优于安慰剂。美西律能够显著的改善患者的僵直程度以及减轻握拳后强直的程度。近期一项中国的病案报道发现一例携带复合杂合突变(c.1401+1G>A,c.16 57A>T)的常染色体隐性遗传MC患者接受美西律100mg 3次/日后缓解迅速[16]。我们研究的患者症状相对尚轻,同时考虑到药物的不良反应,患者及家属暂时拒绝使用相关的药物治疗。
| [1] |
Lossin C, George AL Jr. Myotonia congenita[J]. Adv Genet, 2008, 63: 25-55. DOI:10.1016/S0065-2660(08)01002-X |
| [2] |
Brugnoni R, Kapetis D, Imbrici P, et al. A large cohort of myotonia congenita probands:novel mutations and a high-frequency mutation region in exons 4 and 5 of the CLCN1 gene[J]. J Human Genet, 2013, 58(9): 581-587. DOI:10.1038/jhg.2013.58 |
| [3] |
Liu XL, Huang XJ, Shen JY, et al. Myotonia congenita:novel mutations in CLCN1 gene[J]. Channels, 2015, 9(5): 292-298. DOI:10.1080/19336950.2015.1075676 |
| [4] |
Meng YX, Zhao Z, Shen HR, et al. Identification of novel mutations of the CLCN1 gene for myotonia congenital in China[J]. Neurol Res, 2016, 38(1): 40-44. DOI:10.1080/01616412.2015.1114741 |
| [5] |
马腹蝉, 高峰, 袁哲锋. 先天性肌强直两家系的临床分析以及CLCN1基因突变检测[J]. 临床儿科学杂志, 2011, 29(11): 1041-1043. |
| [6] |
孔令恩, 吴倩仪, 沈岩松, 等. 先天性肌强直一家系CLCNl基因突变的研究[J]. 临床神经病学杂志, 2012, 25(6): 407-409. |
| [7] |
陈枝挺, 陈万金, 陈圣根, 等. 二例先天性肌强直的CLCNl基因突变研究[J]. 中华医学遗传学杂志, 2012, 29(6): 690-692. |
| [8] |
Yang X, Jia H, An R, et al. Sequence CLCN1 and SCN4A in patients with Nondystrophic myotonias in Chinese populations:Genetic and pedigree analysis of 10 families and review of the literature[J]. Channels, 2017, 11(1): 55-65. |
| [9] |
沈宏锐, 靳陶然, 孟雁欣, 等. 81例强制性肌病的临床、病理和分子生物学研究[J]. 中华神经医学杂志, 2019, 18(1): 61-65. |
| [10] |
Jou SB, Chang LI, Pan H, et al. Novel CLCN1 mutations in Taiwanese patients with myotonia congenita[J]. J Neurol, 2004, 251(6): 666-670. |
| [11] |
Zhang Y, Zhang S, Shang H. Clinical characteristics of myotonia congenita in China Literature analysis of the past 30 years[J]. Neural Regenerat Res, 2008, 3(2): 216-220. |
| [12] |
Trip J, Drost G, Verbove DJ, et al. In tandem analysis of CLCN1 and SCN4A greatly enhances mutation detection in families with non-dystrophic myotonia[J]. Eur J Human Genet, 2008, 16(8): 921-929. DOI:10.1038/ejhg.2008.39 |
| [13] |
Gao F, Ma FC, Yuan ZF, et al. Novel chloride channel gene mutations in two unrelated Chinese families with myotonia congenita[J]. Neurol India, 2010, 58(5): 743-746. DOI:10.4103/0028-3886.72163 |
| [14] |
Fialho D, Schorge S, Pucovska U, et al. Chloride channel myotonia:exon 8 hot-spot for dominant-negative interactions[J]. Brain, 2007, 130(Pt 12): 3265-3274. |
| [15] |
Raheem O, Penttila S, Suominen T, et al. New immunohistochemical method for improved myotonia and chloride channel mutation diagnostics[J]. Neurology, 2012, 79(22): 2194-2200. DOI:10.1212/WNL.0b013e31827595e2 |
| [16] |
Miao J, Wei XJ, Liu XM, et al. A case report:autosomal recessive Myotonia congenita caused by a novel splice mutation (c.1401+1G>A) in CLCN1 gene of a Chinese Han patient[J]. BMC Neurol, 22, 18(1): 154. |
 2019, Vol. 46
2019, Vol. 46




