扩展功能
文章信息
- 王谑菲, 袁德智, 张晓天, 赵秋叶, 李晋芳
- WANG Xue-Fei, YUAN De-Zhi, ZHANG Xiao-Tian, ZHAO Qiu-Ye, LI Jin-Fang
- 脑深部电刺激术联合药物治疗帕金森病有效性和安全性的meta分析
- Efficacy and safety of deep brain stimulation combined with drug therapy in treatment of Parkinson's disease: A meta-analysis
- 国际神经病学神经外科学杂志, 2019, 46(4): 358-363
- Journal of International Neurology and Neurosurgery, 2019, 46(4): 358-363
-
文章历史
收稿日期: 2019-04-08
修回日期: 2019-06-04
帕金森病(Parkinson disease, PD)是一种进行性神经变性疾病。其主要特征是震颤、运动迟缓、肌强直及姿势不稳。世界范围内40岁及以上人群中的PD患病率约为0.3%[1]。目前对PD最有效的治疗药物为左旋多巴,而接受左旋多巴类药物治疗5年的患者中多达50%会出现运动症状波动及异动症[2]。脑深部电刺激术(deep brain electrical stimulation, DBS)是用于治疗PD晚期的手术方式[3]。因其可减轻PD患者相关的运动症状波动及异动症,现常用于内科保守治疗疗效欠佳的病人。而DBS术后患者有癫痫发作及认知、行为等并发症。故本研究采用Meta分析的方法评价丘脑底核脑深部电刺激(subthalamic nucleus deep brain electrical stimulation,STN-DBS)治疗PD的有效性及安全性,为临床治疗提供科学依据。
1 资料与方法 1.1 文献检索检索国内外数据库:PubMed、EMBASE、Cochrane Library、CNKI。文献语种限定为中文及英文。英文检索词:subthalamic nucleus、deep brain stimulation、DBS、STN-DBS、Parkinson disease、Outcome。中文检索词:帕金森病、脑深部电刺激、丘脑底核脑深部电刺激、疗效。检索年限为建刊至2018年9月。
1.2 文献纳入标准与排除标准纳入标准:①研究对象:确诊为PD的患者(排除非典型或帕金森综合征),且PD病程在4~5年上;随访时间5年;②干预措施:PD患者均接受STN-DBS术;③研究类型:为自身对照试验;④结局指标:对患者术后5年刺激/未服药(Stim-on/Med-off)与术后5年无刺激/未服药(Stim-off/Med-off)、术后5年刺激/服药(Stim-on/Med-on)与术后5年刺激/未服药(Stim-on/Med-off)的状态下统一帕金森病评估量表运动评分(Unified Parkinson's Disease Rating Scale Part Ⅲ, UPDRSⅢ)、统一帕金森病评估量表日常生活评分(Unified Parkinson's Disease Rating Scale Part Ⅱ, UPDRSⅡ)、抗左旋多巴等效日剂量(levodopa-equivalent daily dose, LEDD)等评价。
排除标准:①研究对象不符合纳入标准;②干预措施为脑深部电刺激但刺激靶点非丘脑底核;③结局指标未分为上述状态进行评分;④失访率过高,或随访时间未达5年。
1.3 文献筛选和数据提取由两名研究者阅读文献文题及摘要初步筛选文献,然后细读全文并交叉核对结果。最后若提取的数据不一致可讨论协商或请第三方评判解决。Jadad量表评价文献质量,总分为7分,评分≥4分为高质量文献,评分 < 4分为低质量文献。
1.4 统计学方法采用RevMan 5.3软件进行Meta分析。计数资料的效应指标采用危险比(risk ratio, RR);计量资料采用标准化均数差(standardized mean difference, SMD)及95%可信区间(95% confidential interval, 95%CI)描述。对各临床结果的异质性采用卡方检验,若异质性检验结果无统计学意义(P≥0.05, I2≤50%),则采用固定效应模型进行Meta分析,否则采用随机效应模型,并对异质性产生原因进行分析。以P < 0.05为差异有统计学意义。采用漏斗图对称性评估Meta分析的发表偏倚。
2 结果 2.1 研究描述初步检出英文文献2 833篇,经过阅读题目摘要后剔除不符合标准的文献2 822篇,进一步阅读全文符合纳入条件文献11篇;中文文献无符合纳入条件文献。文献检索流程见图 1,纳入文献基本资料见表 1。
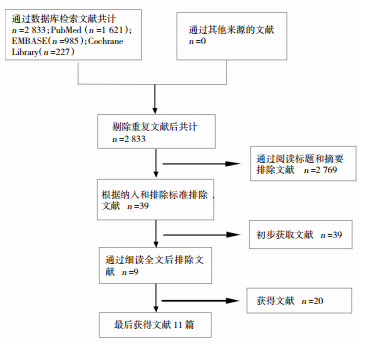
|
| 图 1 文献检索流程图 |
| 文献 | 例数(n) | 年龄(岁) | 病程(年) | “关”期 UPDRSⅢ(分) |
结局指标 | 随访时间(年) | Jadad量表(分) |
| Jiang L, et al[4] | 10 | 59.4±9.3 | 9.3±2.9 | 44.1±9.8 | UPDRSⅢ | 5 | 5 |
| Avilesolmos I, et al[5] | 41 | 56.2±8.4 | 12.9±5.8 | 50.3±15.8 | UPDRSⅢ | 5 | 5 |
| Merola A, et al[6] | 19 | 61.5±5.7 | 22.8±2.3 | 28.8±5.9 | UPDRSⅢ | 5 | 4 |
| Schupbach WMM, et al[7] | 30 | 54.9±9.1 | 15.2±5.3 | 51.9±17.2 | UPDRSⅢ | 5 | 3 |
| Krack P, et al[8] | 42 | 55±7.5 | 14.6±5.0 | 55.7±11.9 | UPDRSⅢ | 5 | 4 |
| Gervaisbernard H, et al[9] | 23 | 55.1±7.2 | 12.9±3.2 | 44.5±13.1 | UPDRSⅢ | 5 | 4 |
| Wider C, et al[10] | 37 | 64.9±7.6 | 14.4±4.9 | 47.2±14.4 | UPDRSⅢ | 5 | 5 |
| Zibetti M, et al[11] | 14 | 60.4±6.5 | 7.2±5 | 51.3±11.4 | UPDRSⅢ | 5 | 4 |
| Liang J, et al[12] | 23 | 60.6±6.4 | 8.4±5.1 | 44.2±12.9 | UPDRSⅢ | 5 | 4 |
| Castrioto A, et al[13] | 18 | 52.9±.79 | 13.4±4.8 | 50.2±13.3 | UPDRSⅢ | 5 | 6 |
| Piboolnurak P, et al[14] | 17 | 53.4±8.3 | 13.5±4.7 | 47.7±11.2 | UPDRSⅢ | 5 | 4 |
有4个研究[7, 11, 13, 14]比较术后5年单独STN-DBS治疗与术后5年基线(Stim-off/Med-off)UPDRS-Ⅲ基线得分,各项研究之间无统计学异质性(P=0.22, I2=32%),故采用固定效应模型进行合并效应分析,结果显示差异有统计学意义(SMD=-21.31, 95%CI:-25.18~-17.44, P < 0.01;图 2),提示DBS后5年单独STN-DBS刺激仍能改善患者的运动功能。另外,纳入的9项研究[4, 5, 7-11, 13, 14]共计232名帕金森患者完成了DBS后5年单独STN-DBS治疗和STN-DBS联合药物治疗的UPDRS-Ⅲ评分,各项研究之间无统计学异质性(P=0.52, I2=0%),故采用固定效应模型进行合并效应分析,结果显示,差异有统计学意义(SMD=-7.26, 95%CI:-9.02~-5.02, P < 0.01;图 3),提示DBS后5年STN-DBS联合药物治疗对运动功能的改善优于单独STN-DBS治疗。
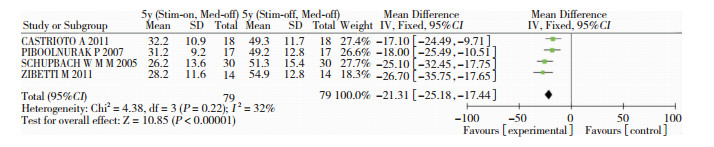
|
| 图 2 单独STN-DBS治疗与基线UPDRS-Ⅲ评分比较的的森林图 |
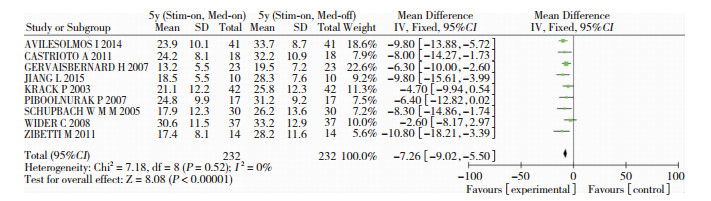
|
| 图 3 STN-DBS联合药物治疗与单独STN-DBS治疗UPDRS-Ⅲ评分比较的的森林图 |
共3项研究[12-14]比较了术后5年单独STN-DBS治疗与术后5年基线震颤得分,各项研究之间无统计学异质性(P=0.21, I2=35%),故采用固定效应模型进行合并效应分析,显示差异有统计学意义(SMD=-4.85, 95%CI:-6.11~-3.58, P < 0.01),结果显示,DBS术后5年单独STN-DBS刺激能改善患者的震颤得分。另外,纳入的7项研究[4, 5, 8, 10, 11, 13, 14]共计179名帕金森患者完成了DBS后5年单独STN-DBS治疗和STN-DBS联合药物治疗的震颤评分,各项研究之间无统计学异质性(P=0.73, I2=0%),故采用固定效应模型进行合并效应分析,显示差异有统计学意义(SMD=-1.12, 95%CI:-1.42~-0.82, P < 0.01),结果显示DBS术后5年STN-DBS联合药物治疗在震颤得分方面优于单独STN-DBS治疗。
2.2.3 强直评分共3项研究[12-14]比较了术后5年单独STN-DBS治疗与术后5年基线强直得分,各项研究之间无统计学异质性(P=0.41, I2=0),故采用固定效应模型进行合并效应分析,显示差异有统计学意义(SMD=-3.61, 95%CI:-4.96~-2.27, P < 0.01),结果显示,DBS术后5年单独STN-DBS刺激能改善患者的强直得分。另外,纳入的6项研究[1, 4, 5, 8, 10, 13]共计165名帕金森患者完成了DBS术后5年单独STN-DBS治疗和STN-DBS联合药物治疗的强直评分,各项研究之间无统计学异质性(P=0.30, I2=18%),故采用固定效应模型进行合并效应分析,显示差异有统计学意义(SMD=-1.74, 95%CI:-2.38~-1.10, P < 0.01),结果显示,DBS术后5年STN-DBS联合药物治疗在强直得分方面优于单独STN-DBS治疗。
2.2.4 轴向症状评分共4项研究[7, 12-14]比较了术后5年单独STN-DBS治疗与术后5年轴向症状基线得分,各项研究之间无统计学异质性(P=0.67, I2=0),故采用固定效应模型进行合并效应分析,显示差异有统计学意义(SMD=-3.41, 95%CI:-4.56~-2.25, P < 0.01),提示DBS后5年单独STN-DBS刺激治疗仍能改善患者的轴向症状。另外,有7项研究[4, 5, 7, 10, 11, 13, 14]共计167名帕金森患者完成了DBS术后5年单独STN-DBS治疗和STN-DBS联合药物治疗的轴向症状评分,各项研究之间无统计学异质性(P=0.69, I2=0),故采用固定效应模型进行合并效应分析,显示差异有统计学意义(SMD=-1.21, 95%CI:-1.94~-0.49, P < 0.01),结果显示DBS术后5年STN-DBS联合药物治疗轴向症状优于单独STN-DBS刺激治疗。
2.2.5 运动迟缓评分共3项研究[12-14]比较了术后5年单独STN-DBS治疗与术后5年运动迟缓基线得分,各项研究之间无统计学异质性(P=0.98, I2=0),故采用固定效应模型进行合并效应分析,显示差异有统计学意义(SMD=-7.18, 95%CI:-9.13~-5.24, P < 0.01),显示DBS术后5年单独STN-DBS刺激治疗能改善患者的运动迟缓。另外,有7项研究[4, 5, 8, 10, 11, 13, 14]共计179名帕金森患者完成了DBS术后5年单独STN-DBS治疗和STN-DBS联合药物治疗的运动迟缓评分,各项研究之间无统计学异质性(P=0.22, I2=27%),故采用固定效应模型进行合并效应分析,显示差异有统计学意义(SMD=-3.15, 95%CI:-4.27~-2.03, P < 0.01),结果显示DBS术后5年STN-DBS联合药物治疗运动迟缓优于单独STN-DBS刺激治疗。
2.2.6 日常生活活动有7项研究[5-8, 11, 13, 14]共计181名帕金森患者完成了DBS术后5年单独STN-DBS治疗和STN-DBS联合药物治疗的UPDRS-Ⅱ评分,各项研究之间无统计学异质性(P=0.28, I2=19%),故采用固定效应模型进行合并效应分析,显示差异有统计学意义(SMD=-4.2, 95%CI:-6.02~-2.82, P < 0.01),结果显示DBS术后5年STN-DBS联合药物治疗对于改善患者日常生活方面优于单独STN-DBS刺激治疗。
2.2.7 左旋多巴等效剂量纳入11项研究共274名PD患者,比较了术前及术后5年左旋多巴等效剂量的变化,各项研究之间有统计学异质性(P < 0.00 001, I2=86%),故采用随机效应模型进行合并效应分析,显示差异有统计学意义(SMD=453.76, 95%CI:394.31~513.21, P < 0.01),结果显示DBS术后5年左旋多巴等效剂量明显低于术前。
2.3 安全性(并发症)对9项[4, 5, 7-11, 13, 14]共275名患者术后并发症进行分析,手术并发症可分为手术相关、装置相关和刺激参数相关三类。
2.3.1 手术所致脑出血12例(4.4%);围手术期相关的意识障碍35例(12.7%);感染6例(2.2%);癫痫3例(1.1%);肺栓塞1例(0.4%);脑挫裂伤3例(1.1%)。
2.3.2 装置所致电极移位、置换8例(2.9%);感染1例(0.4%);装置故障1例(0.4%)。
2.3.3 刺激所致构音障碍、发音低沉56例(20.4%);眼睑失用、睁眼困难38例(13.8%);体重增加71例(25.8%);感觉异常5例(1.8%);运动障碍17例(6.2%);抑郁31例(11.3%);智能减退19例(6.9%);躁狂12例(4.4%);自杀或有自杀观念3例(1.1%);幻觉5例(1.8%)。
3 讨论DBS的临床应用是近二十年来临床神经科学最重要的进展之一。全世界有16万多名患者因各种神经和非神经疾病接受过DBS治疗,且每年接受DBS治疗的人数都在增加[15]。DBS作为一种手术方法,绝大多数都是针对运动障碍,最常见的是帕金森病(PD)。事实上,一些随机对照试验发现,在控制PD的运动障碍症状方面,几乎没有哪种疗法像DBS那样有效[16, 17]。大量研究表明,STN-DBS即使术后5年或10年也能持续改善症状[18]。因此,DBS也被称为治疗PD的“第二次蜜月”。
本文通过系统评价DBS术联合药物治疗的临床试验,探讨术后5年DBS术联合药物治疗的有效性及安全性,结果显示:术后5年,单纯STN-DBS治疗或STN-DBS联合药物治疗能明显改善患者的运动症状(震颤、强直、运动迟缓、轴向症状)及生活质量。且术后5年患者左旋多巴等效剂量明显低于术前。研究表明DBS术后脑出血率低在0.5%~5%,通常预后较好[19],与本文分析脑出血率4.4%相符合,总体出血发生率较低。有研究指出DBS放置相关的癫痫发生率低于2.4%[20],术后感染率为1.2%~15.2%[21-24],本文分析得出癫痫发生率1.1%、术后感染为2.2%,与相关研究结论一致。总的来说,DBS术后并发症发生率较低。
本文共纳入11项研究共274名PD患者,还存在以下局限性:①由于本研究所纳入的文献均为临床试验,但因无法做到对患者及研究人员的双盲,故均未采用双盲,这会使研究结果发生一定的偏移;②本研究的随访以量表得分形式进行评估患者疗效,这也会使得研究结果有偏移;③纳入研究样本量不一,部分样本量较小。
综上所述,STN-DBS在术后5年无论是单纯STN-DBS治疗或STN-DBS联合药物治疗均能改善PD患者的运动症状及生活质量,且较术前明显降低了左旋多巴类药物的用量。STN-DBS术具有手术并发症少、手术安全、无损伤、可逆、可调节等优点。对于帕金森病患者来说DBS术是一个安全有效的治疗方式。
| [1] |
Pringsheim T, Jette N, Frolkis AD, et al. The prevalence of Parkinson's disease:a systematic review and meta-analysis[J]. Mov Disord, 2014, 29(13): 1583-1590. DOI:10.1002/mds.25945 |
| [2] |
Olanow CW, Watts RL, Koller WC. An algorithm (decision tree) for the management of Parkinson's disease (2001):Treatment Guidelines[J]. Neurology, 1998, 56(1): 156-157. |
| [3] |
Fasano A, Daniele A, Albanese A. Treatment of motor and non-motor features of Parkinson's disease with deep brain stimulation[J]. Lancet Neurol, 2012, 11(5): 429-442. DOI:10.1016/S1474-4422(12)70049-2 |
| [4] |
Jiang L, Liu J, Fu X, et al. Long-term Efficacy of Subthalamic Nucleus Deep Brain Stimulation in Parkinson's Disease:A 5-year Follow-up Study in China[J]. Chinese Med J, 2015, 128(18): 2433-2438. DOI:10.4103/0366-6999.164925 |
| [5] |
Avilesolmos I, Kefalopoulou Z, Tripoliti E, et al. Long-term outcome of subthalamic nucleus deep brain stimulation for Parkinson's disease using an MRI-guided and MRI-verified approach[J]. J Neurol Neurosurg Psychiatry, 2014, 85(12): 1419-1425. DOI:10.1136/jnnp-2013-306907 |
| [6] |
Merola A, Zibetti M, Angrisano S, et al. Parkinson's disease progression at 30 years:a study of subthalamic deep brain-stimulated patients[J]. Brain, 2011, 134(7): 2074-2084. DOI:10.1093/brain/awr121 |
| [7] |
Schupbach WMM, Chastan N, Welter M, et al. Stimulation of the subthalamic nucleus in Parkinson's disease:a 5 year follow up[J]. J Neurol Neurosurg Psychiatry, 2005, 76(12): 1640-1644. DOI:10.1136/jnnp.2005.063206 |
| [8] |
Krack P, Batir A, van Blercom N, et al. Five-year follow-up of bilateral stimulation of the subthalamic nucleus in advanced Parkinson's Disease[J]. New Engl J Med, 2003, 349(20): 1925-1934. DOI:10.1056/NEJMoa035275 |
| [9] |
Gervaisbernard H, Xiebrustolin J, Mertens P, et al. Bilateral subthalamic nucleus stimulation in advanced Parkinson's disease:Five year follow-up[J]. J Neurol, 2007, 256(2): 225-233. |
| [10] |
Wider C, Pollo C, Bloch J, et al. Long-term outcome of 50 consecutive Parkinson's disease patients treated with subthalamic deep brain stimulation[J]. Parkinsonism Related Disord, 2008, 14(2): 114-119. DOI:10.1016/j.parkreldis.2007.06.012 |
| [11] |
Zibetti M, Merola A, Rizzi L, et al. Beyond nine years of continuous subthalamic nucleus deep brain stimulation in Parkinson's disease[J]. Mov Disord, 2011, 26(13): 2327-2334. DOI:10.1002/mds.23903 |
| [12] |
Liang J, Hu X, Zhou X, et al. Five-year follow-up of 23 asymmetrical Parkinson's disease patients treated with unilateral subthalamic nucleus stimulation[J]. Neural Regen Res, 2012, 7(18): 1428-1435. |
| [13] |
Castrioto A, Lozano A M, Poon Y, et al. Ten-Year Outcome of Subthalamic Stimulation in Parkinson Disease:A Blinded Evaluation[J]. JAMA Neurol, 2011, 68(12): 1550-1556. |
| [14] |
Piboolnurak P, Lang AE, Lozano AM, et al. Levodopa response in long-term bilateral subthalamic stimulation for Parkinson's disease[J]. Mov Disord, 2007, 22(7): 990-997. DOI:10.1002/mds.21482 |
| [15] |
Lozano AM, Lipsman N. Probing and Regulating Dysfunctional Circuits Using Deep Brain Stimulation[J]. Neuron, 2013, 77(3): 406-424. DOI:10.1016/j.neuron.2013.01.020 |
| [16] |
Schuepbach WM, Rau J, Knudsen K, et al. Neurostimulation for Parkinson's Disease with Early Motor Complications[J]. New Engl J Med, 2013, 368(7): 610-622. DOI:10.1056/NEJMoa1205158 |
| [17] |
Follett KA, Weaver FM, Stern MB, et al. Pallidal versus subthalamic deep-brain stimulation for Parkinson's disease[J]. New Engl J Med, 2010, 362(22): 2077-2091. DOI:10.1056/NEJMoa0907083 |
| [18] |
Rizzone M, Fasano A, Daniele A, et al. Long-term outcome of subthalamic nucleus DBS in Parkinson's disease:from the advanced phase towards the late stage of the disease?[J]. Parkinsonism Related Disord, 2014, 20(4): 376-381. DOI:10.1016/j.parkreldis.2014.01.012 |
| [19] |
Sorar M, Hanalioglu S, Kocer B, et al. Experience Reduces Surgical and Hardware-Related Complications of Deep Brain Stimulation Surgery:A Single-Center Study of 181 Patients Operated in Six Years[J]. Parkinson's Dise, 2018, 2018: 3056018. DOI:10.1155/2018/3056018 |
| [20] |
Coley E, Farhadi R, Lewis S, et al. The incidence of seizures following deep brain stimulating electrode implantation for movement disorders, pain and psychiatric conditions[J]. British J Neurosurg, 2009, 23(2): 179-183. DOI:10.1080/02688690802673197 |
| [21] |
Obwegeser AA, Uitti RJ, Witte RJ, et al. Quantitative and qualitative outcome measures after thalamic deep brain stimulation to treat disabling tremors[J]. Neurosurgery, 2001, 48(2): 274-284. |
| [22] |
Voges J, Waerzeggers Y, Maarouf M, et al. Deep-brain stimulation:long-term analysis of complications caused by hardware and surgery--experiences from a single centre[J]. J Neurol Neurosurg Psychiatry, 2006, 77(7): 868-872. DOI:10.1136/jnnp.2005.081232 |
| [23] |
Sillay KA, Larson PS, Starr PA. Deep brain stimulator hardware-related infections:incidence and management in a large series[J]. Neurosurgery, 2008, 62(2): 360-367. DOI:10.1227/01.neu.0000316002.03765.33 |
| [24] |
Fenoy AJ, Simpson KR. Management of device-related wound complications in deep brain stimulation surgery[J]. J Neurosurg, 2012, 116(6): 1324-1332. DOI:10.3171/2012.1.JNS111798 |
 2019, Vol. 46
2019, Vol. 46




