扩展功能
文章信息
- 余爱勇, 赵迎春, 高卫真, 赵玉武
- YU Ai-Yong, ZHAO Ying-Chun, GAO Wei-Zhen, ZHAO Yu-Wu
- 以共济失调为首发表现的神经梅毒临床特征分析
- Clinical features of neurosyphilis with ataxia as the initial manifestation: An analysis of nine cases
- 国际神经病学神经外科学杂志, 2019, 46(3): 282-288
- Journal of International Neurology and Neurosurgery, 2019, 46(3): 282-288
-
文章历史
收稿日期: 2018-06-13
修回日期: 2019-04-29
2. 上海交通大学医学院附属仁济医院神经外科, 上海市 200127;
3. 上海交通大学附属第六人民医院神经内科, 上海市 200233
目前,神经梅毒(neurosyphilis)发病率呈上升趋势,临床表现复杂多样[1]。本文作者以“neurosyphilis和ataxia”为关键词,利用Medline引擎,自1987-01-01至2017-12-31,共检索出相关文献215篇,这些研究主要集中于精神、行为异常[1]、认知障碍[2, 3]和运动障碍[4],而研究共济失调的文献仅2篇[5, 6]。本文回顾性分析9例以共济失调为首发表现的神经梅毒,总结其临床表现、脑电图及头颅影像学的特征,为临床诊治提供参考。
1 对象与方法 1.1 入选病例和分组 1.1.1 神经梅毒组9例均为首发表现为共济失调的神经梅毒患者,年龄39~76岁,平均年龄(71.9±14.3)岁。7例为2014年7月至2017年9月在上海市松江区中心医院神经内科住院的患者、1例为同期在上海交通大学医学院附属仁济医院神经外科住院的患者、1例为文献报道的患者。农民4例、工人1例、退休2例、无业2例。所有患者均已婚,4例有明确冶游史,5例否认冶游史。
入选患者均符合美国疾病控制中心修正的神经梅毒实验室诊断标准[7]:1项梅毒血清学试验阳性和脑脊液性病研究实验室试验(venereal disease research laboratory test, VDRL)阳性;若脑脊液VDRL阴性,但有不明原因的脑脊液蛋白升高(>0.45 g/L)或(和)白细胞升高(>5个/mm3),以及原因未明的神经梅毒的临床症状和体征。均以共济失调为首发表现,且排除其他疾病导致的共济失调。
1.1.2 脑梗死组选取同期在同院神经内科住院的脑梗死患者19例,年龄46~84岁,平均年龄(71.0±5.6)岁,其中临床诊断为小脑梗死者11例,脑干梗死3例,丘脑梗死1例,大脑半球梗死4例;患者中13例右手为患手,6例左手为患手。
入选标准:①符合脑梗死诊断[8];②以共济失调为主要表现;③患侧肢体肌力V-级及以上;④既往无精神疾病史且无家族史。
排除标准:①意识障碍;②存在失语、失用或忽视症;③患有严重心、肝、肾等疾病;④头颅CT提示颅内出血;⑤不能配合行MRI检查;⑥曾长期从事音乐演奏或键盘操作等工作。
1.2 治疗方案对青霉素皮试阴性者,采用水剂青霉素,每日2400万U,静脉滴注,连续14 d;继以苄星青霉素G,240万U,每周1次,肌肉注射,共3次。对青霉素皮试阳性、无头孢曲松过敏史者、经头孢曲松皮试阴性后,应用头孢曲松钠,每日2 g,静脉滴注,连续15 d。治疗第15天和6月后复查血清和脑脊液。
1.3 检查和评估方案记录神经梅毒患者的临床资料。神经梅毒患者进行血清检查梅毒螺旋体明胶凝集试验(treponema pallidum particle agglutination, TPPA)、梅毒甲苯胺红不加热血清试验(toluidine red untreated serum test, TRUST)。采集脑脊液,检查TPPA、TRUST、性病研究实验室实验(venereal disease research laboratory test, VDRL),1例行脊髓组织免疫组化检测。VDRL和免疫组化由上海市皮肤病医院完成。行脑电图和头颅MRI检查。根据《国际合作共济失调量表》将共济失调症状量化评分[9]。
1.4 统计学方法所有统计分析均由SPSS 17.0软件完成。计量资料以均数±标准差(x±s)表示,符合正态的,两组间比较采用t检验,偏态计量资料采用非参数秩和检验;计数资料采用χ2检验,对样本量过小的计数资料通常采用Fisher精确检验。P<0.05表示差异有统计学意义。
2 结果 2.1 临床表现9例神经梅毒患者的临床表现,见表 1。
| 编号 | 年龄 | 性别 | 病程 | 既往史 | 主诉 | 现病史 | 入院体征 | 入院诊断 |
| 1 | 61 | 男 | 4月 | 车祸 | 走路不稳伴有跌倒 | 走路不稳,行动缓慢,口齿不清,记忆力下降,胡言乱语,跌倒。 | 口齿不清,右侧鼻唇沟浅,定向力、记忆力、计算力减退。双侧跟膝胫试验(+);闭目难立征(+)。 | 硬膜下积液 |
| 2 | 42 | 女 | 15 d | 慢性支气管炎 | 站立不稳伴头晕 | 站立不稳,阵发性头晕、恶心、呕吐、发热。 | 双侧跟膝胫试验(+);闭目难立症阳性。克氏征可疑阳性,双下肢震动觉减退。 | 病毒性脑膜炎 |
| 3 | 65 | 男 | 20 d | 前列腺增生 | 双下肢走路不协调 | 双下肢不协调,自觉行走时身体前冲,少许头晕。 | 右下肢针刺觉减退,右下肢深感觉障碍。双侧病理征未引出。双侧跟膝胫试验(+);闭目难立症阳性。 | 腰椎间盘突出症 |
| 4 | 70 | 男 | 1月 | 无 | 左肢活动不稳 | 左上肢持物不稳,下肢走路不稳,反应迟钝、行为异常。 | 反应稍迟钝。记忆力下降。计算力下降。双侧跟膝胫试验(+);闭目难立症阴性。 | 脑梗死 |
| 5 | 76 | 女 | 1 d | 高血压病 | 双上肢活动不灵 | 双上肢活动不灵巧,双上肢感觉丧失,伴有左下肢疼痛感。 | 双上肢轮替运动(+),双侧指鼻试验(+),双侧跟膝胫试验(+),双上肢针刺觉减退。 | 脑梗死 |
| 6 | 42 | 男 | 1年 | 无 | 走路无法成直线 | 走路无法成直线,行走谨慎、缓慢,混乱攻击,认知下降。 | 左手和双腿可见颤抖。四肢肌张力增高。左侧腱反射(+++),双侧跟膝胫试验(+)。 | 帕金森病 |
| 7 | 76 | 男 | 2年 | 糖尿病 | 走路时失去平衡感 | 走路时失去平衡感,伴记忆力减退。 | 膝反射和踝反射(-),位置觉和震动觉减退,闭目难立症阳性,宽基底步态。 | 脑梗死后遗症 |
| 8 | 39 | 男 | 2年 | 梅毒 | 步态紊乱、冲撞 | 行走不稳,走路困难,视力减退。步态紊乱,走路冲撞,下肢疼痛。 | 阿-罗瞳孔,神经萎缩,膝反射(-)。闭目难立症阳性,下肢关节位置觉、振动觉受损,跟膝胫试验(+)。 | 脊髓痨 |
| 9 | 47 | 男 | 2月 | 无 | 左下肢走路不稳 | 左下肢走路不稳,右腿热觉减退,伴有小便困难和便秘。 | 左侧T5-T7肋神经支配区痛觉敏感,右侧T7肋神经平面以下痛温度觉减退,跟膝胫试验(+)。 | 脊髓肿瘤 |
在静态评分中,与脑梗死组比较,神经梅毒组患者的行走能力评分低、步速评分低、睁眼时身体站立能力评分高、睁眼和闭眼时身体摇晃程度评分高,差异有统计学意义(P<0.05)。
在动态评分中,与脑梗死组比较,神经梅毒组患者的跟膝胫试验评分(动作分裂和意向性震颤)低、指鼻试验评分低(动作分裂和辨距不良)、指鼻试验评分低(手指意向性震颤)、绘阿基米德螺旋图形评分低、肢体协调评分(动态分数)低,差异有统计学意义(P<0.05)。
在共济失调总分中,与脑梗死组比较,神经梅毒组患者评分低,差异有统计学意义(P<0.05)。见表 2。
| 共济失调评分 | 赋值 | 神经梅毒组(n=9) | 脑梗死组(n=19) | t | P |
| 姿势和步态评分(静态分数) | 0~34 | 21.00±5.61 | 19.13±7.66 | 0.701 | 0.506 |
| 行走能力 | 0~8 | 2.00±1.31 | 4.38±2.20 | -2.683 | 0.031 |
| 步速 | 0~4 | 1.50±1.20 | 3.00±0.76 | -2.806 | 0.026 |
| 睁眼时身体站立能力 | 0~6 | 3.87±1.55 | 2.25±0.71 | 2.391 | 0.048 |
| 足距* | 0~4 | 2.38±1.06 | 1.25±0.71 | 2.183 | 0.065 |
| 睁眼时身体摇晃程度 | 0~4 | 2.87±0.83 | 1.00±0.76 | -3.910 | 0.006 |
| 闭眼时身体摇晃程度 | 0~4 | 2.63±0.74 | 1.25±0.46 | -3.667 | 0.008 |
| 坐姿 | 0~4 | 2.13±0.35 | 1.62±0.74 | 1.528 | 0.170 |
| 肢体协调评分(动态分数)△ | 0~52 | 12.89±3.01 | 20.67±5.83 | -2.765 | 0.024 |
| 跟膝胫试验(动作分裂和意向性震颤) | 0~8 | 1.89±1.54 | 4.00±1.87 | -2.562 | 0.034 |
| 跟膝胫试验(动作性震颤) | 0~8 | 0.56±0.53 | 1.22±0.67 | -2.309 | 0.050 |
| 指鼻试验(动作分裂和辨距不良) | 0~8 | 2.89±2.03 | 5.00±1.87 | -2.801 | 0.023 |
| 指鼻试验(手指意向性震颤) | 0~8 | 2.33±1.41 | 4.77±1.48 | -4.400 | 0.002 |
| 指指试验 | 0~8 | 3.00±1.22 | 3.77±1.39 | -1.214 | 0.259 |
| 轮替动作 | 0~8 | 0.89±0.78 | 1.00±0.71 | -0.286 | 0.782 |
| 绘阿基米德螺旋图形 | 0~4 | 1.78±0.67 | 2.56±0.73 | -2.800 | 0.023 |
| 构音障碍评分 | 0~8 | 0.67±0.42 | 3.26±1.34 | -2.274 | 0.039 |
| 构音困难(语言流利度) | 0~4 | 0.22±0.44 | 1.22±0.97 | -2.683 | 0.028 |
| 构音困难(语言清晰度) | 0~4 | 0.33±0.50 | 1.44±1.01 | -3.162 | 0.013 |
| 眼球运动评分 | 0~6 | 0.50±0.62 | 1.62±1.13 | -1.104 | 0.127 |
| 凝视诱发的眼震 | 0~4 | 0.11±0.33 | 0.44±0.73 | -1.155 | 0.282 |
| 眼球追踪异常 | 0~3 | 0.22±0.44 | 0.56±1.01 | -1.155 | 0.282 |
| 眼睛扫视辩距不良 | 0~1 | 0.11±0.33 | 0.33±0.50 | -1.512 | 0.169 |
| 共济失调总分 | 100 | 34.14±12.87 | 49.27±18.45 | -2.594 | 0.039 |
| 注:*:在睁眼、没有支撑的自然姿势下站立时测量结果。△:除了“绘阿基米德螺旋图形”项外,均包括左侧评分和右侧评分。 | |||||
治疗前,患者的血清TRUST的滴度为1 : 8~1 : 64,脑脊液TRUST的滴度为1 : 4~1 : 32,VDRL的滴度1 : 2~1 : 64。治疗15 d后,患者血清TRUST的滴度为1 : 2~1 : 32,脑脊液TRUST的滴度为1 : 1~1 : 16,VDRL的滴度1 : 1~1 : 16。治疗6月后,患者的血清TRUST的滴度为1 : 1~1 : 4,脑脊液TRUST的滴度为1 : 1~1 : 4,VDRL的滴度为1 : 1~1 : 2。治疗前与治疗后患者血清和脑脊液的TPPA均为阳性。见表 3。
| 编号 | 治疗前血清 | 治疗前脑脊液 | 治疗15 d血清 | 治疗15 d脑脊液 | 治疗6月血清 | 治疗6月脑脊液 | ||||||||||||||
| TPPA | TRUST | TPPA | TRUST | VDRL | TPPA | TRUST | TPPA | TRUST | VDRL | TPPA | TRUST | TPPA | TRUST | VDRL | ||||||
| 1 | + | 1:32 | + | 1:4 | 1:8 | + | 1:8 | + | 1:2 | 1:4 | + | 1:4 | + | 1:1 | 1:1 | |||||
| 2 | + | 1:16 | + | 1:4 | 1:16 | + | 1:8 | + | 1:2 | 1:8 | + | 1:2 | + | 1:1 | 1:1 | |||||
| 3 | + | 1:64 | + | 1:32 | 1:2 | + | 1:32 | + | 1:16 | 1:1 | + | 1:4 | + | 1:4 | 1:1 | |||||
| 4 | + | 1:16 | + | 1:4 | 1:4 | + | 1:4 | + | 1:1 | 1:2 | + | 1:4 | + | 1:2 | 1:1 | |||||
| 5 | + | 1:8 | + | 1:4 | 1:2 | + | 1:2 | + | 1:1 | 1:1 | + | 1:1 | + | 1:1 | 1:1 | |||||
| 6 | + | 1:32 | + | 1:8 | 1:4 | + | 1:8 | + | 1:4 | 1:2 | + | 1:2 | + | 1:1 | 1:1 | |||||
| 7 | + | 1:64 | + | 1:8 | 1:4 | + | 1:32 | + | 1:4 | 1:2 | + | 1:4 | + | 1:2 | 1:1 | |||||
| 8 | + | 1:32 | + | 1:16 | 1:64 | + | 1:16 | + | 1:8 | 1:16 | + | 1:4 | + | 1:2 | 1:2 | |||||
| 9 | + | 1:32 | + | 1:16 | 1:8 | + | 1:16 | + | 1:8 | 1:4 | + | 1:4 | + | 1:2 | 1:2 | |||||
9例患者查头颅MRI,1例患者正常。2例患者基底节区呈现急性脑梗死表现。1例患者有硬膜下积液,6例患者显示脑沟、脑裂和脑池增宽,脑室扩大。2例患者单侧或者双侧的颞叶海马萎缩,1例患者显示椎间盘突出或膨出,节段硬脊膜囊受压。1例患者皮质下小缺血灶。2例患者脑内多发梗死灶。9例患者均查脑电图,大多可见双侧大脑半球弥漫性θ波和δ波,1例痫样发作,6例中-重度异常,2例正常。9例患者所查脑脊液白细胞计数均高于正常,最低0.001×109/L,最高0.25×109/L。9例患者中脑脊液蛋白定性的潘氏试验阳性8例,8例患者蛋白质定量增高,最低值340.5 mg/L,最高值2 661.1 mg/L。所有患者的糖和氯化物基本正常。见表 4。
| 编号 | MRI结果 | 脑电图 | 颜色 | 潘氏试验 | 细胞数 (109/L) |
氯 (mmol/L) |
糖 (mmol/L) |
总蛋白 (mg/L) |
| 1 | 脑沟、脑裂和脑池增宽,脑室扩大。右侧颞顶部及左侧大脑半球内板下硬膜下积液 | 双侧大脑半球可见中-高波幅θ波和δ波 | 淡红 | + | 0.04 | 126 | 3.8 | 1 183.5 |
| 2 | 双侧额、顶叶皮质下小缺血灶 | 双侧大脑半球可见弥漫性θ波和δ波 | 清 | + | 0.25 | 113 | 3.6 | 2 661.1 |
| 3 | 脑沟、脑裂和脑池增宽,脑室扩大,颞叶海马萎缩 | 双侧大脑半球偶见中波幅α波,多见低波幅θ波 | 清 | - | 0.001 | 131 | 3.4 | 490.8 |
| 4 | 脑内多发梗死灶,右侧基底节区见急性腔隙梗死表现。脑沟、脑裂和脑池增宽,脑室扩大 | 双侧大脑半球可见低﹣中波幅θ波和δ波,以右侧多见,尤其以中央、中颞为主 | 清 | + | 0.07 | 120 | 3.5 | 824.1 |
| 5 | 右基底节区急性脑梗死。脑沟、脑裂和脑池增宽,脑室扩大 | 双侧大脑半球可见低-中波幅θ波和δ波 | 清 | + | 0.008 | 128 | 3.2 | 1 435.7 |
| 6 | 脑沟、脑裂和脑池增宽,脑室扩大,右颞叶海马萎缩 | 双侧大脑半球弥漫性中-高波幅θ波和δ波 | 清 | + | 0.012 | 129 | 4.0 | 630.5 |
| 7 | 脑沟、脑裂和脑池增宽,脑室扩大 | 痫样发作 | 清 | + | 0.05 | 127 | 3.9 | 340.5 |
| 8 | 脊髓MRI显示C4-5, C5-6, L4-5椎间盘突出或膨出 | 未见明显异常 | 清 | + | 0.025 | 132 | 3.5 | 782.8 |
| 9 | 矢状位胸4-5水平髓内T1加权像呈低信号,增强后病灶明显强化。横断面T2加权像呈高信号 | 未见明显异常 | 清 | + | 0.015 | 126 | 3.7 | 966.2 |
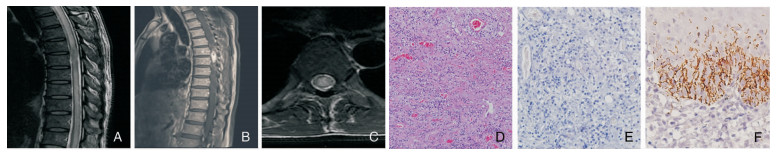
|
| A:矢状位胸4-5水平髓内T1加权像呈低信号;B:增强后病灶明显强化;C:横断面胸4-5水平髓内T2加权像呈高信号;D:脊髓组织间质大量中性粒细胞、浆细胞及淋巴细胞浸润,伴组织细胞水肿、局部组织坏死、血管周围炎(HE染色,10×10);E:脊髓组织梅毒螺旋体免疫组化为阴性;F:皮肤组织梅毒螺旋体免疫组化为阳性。 图 1 病例9的脊髓MRI、脊髓和皮肤的病理结果 |
神经梅毒是由苍白密螺旋体感染人体中枢神经系统所致,其诊断一直无金标准。美国疾控中心提出:神经梅毒除了实验室依据外,还需要有神经梅毒的症状和体征。因此,症状和体征在诊断神经梅毒中具有重要地位。Drago等[10]收集137篇文章,分析286名病人,证实神经梅毒临床表现通常不典型。不典型神经梅毒可以表现为癫痫[11]、头痛[12]、局灶性麻痹、耳聋、眼萎缩、睑下垂、共济失调[5, 6]、帕金森病[6, 13]、不自主运动[14]、肌张力障碍[15]等。共济失调是一种常见,但易被忽视的体征,神经梅毒引起的共济失调研究较少,本研究初步探讨了以共济失调为首发表现的神经梅毒临床特征。
本研究发现,以共济失调为首发表现的神经梅毒,男性多见,病程长短不一,可以短至1 d,也可长达2年。发病年龄在39~76岁,集中在40岁和70岁左右较多。本研究发现共济失调以双下肢共济失调为多见,也可累及偏侧肢体和双上肢。虽然患者是以共济失调为首发症状,但其它伴随症状对于诊断神经梅毒具有重要提示作用,本研究发现其伴随症状有人格障碍、认知障碍、言语障碍、头晕、跌倒、感觉障碍、肢体疼痛、发热和大小便功能障碍,未发现伴随有头痛。
本研究发现,在静态姿势和步态项目的评分中,神经梅毒组患者睁眼时身体站立能力差、睁眼和闭眼时身体摇晃程度明显。在动态肢体协调项目的评分中,脑梗死组患者的跟膝胫试验(动作分裂和意向性震颤)完成差、指鼻试验(动作分裂和辨距不良)完成差、指鼻试验(手指意向性震颤)完成差、绘阿基米德螺旋图形完成差,总体动态肢体协调完成差。换句话说,神经梅毒患者的共济失调以静态姿势和步态损害为显著,而脑梗死患者的共济失调以动态肢体协调的损害为显著。Ikeda等[16]报道1例神经梅毒患者存在小脑性共济失调,包括构音障碍,共济失调步态和双侧意向性震颤,但作者未对步态、构音、震颤进行对比分析研究。Shah等[17]综述了神经梅毒的运动障碍,Duchenne是首次使用术语“共济失调”来描述梅毒患者的平衡和步态受损,Charcot进一步扩展。在神经梅毒描述小脑性共济失调的报告很少,目前更没有与脑梗死共济失调对比的文献报道。本研究还发现,在共济失调总分数中,与脑梗死组比较,神经梅毒组患者评分低,也就是说,神经梅毒共济失调往往不如脑梗死共济失调症状表现得显著,具有较强的隐匿性。
神经梅毒患者的头颅MRI表现多样,但无特异性。本组患者的头颅MRI发现2例患者基底节区呈现急性脑梗死表现,1例患者脑内多发梗死灶,1例患者皮质下小缺血灶。1例患者脊髓MRI显示T2加权序列的高信号灶。Brisset等[18]发现1例患者脑核磁共振成像显示T2加权序列的双侧颞叶、脑岛、额叶高信号灶,主要是由于增生性小动脉内膜炎引起小动脉闭塞致脑实质损伤[17]。6例患者显示脑沟、脑裂和脑池增宽,脑室扩大。2例患者颞叶海马萎缩,可能与梅毒广泛侵袭大脑神经元,诱导神经元凋亡有关。1例脊髓痨的患者未见脊髓弥漫性肿胀,亦未见髓内异常信号,仅表现为脊柱退行性变,可能与梅毒螺旋体导致闭塞性小动脉内膜炎,脊髓出现坏死、炎症和脱髓鞘改变的程度尚较轻。6例患者的脑电图均发现弥漫性θ波和δ波,提示大脑皮质广泛受累,考虑与梅毒感染后引起神经元电生理活动紊乱相关。
病例9的脊髓组织HE染色提示:脊髓组织间质大量中性粒细胞、浆细胞及淋巴细胞浸润,伴组织细胞水肿、局部组织坏死、血管周围炎。虽然在其皮肤组织中,经免疫组化找到梅毒螺旋体,但是在脊髓组织中,运用免疫组化技术反复染色,均未找到梅毒螺旋体。脊髓组织内病原体直接检出率很低,可能因为脊髓梅毒性肉芽肿为梅毒螺旋体抗原成份所诱导的迟发型变态反应。
血清和脑脊液TPPA和TRUST,对于诊断神经梅毒具有良好的灵敏度和特异性,脑脊液VDRL曾被认为是诊断神经梅毒的重要指标,其特异性98%,敏感性30%~78%,脑脊液TPPA和脑脊液VDRL诊断一致性为71.9%。也有认为脑脊液TRUST可以代替VDRL诊断神经梅毒[19]。本组患者的血清和脑脊液的TPPA和TRUST均阳性,两者联合可确诊神经梅毒。本组患者VDRL均阳性。随着治疗的进程,患者TPPA一直阳性,但TRUST和VDRL滴度呈进行性下降。
脑脊液检查是诊断神经梅毒的必要依据之一。本研究发现,9例患者所查脑脊液白细胞计数均高于正常,最低0.001×109/L,最高0.25×109/L。9例患者中脑脊液蛋白定性的潘氏试验阳性8例,8例患者蛋白质定量增高,最低值340.5 mg/L,最高值2 661.1 mg/L。所有患者的糖和氯化物基本正常。
在以共济失调为首发表现的神经梅毒中,有累及脑脊膜型,有脑膜血管型,也有累及脑实质型。对于合并有精神异常和认知障碍,累及双上肢或者双下肢或者偏侧肢体、以损害静态姿势和步态为主的共济失调患者,需要考虑神经梅毒的可能。
致谢: 感谢上海市皮肤病医院病理科刘业强教授对病理研究的技术支持。
| [1] |
Crozatti LL, de Brito MH, Lopes BN, et al. Atypical behavioral and psychiatric symptoms:Neurosyphilis should always be considered[J]. Autops Case Rep, 2015, 5(3): 43-47. DOI:10.4322/acr.2015.021 |
| [2] |
Mehrabian S, Raycheva MR, Petrova EP, et al. Neurosyphilis presenting with dementia, chronic chorioretinitis and adverse reactions totreatment:a case report[J]. Cases J, 2009, 1(2): 8334-8337. |
| [3] |
Cecilia TC, MacPherson PA. Neurocognitive and psychiatric changes as the initial presentation of neurosyphilis[J]. CMAJ, 2013, 185(6): 499-503. DOI:10.1503/cmaj.121146 |
| [4] |
McAuley J, Hughes G. Neurosyphilis presenting as parkinsonism[J]. BMJ Case Rep, 2015, 28(9): 1-4. |
| [5] |
Pandey S. Magnetic resonance imaging of the spinal cord in a man with tabes dorsalis[J]. J Spinal Cord Med, 2011, 34(6): 609-611. DOI:10.1179/2045772311Y.0000000041 |
| [6] |
Liis S, Mark B, Pille T. Neurosyphilis as a great imitator:a case report[J]. BMC Res Notes, 2016, 9(1): 372. DOI:10.1186/s13104-016-2176-2 |
| [7] |
Carr J. Neurosyphilis[J]. Pract Neurol, 2003, 3(6): 328-341. DOI:10.1111/pnr.2003.3.issue-6 |
| [8] |
陈伟群, 王新德. 全国第五届脑血管病学术会议纪要[J]. 中华神经科杂志, 2000, 4(33): 110-114. |
| [9] |
Trouillas P, Takayanagi T, Hallett M, et al. International Cooperative Ataxia Rating Scale for pharmacological assessment of the cerebellar syndrome. The Ataxia Neuropharmacology Committee of the World Federation of Neurology[J]. J Neurol Sci, 1997, 145(2): 205-211. DOI:10.1016/S0022-510X(96)00231-6 |
| [10] |
Drago F, Merlo G, Ciccarese G, et al. Changes in neurosyphilis presentation:a survey on 286 patients[J]. J Eur Acad Dermatol Venereol, 2016, 30(11): 1886-1900. |
| [11] |
Kyebambe PS. Neurosyphilis masquerading as hemiparesis and Jacksonian epilepsy in an HIV positive patient:a case report[J]. Afr Health Sci, 2010, 10(2): 211. |
| [12] |
Asdaghi N, Muayqil T, Scozzafava J, et al. The re-emergence in Canada of meningovascular syphilis:2 patients with headache and stroke[J]. CMAJ, 2007, 176(12): 1699-1700. DOI:10.1503/cmaj.070371 |
| [13] |
赵二义, 王带媚, 文国强, 等. 以帕金森综合征为主要表现的神经梅毒8例临床分析[J]. 中国神经精神疾病杂志, 2015, 41(10): 607-612. DOI:10.3969/j.issn.1002-0152.2015.10.006 |
| [14] |
Lenka A, Thota N, Stezin A, et al. Orofacial Involuntary Movements in Neurosyphilis:Beyond the Candy Sign[J]. Tremor Other Hyperkinet Mov (NY), 2017, 5(7): 507-509. |
| [15] |
张薇, 王涛, 王佳君, 等. 神经梅毒面部肌张力障碍表现一例[J]. 中华神经科杂志, 2017, 50(10): 771-773. DOI:10.3760/cma.j.issn.1006-7876.2017.10.013 |
| [16] |
Ikeda S, Yakushiji Y, Eriguchi M, et al. Neurosyphilis with cerebellar ataxia, personality change and cognitive decline one year after onset of cerebral infarction[J]. Rinsho Shinkeigaku, 2018, 58(8): 499-504. DOI:10.5692/clinicalneurol.cn-001170 |
| [17] |
Shah BB, Lang AE. Acquired neurosyphilis presenting as movement disorders[J]. Mov Disord, 2012, 27(6): 690-695. DOI:10.1002/mds.v27.6 |
| [18] |
Brisset M, Chadenat ML, Cordoliani Y, et al. MRI features of neurosyphilis[J]. Rev Neurol (Paris), 2011, 167(4): 337-342. DOI:10.1016/j.neurol.2010.08.012 |
| [19] |
Gu W, Yang Y, Wu L, et al. Comparing the performance characteristics of CSF-TRUST and CSF-VDRL for syphilis:a cross-sectional study[J]. BMJ Open, 2013, 3(2): 1-5. |
 2019, Vol. 46
2019, Vol. 46




