扩展功能
文章信息
- 潘楚政, 武斌, 刘丽, 唐显毕
- Pan Chu-Zheng, Wu Bin, Liu Li, Tang Xian-Bi
- 载脂蛋白E基因多态性与路易体痴呆关系的Meta分析
- A meta-analysis of the relationship between APOE gene polymorphism and dementia with Lewy bodies
- 国际神经病学神经外科学杂志, 2019, 46(3): 275-281
- Journal of International Neurology and Neurosurgery, 2019, 46(3): 275-281
-
文章历史
收稿日期: 2018-12-12
修回日期: 2019-05-26
路易体痴呆(dementia with Lewy bodies, DLB)是一种在老年人群中常见的神经退行性疾病,临床主要表现为波动性认知障碍、帕金森综合征和以视幻觉为突出表现的精神症状[1]。在神经变性病所致的痴呆中,DLB发病率仅次于阿尔茨海默病位居第二位[2]。DLB典型的病理改变为路易小体,路易小体的主要成分是α-突触核蛋白和泛素[3]。研究表明,一些基因变异如H1G和H2单体型等与DLB患病率相关[4]。载脂蛋白E(apolipoprotein E, APOE)基因位于第19号染色体,主要参与脂质代谢[5]。APOE基因共包括3个等位基因:ε2(Cys-112/Cys-158)、ε3(Cys-112/Arg-158)和ε4(Arg-112/Arg-158),分为ε3ε3、ε2ε3、ε2ε2、ε3ε4、ε4ε4和ε2ε4共6种基因型[6]。有研究表明,APOE基因多态性与神经退行性疾病密切相关[7]。目前已有多项关于APOE基因与DLB相关性的病例对照研究,但两者的关系在不同研究间仍存在争议,例如某些研究发现,APOE ε4增加了DLB的患病风险[8-10],但是也有研究显示阴性结果[11]。同时,ε2与DLB的关系也尚不明确[8, 9, 12]。
目前尚未有APOE基因多态性与DLB易感性的Meta分析。本文对既往大样本病例对照研究进行综合,通过Meta分析的方法探索APOE基因多态性与DLB的关系,旨在为DLB遗传易感性提供循证学证据。
1 资料与方法 1.1 纳入与排除标准纳入标准:①国内外公开发表的关于APOE基因多态性与DLB关系的临床研究;②研究设计为病例对照研究;③文献中一般资料齐全,数据完整;④限英文和中文;⑤研究对象为经临床明确诊断为DLB的患者;⑥结局指标为DLB患病率。
排除标准:①重复发表文献;②原始数据不能运用,联系作者也不能获得有用数据者;③仅有摘要的会议汇编、非病例对照研究、全基因组关联分析、动物实验或综述类文献。
1.2 文献检索在检索过程中分别以载脂蛋白E(APOE)基因、路易体痴呆(dementia with Lewy Bodies, DLB)、基因多态性(polymorphism, variant, mutation)等中英文相关词组为检索词,检索美国国立医学图书馆生物医学信息检索系统(PubMed)、荷兰医学文摘(EMBASE)、Cochrane图书馆以及中国知识基础设施工程(CNKI)等国内外知名数据库发表的关于APOE基因多态性与DLB关系的病例对照研究,同时查找和阅读相关研究和综述的参考文献,以避免漏检相关文献。检索时间截止至2018年4月。检索到的文献缺乏临床资料者,通过电话、邮件与作者或通讯作者联系,获取并补充相关信息。
1.3 文献筛选由两位相互独立的评估者根据纳入和排除标准,分别对文献进行筛选、提取资料并评估文献质量,如遇分歧则讨论解决或交由第3人协助裁定。
1.4 文献质量评估根据Newcastle-Ottawa文献质量评价表(NOS)对所纳入的文献进行方法学质量评价。该量表共包含8个条目,分别是研究对象选择4个条目(共计4分),组间可比性1个条目(共计2分),结果的测量3个条目(共计3分),总计9分,评分>5分者为高质量文献、评分≤5分者为低质量文献,予以排除。
1.5 数据提取提取内容主要包括:①纳入研究的基本信息,如第一作者,发表时间、国家等;②质量评估的关键要素;③病例组和对照组基因型频率。
1.6 统计分析方法采用Cochrane协作网提供的RevMan 5.3统计软件进行Meta分析。计数资料采用合并的以比值比(OR)和95%可信区间(95%CI)来描述多个研究的合并结果,并根据人群分别采用亚组分析,P < 0.05认为差异有统计学意义。对各研究间进行异质性检验,根据异质性大小选择固定效应模型或随机效应模型进行数据合并。当I2>50%和P < 0.10时,即存在异质性,采用随机效应模型进行合并效应分析;当I2≤50%和P≥0.10时,即无异质性,采用固定效应模型进行合并效应分析。绘制漏斗图对所纳入文献的潜在发表偏倚进行评估,采用逐一剔除的方法评估研究结果的稳定性。
2 结果 2.1 文献检索结果共检索到301篇可能相关文献,其中PubMed 118篇、EMBASE 177篇、Cochrane图书馆1篇、CNKI 5篇;排除60篇重复文献,通过阅读文题和摘要排除了173篇文献;剩下的68篇文献通过阅读全文进一步筛查,排除了43篇不符合纳入标准的文献以及4篇NOS≤5分的文献[13-16],最终入选21篇文献[8, 9, 11, 12, 17-33](图 1)。21项研究共纳入7450例受试者,其中DLB患者1178例,对照组6272例,其中17篇研究对象为高加索人群(表 1)。
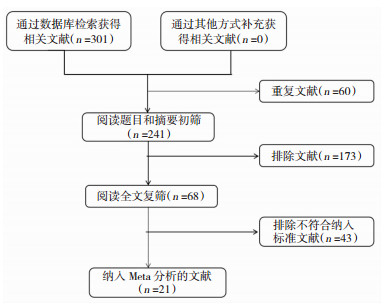
|
| 图 1 文献筛选流程图 |
| 作者 | 发表 年份 |
国家/ 人种 |
样本量(病例/对照) | DLB | 正常人 | |||||||||||||||||||
| ε2ε2 | ε2ε3 | ε2ε4 | ε3ε3 | ε3ε4 | ε4ε4 | ε4+* | ε2 | ε3 | ε4 | ε2ε2 | ε2ε3 | ε2ε4 | ε3ε3 | ε3ε4 | ε4ε4 | ε4+ | ε2 | ε3 | ε4 | |||||
| Singleton, A. B.[8] | 2002 | 英国 | 76/111 | 0 | 7 | 4 | 24 | 36 | 5 | 45 | 11 | 91 | 50 | 0 | 19 | 2 | 65 | 24 | 1 | 27 | 21 | 173 | 28 | |
| Lovati, C. [11] | 2010 | 意大利 | 40/735 | 0 | 4 | 0 | 25 | 11 | 0 | 11 | 4 | 65 | 11 | 1 | 29 | 10 | 382 | 267 | 46 | 323 | 41 | 1 060 | 369 | |
| Kobayashi, S. [9] | 2011 | 日本 | 50/279 | 0 | 5 | 2 | 24 | 16 | 3 | 21 | 7 | 69 | 24 | 0 | 20 | 2 | 208 | 46 | 3 | 51 | 22 | 482 | 54 | |
| Keogh, M. J. [36] | 2016 | 英国 | 87/93 | 0 | 6 | 0 | 33 | 45 | 3 | 48 | 6 | 117 | 51 | 2 | 12 | 0 | 54 | 24 | 1 | 25 | 16 | 144 | 26 | |
| Fehér, á. [32] | 2009 | 匈牙利 | 35/175 | 0 | 1 | 0 | 16 | 17 | 1 | 18 | 1 | 50 | 19 | 2 | 25 | 0 | 125 | 19 | 4 | 23 | 29 | 294 | 27 | |
| Chen, K. L. [33] | 2016 | 中国 | 44/1 149 | 0 | 3 | 0 | 31 | 9 | 1 | 10 | 3 | 74 | 11 | 8 | 154 | 21 | 802 | 156 | 8 | 185 | 191 | 1914 | 193 | |
| Borroni, B. [30] | 2006 | 意大利 | 82/81 | 0 | 4 | 0 | 47 | 26 | 5 | 31 | 4 | 124 | 36 | 0 | 5 | 0 | 58 | 17 | 1 | 18 | 5 | 138 | 19 | |
| Berge, G. [12] | 2014 | 挪威 | 156/643 | 1 | 7 | 7 | 64 | 63 | 14 | 84 | 16 | 196 | 100 | 4 | 105 | 23 | 365 | 131 | 17 | 171 | 136 | 965 | 185 | |
| Zintl, M. [23] | 2009 | 德国 | 6/54 | 0 | 0 | 0 | 3 | 3 | 0 | 3 | 0 | 9 | 3 | 0 | 12 | 1 | 33 | 8 | 0 | 9 | 13 | 86 | 9 | |
| Tsuang, D. [24] | 2013 | 美国 | 91/269 | 1 | 6 | 8 | 37 | 28 | 11 | 47 | 16 | 108 | 58 | 3 | 37 | 3 | 192 | 32 | 2 | 37 | 46 | 453 | 39 | |
| Nielsen, A. S. [25] | 2003 | 荷兰 | 12/163 | 0 | 2 | 1 | 7 | 2 | 0 | 3 | 3 | 18 | 3 | 3 | 19 | 2 | 102 | 37 | 0 | 39 | 27 | 260 | 39 | |
| Kalman, J. [26] | 2003 | 高加索人 | 37/51 | 0 | 1 | 0 | 17 | 18 | 1 | 19 | 1 | 53 | 20 | 0 | 6 | 0 | 38 | 6 | 1 | 7 | 6 | 88 | 8 | |
| Jairani, P. S. [27] | 2016 | 印度 | 12/138 | 0 | 1 | 1 | 7 | 2 | 1 | 4 | 2 | 17 | 5 | 5 | 8 | 3 | 82 | 34 | 6 | 43 | 21 | 206 | 49 | |
| Skillbäck, T. [28] | 2018 | 瑞典 | 13/1 265 | 0 | 1 | 1 | 6 | 4 | 1 | 6 | 2 | 17 | 7 | 10 | 140 | 28 | 760 | 296 | 31 | 355 | 188 | 1 956 | 386 | |
| Rowe, C. C. [22] | 2007 | 澳大利亚 | 9/27 | 0 | 0 | 0 | 2 | 6 | 1 | 7 | 0 | 10 | 8 | 0 | 6 | 1 | 13 | 6 | 1 | 8 | 7 | 38 | 9 | |
| St Clair, D. [19] | 1994 | 英国 | 39/47 | - | - | - | - | - | - | - | 3 | 48 | 27 | - | - | - | - | - | - | - | 3 | 79 | 12 | |
| Benjamin, R. [18] | 1995 | 英国 | 28/46 | - | - | - | - | - | - | - | 5 | 31 | 20 | - | - | - | - | - | - | - | 7 | 71 | 14 | |
| Struyfs, H. [29] | 2015 | 比利时 | 16/11 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 3 | - | - | - | |
| Nervi, A. [21] | 2008 | 美国 | 159/364 | - | - | - | - | - | - | 62 | - | - | - | - | - | - | - | - | - | 93 | - | - | - | |
| Sohma, H. [20] | 2013 | 日本 | 50/279 | - | - | - | - | - | - | 21 | - | - | 27 | - | - | - | - | - | - | 51 | - | - | 57 | |
| Boot, B. P. [17] | 2013 | 美国 | 136/292 | - | - | - | - | - | - | 83 | - | - | 136 | - | - | - | - | - | - | 140 | - | - | 175 | |
| 注:* ε4+: APOE ε4携带者;“-”表示情况不明 | ||||||||||||||||||||||||
在ε4等位基因相关的比较模型中,结果显示差异均有统计学意义:ε4 vs. ε3(OR=2.51, 95%CI: 1.87~3.38, P < 0.001)、ε4 vs. ε2(OR=2.71, 95%CI: 1.73~4.26, P=0.007)、ε4 vs. ε2+ε3+ε4(OR=2.14, 95%CI: 1.74~2.63, P=0.001)、ε4携带者vs. ε2+ε3+ε4携带者(OR=1.88, 95%CI: 1.52~2.31, P < 0.001)。在ε4相关基因型的比较模型中,结果显示差异均有统计学意义:ε4ε4 vs. ε3ε3(OR=4.24, 95%CI: 2.79~6.43, P < 0.001)、ε3ε4 vs. ε3ε3(OR=2.58, 95%CI: 1.80~3.70, P < 0.001)、ε3ε4+ε4ε4 vs. ε3ε3(OR=2.70, 95%CI: 1.86~3.93, P < 0.001)、ε4ε4 vs. ε3ε3+ε3ε4(OR=3.25, 95%CI: 2.14~4.95, P < 0.001)。综上,在所有关于APOE ε4的比较模式中,我们发现ε4为危险因素(表 2)。等位基因ε4 vs. ε3森林图见图 2。
| 等位基因 | 纳入 研究数 |
样本量 (病例/对照) |
关联分析 | 异质性 | 模型 | |||
| OR(95%CI) | P | I2 | P | |||||
| ε4 vs. ε3等位基因 | 17 | 817/5 326 | 2.51(1.87, 3.38) | <0.001 | 70% | <0.001 | 随机效应 | |
| ε4 vs. ε2等位基因 | 17 | 817/5 326 | 2.71(1.73, 4.26) | 0.007 | 52% | <0.001 | 随机效应 | |
| ε4 vs. ε2+ε3+ε4等位基因 | 19 | 1 003/5 897 | 2.14(1.74, 2.63) | 0.001 | 56% | <0.001 | 随机效应 | |
| ε4 vs. ε2+ε3+ε4携带者 | 19 | 1 111/6 179 | 1.88(1.52, 2.31) | <0.001 | 49% | 0.008 | 随机效应 | |
| ε4ε4 vs ε3ε3 | 15 | 750/5 226 | 4.24(2.79, 6.43) | <0.001 | 16% | 0.28 | 固定效应 | |
| ε3ε4 vs ε3ε3 | 15 | 750/5 227 | 2.58(1.80, 3.70) | <0.001 | 62% | <0.001 | 随机效应 | |
| ε3ε4+ε4ε4 vs ε3ε3 | 15 | 750/5 228 | 2.70(1.86, 3.93) | <0.001 | 68% | <0.001 | 随机效应 | |
| ε4ε4 vs ε3ε3+ε3ε4 | 15 | 750/5 229 | 3.25(2.14, 4.95) | <0.001 | 0% | 0.45 | 固定效应 | |
| ε2 vs. ε3等位基因 | 17 | 817/5 326 | 0.84(0.66, 1.08) | 0.18 | 25% | 0.17 | 固定效应 | |
| ε2 vs. ε2+ε3+ε4等位基因 | 17 | 817/5 326 | 0.60(0.54, 0.89) | 0.004 | 24% | 0.19 | 固定效应 | |
| ε2 vs. ε2+ε3+ε4携带者 | 15 | 750/5 225 | 0.69(0.53, 0.90) | 0.007 | 27% | 0.16 | 固定效应 | |
| ε2ε2 vs ε3ε3 | 15 | 750/5 226 | 1.37(0.54, 3.48) | 0.5 | 0% | 0.96 | 固定效应 | |
| ε2ε3 vs ε3ε3 | 15 | 750/5 227 | 0.76(0.55, 1.05) | 0.51 | 0% | 0.1 | 固定效应 | |
| ε2ε3+ε2ε2 vs ε3ε3 | 15 | 750/5 228 | 0.75(0.54, 1.03) | 0.08 | 0% | 0.58 | 固定效应 | |
| ε2ε2vs.ε3ε3+ε2ε3 | 15 | 750/5 229 | 1.43(0.56, 3.62) | 0.45 | 0% | 0.97 | 固定效应 | |
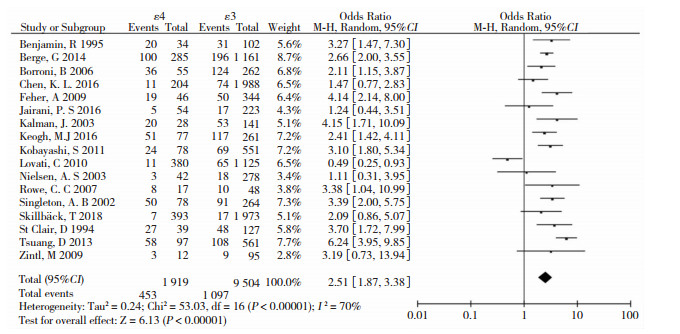
|
| 图 2 等位基因ε4与ε3患病风险比较的森林图 |
等位基因ε2仅在等位基因ε2 vs. ε2+ε3+ε4(OR=0.69, 95%CI: 0.54~0.89, P=0.004)和ε2携带者vs. ε2+ε3+ε4(OR=0.69, 95%CI: 0.53~0.90, P=0.007)中有差异(表 2)。等位基因ε2 vs. ε3森林图见图 3。
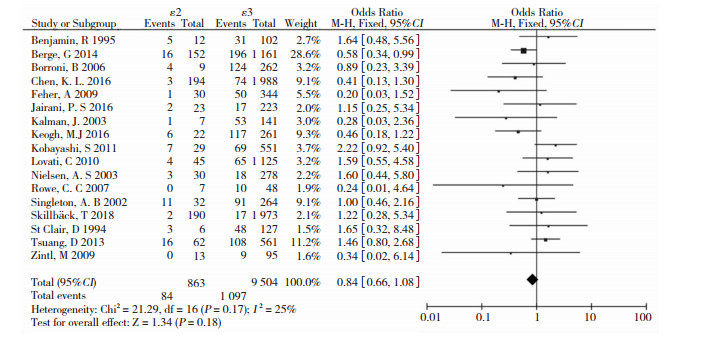
|
| 图 3 等位基因ε2与ε3患病风险比较的森林图 |
由于亚洲相关文献有限,我们仅在高加索人群中进行亚组分析。在高加索人群中,分析结果基本相似,参见表 3。
| 比较 | 纳入 研究数 |
样本量 (病例/对照) |
关联分析 | 异质性 | 模型 | |||
| OR(95%CI) | P | I2 | P | |||||
| ε4 vs. ε3等位基因 | 14 | 711/3 760 | 2.67(1.90, 3.47) | <0.001 | 0.72 | <0.001 | 随机效应 | |
| ε4 vs. ε2等位基因 | 14 | 711/3 760 | 2.99(1.78, 5.04) | <0.001 | 0.55 | <0.001 | 随机效应 | |
| ε4 vs. ε2+ε3+ε4等位基因 | 15 | 847/4 061 | 2.17(1.69, 2.79) | <0.001 | 0.63 | <0.001 | 随机效应 | |
| ε4 vs. ε2+ε3+ε4携带者 | 15 | 955/4 343 | 1.86(1.46, 2.43) | <0.001 | 0.58 | 0.003 | 随机效应 | |
| ε4ε4 vs ε3ε3 | 12 | 644/3 659 | 4.23(2.69, 6.64) | <0.001 | 0.31 | 0.160 | 固定效应 | |
| ε3ε4 vs ε3ε3 | 12 | 644/3 659 | 2.84(1.87, 4.30) | <0.001 | 0.66 | <0.001 | 随机效应 | |
| ε3ε4+ε4ε4 vs ε3ε3 | 12 | 644/3 659 | 2.96(1.91, 4.58) | <0.001 | 0.71 | <0.001 | 随机效应 | |
| ε4ε4 vs ε3ε3+ε3ε4 | 12 | 644/3 659 | 3.31(2.14, 5.13) | <0.001 | 0.15 | 0.300 | 固定效应 | |
| ε2 vs. ε3等位基因 | 14 | 711/3 760 | 0.82(0.63, 1.08) | 0.160 | 0.15 | 0.290 | 固定效应 | |
| ε2 vs. ε2+ε3+ε4等位基因 | 14 | 711/3 760 | 0.66(0.50, 0.86) | 0.003 | 0.16 | 0.280 | 固定效应 | |
| ε2 vs. ε2+ε3+ε4携带者 | 12 | 644/3 659 | 0.65(0.48, 0.87) | 0.004 | 0.2 | 0.250 | 固定效应 | |
| ε2ε2 vs ε3ε3 | 12 | 644/3 659 | 1.42(0.50, 4.02) | 0.510 | 0 | 0.880 | 固定效应 | |
| ε2ε3 vs ε3ε3 | 12 | 644/3 659 | 0.71(0.49, 1.03) | 0.070 | 0 | 0.630 | 固定效应 | |
| ε2ε3+ε2ε2 vs ε3ε3 | 12 | 644/3 659 | 0.71(0.50, 1.02) | 0.060 | 0 | 0.700 | 固定效应 | |
| ε2ε2vs.ε3ε3+ε2ε3 | 12 | 644/3 659 | 1.49(0.52, 4.22) | 0.450 | 0 | 0.890 | 固定效应 | |
采用逐个排除的方法进行敏感性分析。仅等位基因ε2 vs. ε2+ε3+ε4和ε2携带者vs. ε2+ε3+ε4这两个比较模型在排除Berge等[12]研究后,结果由有差异变为无差异,而其余比较模型中效应量均无明显变化,纳入研究结果无明显异质性,提示该研究结果稳定性好。纳入文献的漏斗图呈对称性,提示不存在发表偏倚,等位基因ε4 vs. ε3漏斗图见图 4。
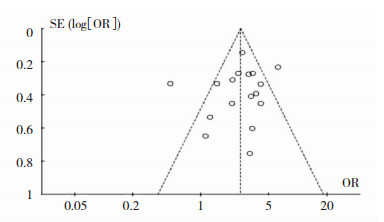
|
| 图 4 等位基因ε4与ε3患病风险比较的漏斗图 |
APOE基因编码载脂蛋白E,这是一种参与脂质结合、转运和受体介导胞吞作用的蛋白质[5]。载脂蛋白E通过影响淀粉样蛋白β的聚集和清除从而增加阿尔茨海默病易感性,同时它可能还参与了tau磷酸化、神经可塑性和神经炎症等其他神经退行性疾病病理过程[34, 35]。
早在20年前,有研究发现,APOE ε4等位基因与DLB发病有关[18],这一结论在许多研究中得到了证实[8-11, 36]。同时,最近一项的关于DLB的GWAS研究表明APOE基因位点与DLB具有相关性[37]。Berge等[12]研究发现,ε2等位基因在DLB中具有保护作用。但这一结论并未在其他研究中得到证实[8-11, 36]。本研究发现APOE ε4等位基因增加了DLB患病风险,并且携带ε4等位基因数量越多,患病风险越大。而APOE ε2等位基因与DLB无明显相关性。
APOE基因和DLB之间的关联机制目前尚不清楚。Gomperts等[38]发现,APOE ε4与DLB患者大脑中的淀粉样蛋白沉积有关。然而,在无或较少阿尔茨海默病相关病理改变的DLB患者中,DLB患病风险依然与APOE ε4呈很强相关性[12],这表明除了淀粉样蛋白途径外,APOE基因可能还参与其他痴呆相关的病理途径。体外研究发现,极低水平的载脂蛋白E能够导致α-突触核蛋白聚集,这可能是α-突触核蛋白诱导神经变性的潜在发病机制[39]。
在本研究中,比较模型的灵敏度分析结果是一致和稳定的。在APOE ε4比较模型中,Meta分析结果均显示APOE ε4与DLB患病风险显著相关。在等位基因ε2 vs.ε2+ε3+ε4和ε2携带者vs. ε2+ε3+ε4比较模型的一致性分析中,排除Berge等[12]的研究后,结果变为无明显差异,表明结果为不可靠,应谨慎对待。因此本研究发现ε2与DLB易感性无明显相关性。
不过,本研究存在以下局限性:①纳入分析的21项病例对照研究中,7项研究[17-22, 29]未提供确切的等位基因或携带者数据,这可能对分析结果造成影响。②由于对照组来自医院而不是社区、缺少病理学或尸检证实的DLB诊断、临床的复杂性和病理异质性,汇总的研究间存在遗传差异性,因此需要更多的大样本研究来避免假阳性和假阴性结果。③我们的荟萃分析仅包含4篇亚洲人群的文章[9, 20, 27, 33],而17篇文章为基于高加索人群的研究[8, 11, 12, 17-19, 21-26, 28-32]。这些因素都可能造成结论偏差。同时,鉴于DLB病因尚不明确,应该将更多的因素纳入Meta分析,例如发病年龄、性别、病理标准、临床表现、生活习惯以及其他相关基因(如GBA、SNCA等)。
4 结论本研究结果证明APOE基因多态性与DLB具有相关性,APOE ε4是DLB发病的危险因素,APOE ε2与DLB易感性无明显相关性。
| [1] |
周子懿, 吕磊, 蔡定芳. 帕金森病痴呆与路易体痴呆[J]. 国际神经病学神经外科学杂志, 2007, 34(5): 408-411. |
| [2] |
Walker Z, Possin KL, Boeve BF, et al. Lewy body dementias[J]. Lancet (London, England), 2015, 386: 1683-1697. DOI:10.1016/S0140-6736(15)00462-6 |
| [3] |
McKeith IG, Dickson DW, Lowe J, et al. Diagnosis and management of dementia with Lewy bodies:third report of the DLB Consortium[J]. Neurology, 2005, 65: 1863-1872. DOI:10.1212/01.wnl.0000187889.17253.b1 |
| [4] |
Vergouw LJM, van Steenoven I, van de Berg WDJ, et al. An update on the genetics of dementia with Lewy bodies[J]. Parkinsonism Relat Disord, 2017, 43: 1-8. DOI:10.1016/j.parkreldis.2017.07.009 |
| [5] |
Lin-Lee YC, Kao FT, Cheung P, et al. Apolipoprotein E gene mapping and expression:localization of the structural gene to human chromosome 19 and expression of ApoE mRNA in lipoprotein-and non-lipoprotein-producing tissues[J]. Biochemistry, 1985, 24: 3751-3756. DOI:10.1021/bi00335a050 |
| [6] |
Mahley RW, Weisgraber KH, Huang Y. Apolipoprotein E4:a causative factor and therapeutic target in neuropathology, including Alzheimer's disease[J]. Proc Natl Acad Sci U S A, 2006, 103: 5644-5651. DOI:10.1073/pnas.0600549103 |
| [7] |
Lopez MF, Krastins B, Ning M. The role of apolipoprotein E in neurodegeneration and cardiovascular disease[J]. Ex Rev Prot, 2014, 11: 371-381. DOI:10.1586/14789450.2014.901892 |
| [8] |
Singleton AB, Wharton A, O'Brien KK, et al. Clinical and neuropathological correlates of apolipoprotein E genotype in dementia with Lewy bodies[J]. Dement Geriatr Cogn Disord, 2002, 14: 167-175. DOI:10.1159/000066022 |
| [9] |
Kobayashi S, Tateno M, Park TW, et al. Apolipoprotein E4 frequencies in a Japanese population with Alzheimer's disease and dementia with Lewy bodies[J]. PloS One, 2011, 6(4): e18569. DOI:10.1371/journal.pone.0018569 |
| [10] |
Lippa CF, Smith TW, Saunders AM, et al. Apolipoprotein E genotype and Lewy body disease[J]. Neurology, 1995, 45: 97-103. DOI:10.1212/WNL.45.1.97 |
| [11] |
Lovati C, Galimberti D, Albani D, et al. Apoe ε2 and ε4 influence the susceptibility for Alzheimer's disease but not other dementias[J]. Int J Mol Epidemiol Genetics, 2010, 1: 193-200. |
| [12] |
Berge G, Sando SB, Rongve A, et al. Apolipoprotein e ε2 genotype delays onset of dementia with lewy bodies in a Norwegian cohort[J]. J Neurol Neurosurg Psychiatry, 2014, 85: 1227-1231. DOI:10.1136/jnnp-2013-307228 |
| [13] |
Huckvale C, Richardson AM, Mann DM, et al. Debrisoquine hydroxylase gene polymorphism (CYP2D6*4) in dementia with Lewy bodies[J]. J Neurol Neurosurg Psychiatry, 2003, 74: 135-136. DOI:10.1136/jnnp.74.1.135 |
| [14] |
Martinoli MG, Trojanowski JQ, Schmidt ML, et al. Association of apolipoprotein ε4 allele and neuropathologic findings in patients with dementia[J]. Acta Neuropathol, 1995, 90: 239-243. DOI:10.1007/BF00296506 |
| [15] |
Morenas-Rodríguez E, Cervera-Carles L, Vilaplana E, et al. Progranulin protein levels in cerebrospinal fluid in primary neurodegenerative dementias[J]. J Alzheimer's Dis, 2016, 50: 539-546. |
| [16] |
Morris CM, Massey HM, Benjamin R, et al. Molecular biology of APO E alleles in Alzheimer's and non-Alzheimer's dementias[J]. J Neural Transm Suppl, 1996, 47: 205-218. DOI:10.1007/978-3-7091-6892-9 |
| [17] |
Boot BP, Orr CF, Ahlskog JE, et al. Risk factors for dementia with Lewy bodies A case-control study[J]. Neurology, 2013, 81: 833-840. DOI:10.1212/WNL.0b013e3182a2cbd1 |
| [18] |
Benjamin R, Leake A, Ince PG, et al. Effects of apolipoprotein E genotype on cortical neuropathology in senile dementia of the Lewy body and Alzheimer's disease[J]. Neurodegeneration, 1995, 4: 443-448. DOI:10.1006/neur.1995.0053 |
| [19] |
Clair St D, Norrman J, Perry R, et al. Apolipoprotein E ε4 allele frequency in patients with Lewy body dementia, Alzheimer's disease and age-matched controls[J]. Neurosci Letters, 1994, 176: 45-46. DOI:10.1016/0304-3940(94)90867-2 |
| [20] |
Sohma H, Imai SI, Takei N, et al. Evaluation of annexin A5 as a biomarker for Alzheimer's disease and dementia with lewy bodies[J]. Front Aging Neurosci, 2013, 5: 15. |
| [21] |
Nervi A, Reitz C, Tang MX, et al. Comparison of clinical manifestations in Alzheimer disease and dementia with Lewy bodies[J]. Arch Neurol, 2008, 65: 1634-1639. |
| [22] |
Rowe CC, Ng S, Ackermann U, et al. Imaging beta-amyloid burden in aging and dementia[J]. Neurology, 2007, 68: 1718-1725. DOI:10.1212/01.wnl.0000261919.22630.ea |
| [23] |
Zintl M, Schmitz G, Hajak G, et al. ApoE genotype and family history in patients with dementia and cognitively intact spousal controls[J]. Am J Alzheimer's Dis Other Dement, 2009, 24: 349-352. DOI:10.1177/1533317509333040 |
| [24] |
Tsuang D, Leverenz JB, Lopez OL, et al. APOE ε4 increases risk for dementia in pure synucleinopathies[J]. JAMA Neurol, 2013, 70: 223-228. DOI:10.1001/jamaneurol.2013.600 |
| [25] |
Nielsen AS, Ravid R, Kamphorst W, et al. Apolipoprotein E ε4 in an autopsy series of various dementing disorders[J]. J Alzheimer's Dis, 2003, 5: 119-125. DOI:10.3233/JAD-2003-5206 |
| [26] |
Kalman J, Juhasz A, Rimanoczy A, et al. The nitric oxide synthase-3 codon 298 polymorphism is not associated with late-onset sporadic Alzheimer's dementia and Lewy body disease in a sample from Hungary[J]. Psychiatr Genetics, 2003, 13: 201-204. DOI:10.1097/00041444-200312000-00002 |
| [27] |
Jairani PS, Aswathy PM, Gopala S, et al. Interaction with the MAPT H1H1 Genotype Increases Dementia Risk in APOE epsilon4 Carriers in a Population of Southern India[J]. Dementia Geriatric Cognit Disord, 2016, 42: 255-264. DOI:10.1159/000447446 |
| [28] |
Skillbäck T, Lautner R, Mattsson N, et al. Apolipoprotein E genotypes and longevity across dementia disorders[J]. Alzheimer's Dementia, 2018, 14(7): 895-901. DOI:10.1016/j.jalz.2018.02.003 |
| [29] |
Struyfs H, Van Broeck B, Timmers M, et al. Diagnostic Accuracy of Cerebrospinal Fluid Amyloid-β Isoforms for Early and Differential Dementia Diagnosis[J]. J Alzheimer's Dis, 2015, 45: 813-822. DOI:10.3233/JAD-141986 |
| [30] |
Borroni B, Grassi M, Costanzi C, et al. APOE genotype and cholesterol levels in Lewy body dementia and Alzheimer disease:Investigating genotype-phenotype effect on disease risk[J]. American J Geriatr Psychiatry, 2006, 14: 1022-1031. DOI:10.1097/01.JGP.0000225088.29353.08 |
| [31] |
Keogh MJ, Wei W, Wilson I, et al. Genetic compendium of 1511 human brains available through the UK Medical Research Council Brain Banks Network Resource[J]. Genome Res, 2017, 27: 165-173. DOI:10.1101/gr.210609.116 |
| [32] |
Feher A, Juhasz A, Rimanoczy A, et al. Association between BDNF Val66Met polymorphism and Alzheimer disease, dementia with Lewy bodies, and Pick disease[J]. Alzheimer Dis Assoc Disord, 2009, 23: 224-228. DOI:10.1097/WAD.0b013e318199dd7d |
| [33] |
Chen KL, Sun YM, Zhou Y, et al. Associations between APOE polymorphisms and seven diseases with cognitive impairment including Alzheimer's disease, frontotemporal dementia, and dementia with Lewy bodies in southeast China[J]. Psychiatric Genetics, 2016, 26: 124-131. DOI:10.1097/YPG.0000000000000126 |
| [34] |
云霞, 欧吉兵, 李凡, 等. 载脂蛋白E在神经修复中作用机制的研究进展[J]. 国际神经病学神经外科学杂志, 2013, 40(5-6): 481-485. |
| [35] |
Kim J, Basak JM, Holtzman DM. The role of apolipoprotein E in Alzheimer's disease[J]. Neuron, 2009, 63: 287-303. DOI:10.1016/j.neuron.2009.06.026 |
| [36] |
Keogh MJ, Kurzawa-Akanbi M, Griffin H, et al. Exome sequencing in dementia with Lewy bodies[J]. Translat Psychiatry, 2016, 6: e728. DOI:10.1038/tp.2015.220 |
| [37] |
Guerreiro R, Ross OA, Kun-Rodrigues C, et al. Investigating the genetic architecture of dementia with Lewy bodies:a two-stage genome-wide association study[J]. Lancet Neurol, 2018, 17: 64-74. DOI:10.1016/S1474-4422(17)30400-3 |
| [38] |
Gomperts SN, Locascio JJ, Marquie M, et al. Brain amyloid and cognition in Lewy body diseases[J]. Mov Disord, 2012, 27: 965-973. DOI:10.1002/mds.v27.8 |
| [39] |
Emamzadeh FN, Aojula H, McHugh PC, et al. Effects of different isoforms of apoE on aggregation of the alpha-synuclein protein implicated in Parkinson's disease[J]. Neurosci Letters, 2016, 618: 146-151. DOI:10.1016/j.neulet.2016.02.042 |
 2019, Vol. 46
2019, Vol. 46




