扩展功能
文章信息
- 张申, 刘畅, 周菲惠, 夏阳, 王瑞飞, 李智高, 王崇谦, 王进昆, 汤志伟
- ZHANG Shen, LIU Chang, ZHOU Fei-Hui, XIA Yang, WANG Rui-Fei, LI Zhi-Gao, WANG Chong-Qian, WANG Jin-Kun, Tang Zhi-Wei
- 甲状腺激素受体β 1在非典型脑膜瘤的表达及其作用研究
- Expression of thyroid hormone receptor β1 and its role in atypical meningioma
- 国际神经病学神经外科学杂志, 2019, 46(3): 254-259
- Journal of International Neurology and Neurosurgery, 2019, 46(3): 254-259
-
文章历史
收稿日期: 2019-02-12
修回日期: 2019-04-18
脑膜瘤是起源于蛛网膜颗粒上帽状细胞的一种常见的中枢神经系统肿瘤,其发病率约为4.5/10万,占颅内原发肿瘤的15%~24%,按2016年WHO分级可分为良性脑膜瘤(Ⅰ级)、非典型脑膜瘤(Ⅱ级)和间变脑膜瘤(Ⅲ级)三个病理级别[1、2]。非典型脑膜瘤属于WHOⅡ级,与间变脑膜瘤相比虽然治后的复发率较低但其具有较高发病率;和良性脑膜瘤相比虽然发病率远远不及,但在手术,放疗等治疗措施后仍具有较高的复发率,综合其不低的发病率以及较差的预后,非典型脑膜瘤成为了目前脑膜瘤治疗中的亟需解决的难题[3、4]。在发病机制上与良性脑膜瘤和性别以及相关激素具有相关性不同[5, 10, 11, 28]。研究发现在一些恶性程度较高的脑膜瘤发病人群中并没有明显的性别差异,甚至一些人群中男性发病高于女性[25-27],提示非典型脑膜瘤的发生及生长过程中可能存在其他途径和机制。在目前的一些流行病学研究中甲状腺疾病和脑膜瘤的发病被多次报道的具有一定的相关性而甲状腺相关疾病会导致体内的甲状腺激素及其相关受体发生改变[8, 9, 14]。
甲状腺激素受体(Thyroid hormones receptor, TR)具有TRα1、TRα2、TRβ1、TRβ2等多种亚型,在个体的发育、维持内环境稳定、细胞增殖和分化等方面均产生作用[6]。而其中TRβ1具有最广泛的组织分布[7]。在目前的文献报道中,TRβ1,在乳腺癌、甲状腺癌和急性淋巴细胞白血病等多种肿瘤中发挥抑癌作用[13、22]。但目前国内外在TRβ1和非典型脑膜瘤等方面的研究尚无报道,为了进一步验证两者之间的关系,为此我们设计了该实验,为非典型脑膜瘤的治疗提供新的思路。
2 材料和方法 2.1 实验材料通过外科手术获得脑膜瘤标本45例,男10例,女35例,平均年龄49.75±13.9岁,其中按WHO标准分级,WHOⅠ级38例,WHOⅡ级6例,均经病理诊断证实,新鲜标本一部分于-80℃保存,一部分石蜡包埋切片待用。所有标本均来自昆明医科大学第一附属医院。TRβ1抗体购自美国Santa Cruz公司,IscriptTM cDNA逆转录试剂盒购自BIO-RAD公司,引物、siRNA由锐博公司合成,二抗均购自美国Abcam公司,EDTA缓冲溶液购自索来宝公司,DAB染色试剂盒购自VECTOR公司,DMEM和双抗购自Gibco公司,胎牛血清购自BI公司,siRNA由锐博公司设计合成。
2.2 免疫组织化学烤片65℃,2小时。石蜡切片脱蜡水化,pH 8.0的高温高压抗原热修复45分钟;PBS洗涤3次,封闭,滴加一抗(1 : 50 PBS稀释),4℃过夜孵育。过夜孵育后室温再孵育30分钟,PBS洗涤3次,滴加二抗(1 : 100 PBS稀释)室温孵育45分钟;PBS洗涤3次后DAB试剂盒显微镜下控制显色,中性树胶封片。
2.3 实时荧光定量PCR测定取-80℃保存的脑组织,于液氮中研磨成粉状后提取获得总RNA,用IscriptTM cDNA逆转录试剂(BIO-RAD)将mRNA反转录得到cDNA,以其为模板,加入SYBR Green Master Mix(ThermoFisher Scientific公司)试剂、引物在荧光定量PCR系统(ABI7500,Applied Biosystems)进行模板的扩增和信号采集,以获得图像并通过计算△Ct值得到目的mRNA的相对表达水平。
引物序列TRβ1: F-5’-TACAGCCTGGGACAAACC-3’,R-5’-GGCGACGACTGTTCATTT-3’;GAPDH:F-5’-GGAGCGAGATCCCTCCAAAAT-3’,R-5’-GGCTGTTGTCATACTTCTCATGG-3’。
2.4 脑膜瘤细胞分离、培养及鉴定 2.4.1 脑膜瘤细胞分离、培养参照文献[15],获得新鲜脑膜瘤组织后,立即进行细胞分离并培养原代脑膜瘤细胞。简略步骤为:剪碎组织后,加入适量体积的胰酶于温箱中消化后,按文献提供方法收集培养原代脑膜瘤细胞。所有细胞用含10%胎牛血清和1%双抗的DMEM组成的完全培养基培养。首次隔天换液,以后每2~3天换液,待细胞密度大于90%进行传代培养。
2.4.2 脑膜瘤细胞的鉴定将非典型脑膜瘤细胞,按照105个/ml的浓度进行细胞爬片,ABC免疫细胞化学法,将波形蛋白(Vimentin)、上皮膜抗原(EMA)蛋白的单克隆抗体分别按照1 : 200和1 : 100的浓度,进行DAB显色,PBS代替一抗作阴性对照,胞内出现棕褐色则为表达阳性。
2.5 Western blot检测TRβ1的siRNA的有效性将细胞接种于培养瓶中过夜,次日加入siRNA(浓度2 ng/ml)处理,7小时后换正常培养基,48小时后收取细胞蛋白,用Western blot检测脑膜瘤细胞中TRβ1蛋白的表达量。siRNA序列:GCGCTATGACCCAGAAAGT。
2.6 MTT细胞活性测定T3粉剂溶于1N NaOH溶液中,设置相同浓度的NaOH为对照组。将细胞以40 000个/ml浓度均匀接种于96孔培养板, 100 μl/孔; 培养24小时后换用加有T3的完全培养基, 设置五个药物浓度梯度1 ng/ml、5 ng/ml、10 ng/ml、20 ng/ml; 在T3干预48小时后加入MTT (5 mg/ml)试剂, 测定OD值(490 nm波长)。同样的处理种板过夜,加入有效siRNA片段处理,MTT检测20 ng/ml T3干预48小时后OD值(490 nm波长)。所有实验均重复三次。
2.7 统计学方法上述实验所得数据的记录、处理、运算、作图和统计学分析应用Microsoft Excel 2016、SPSS 22.0及IMAGE J软件进行分析,计量资料以均数±标准差(x±s)表示,计量资料两组间比较采用t检验或非配对t检验,P < 0.05为差异有统计学意义。
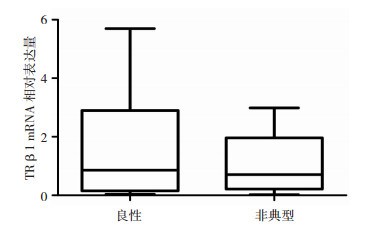
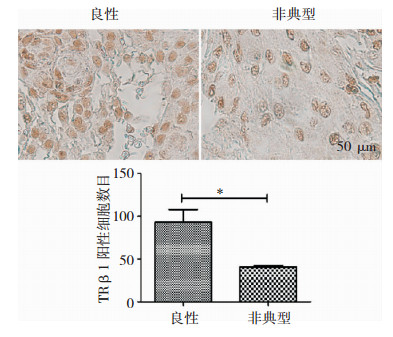
3 结果 3.1 甲状腺激素受体TRβ1在脑膜瘤上表达,且不同级别有差异对脑膜瘤组织进行实时定量PCR检测后发现,在所有脑膜瘤中均可检测到TRβ1的mRNA表达,其中在良性脑膜瘤中表达的平均值为1.88,而在非典型脑膜瘤中的为1.16, 两组之间进行统计学分析,P值为0.49,没有统计学意义(图 1)。将脑膜瘤组织切片,利用免疫组化法检测不同级别脑膜瘤组织中的TRβ1蛋白表达水平,通过对特异性着色的阳性细胞计数后发现,良性脑膜瘤中TRβ1的表达阳性的细胞数平均值为93个/mm2,非典型脑膜瘤中表达阳性的细胞数平均值为40.75个/mm2,两者之间的差异具有统计学意义(P < 0.05)。(图 2)
|
| 通过PCR分别检测在良性脑膜瘤和非典型脑膜瘤中TRβ1 mRNA的表达量。 图 1 TRβ1的mRNA在不同病理级别脑膜瘤中的表达情况 |
|
| 通过免疫组化对脑膜瘤组织上的TRβ1进行染色,棕褐色深染细胞均为阳性染色细胞,并对视野内的阳性染色细胞计数分析。(P < 0.05) 图 2 TRβ1蛋白在不同病理级别脑膜瘤中的表达情况 |
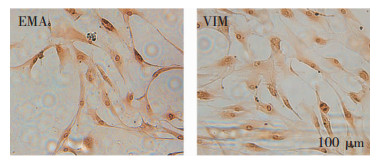
脑膜瘤原代细胞在培养4~6小时后贴壁,采用差速贴壁法进行纯化肿瘤细胞;肿瘤细胞传代后形态呈长梭形,细胞透亮,折光性好,3天左右细胞密度可达80%~90%时传代。通过对Vimentin、EMA蛋白的DAB染色对细胞进行鉴定,其中Vimentin阳性比率为99%,EMA阳性比率为99%。结果显示所培养细胞均为脑膜瘤细胞,可用于后续实验。(图 3)
|
| 通过免疫化学对细胞上的EMA和Vimentin进行染色,其中胞质部分的棕褐色为阳性染色,可见图中细胞均为阳性表达。 图 3 脑膜瘤细胞鉴定 |
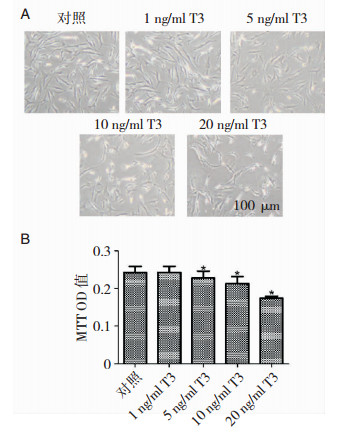
选取细胞中的非典型脑膜瘤细胞(按标本来源的病理等级挑选),用MTT法检测不同浓度的T3干预后对原代非典型脑膜瘤细胞增殖的影响。结果显示:T3可有效抑制非典型脑膜瘤细胞的增殖,且抑制作用具有明显浓度依赖性。在浓度为5 mg/ml时,T3开始出现抑制细胞增殖的作用;当浓度为20 ng/ml时,T3对细胞增殖的抑制作用更显著。(P < 0.05)(图 4)
|
| A:通过光学显微镜发现随着T3浓度的升高,细胞数目逐渐减少,形态变差;B:MTT分析发现T3可以抑制细胞增殖,呈浓度依赖性(P < 0.05)。 图 4 T3可抑制非典型脑膜瘤细胞增殖 |
用siRNA转染对细胞上的TRβ1进行沉默,并用Western blot法检测siRNA的沉默效率。结果显示,与对照组相比,转染组细胞中TRβ1蛋白的表达下调51%,说明siRNA对于TRβ1蛋白的沉默有效。然后检测下调TRβ1表达后,T3对非典型脑膜瘤细胞的作用。结果显示siRNA下调TRβ1表达后,T3对细胞的增殖的抑制作用明显减弱,而对照组中,T3对细胞的增殖仍有明显抑制作用,具有统计学意义(P < 0.05), 说明T3通过其受体TRβ1对非典型脑膜瘤细胞发挥抑制作用。(图 5)
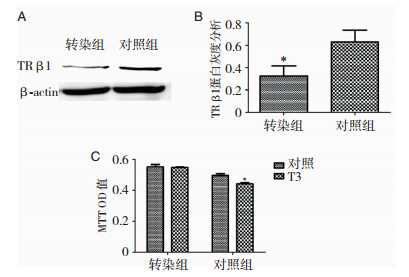
|
| A:通过western blot检测TRβ1的siRNA的沉默效率,siRNA转染后细胞上的TRβ1表达下调;B:对western blot的蛋白条带进行灰度分析,siRNA转染后细胞上的TRβ1表达下调(P < 0.05);C:MTT检测siRNA转染后的T3对细胞的作用(P < 0.05)。 图 5 沉默TRβ1可以减轻T3对非典型脑膜瘤细胞增殖的抑制作用 |
脑膜瘤是在颅内高发肿瘤,其治疗方法主要为手术切除,且绝大多数患者预后较好。但反复复发的脑膜瘤中大多数为非典型脑膜瘤,该部分患者总体预后不佳[3, 4, 24]。为了寻找更为有效的治疗方法及策略,对非典型脑膜瘤的发病机制的研究则具有重要意义。在目前众说纷纭的发病机制中,我们关注到了被广泛认为在肿瘤具有抑癌作用的TRβ1。有研究提示TRβ蛋白可以作为乳腺癌诊断或预后的潜在生物标志物[18];而一动物模型的报道的结果提示,稳定表达的TRβ1可以抑制细胞周期进展而有效阻断甲状腺癌的发展[19]。Olaia Martínez-Iglesiasdengre等人的研究发现,在肝癌和乳腺癌细胞上TRβ的表达可以有效抑制肿瘤的生长[20]。
与其他肿瘤相似的是,我们的结果也显示TRβ1在非典型脑膜瘤中可能具有着抑癌作用。首先在mRNA水平,我们发现在非典型脑膜瘤中TRβ1mRNA的表达较良性脑膜瘤高,但结果之间没有统计学意义。而在蛋白水平,非典型脑膜瘤上TRβ1表达较良性脑膜瘤上低的,且具有统计学意义。TRβ1在非典型脑膜瘤的低表达说明TRβ1可能在复发性及恶性程度更高的非典型脑膜瘤的发生发展的过程中发挥着作用。为了进一步验证该假设,我们利用MTT检测了TRβ1的激动剂T3对非典型脑膜瘤细胞的作用;同时也检测了转染siRNA沉默TRβ1蛋白后,T3于细胞的作用。结果显示,T3可有效抑制非典型脑膜瘤细胞的增殖,但在沉默TRβ1蛋白后,T3对细胞的抑制作用减弱。提示TRβ1在配体T3的激活后,可抑制非典型脑膜瘤细胞增殖。
但关于TRβ1在T3激活后对非典型脑膜瘤的增殖的抑制作用的具体途径和机制尚不清楚,需要更进一步的实验来探讨验证。目前在甲状腺激素及其受体在其他肿瘤中作用的具体机制的研究可以为我们提供思路。ZHU等人在体外实验中发现TRβ1明显抑制了活化的磷酸化AKT,从而对肿瘤的迁移和增殖产生影响[17]。也有研究表明T3与TRβ1结合时,可下调Src信号通路,抑制肿瘤细胞的生长[23]。在乳腺癌中,在甲状腺激素T3的作用下TRβ1可以通过调节JAK-STAT-cyclin D信号通路抑制肿瘤细胞的增殖[21]。
总之,既往对良性脑膜瘤发生及生长的机制研究较多,但对非典型脑膜瘤的相关机制研究仍不完全清楚。我们的研究表明TRβ1在不同病理级别的脑膜瘤中具有表达差异,且TRβ1在被T3激活后,可抑制非典型脑膜瘤细胞的增殖,提示TRβ1在非典型脑膜瘤的发生及发展过程中扮演重要角色,进一步研究其作用的机制可为非典型脑膜瘤的临床治疗提供新的思路。
| [1] |
Farah P, Blanda R, Kromer C, et al. Conditional survival after diagnosis with malignant brain and central nervous system tumor in the United States, 1995-2012[J]. J Neurooncol, 2016, 128(3): 419-429. DOI:10.1007/s11060-016-2127-8 |
| [2] |
Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System:a summary[J]. Acta Neuropathol, 2016, 131(6): 803-820. DOI:10.1007/s00401-016-1545-1 |
| [3] |
Soussain C, Ricard D, Fike JR, et al. CNS complications of radiotherapy and chemotherapy[J]. Lancet, 2009, 374(9701): 1639-1651. DOI:10.1016/S0140-6736(09)61299-X |
| [4] |
张浩宇, 李达, 郝淑煜, 张俊廷. 侵袭性脑膜瘤的分子生物学研究进展[J]. 国际神经病学神经外科学杂志, 2013, 40(3): 248-251. |
| [5] |
Jhawar BS, Fuchs CS, Colditz GA, et al. Sex steroid hormone exposures and risk for meningioma[J]. J Neurosurg, 2003, 99(5): 848. DOI:10.3171/jns.2003.99.5.0848 |
| [6] |
Oppenheimer JH. The molecular basis of thyroid hormone action:scattered pieces of jigsaw puzzle[J]. Progress in Clinical & Biological Research, 1981, 74: 45. |
| [7] |
Ling Y, Shi X, Wang Y, et al. Down-regulation of thyroid hormone receptor β1 gene expression in gastric cancer involves promoter methylation[J]. Biochem Biophys Res Commun, 2014, 444(2): 147-152. DOI:10.1016/j.bbrc.2014.01.012 |
| [8] |
Sughrue ME, Kane AJ, Shangari G, et al. Prevalence of previous extracranial malignancies in a series of 1228 patients presenting with meningioma[J]. J Neurosurgery, 2010, 113(5): 1115-1121. DOI:10.3171/2010.3.JNS091975 |
| [9] |
Claus EB, Calvocoressi L, Bondy ML, et al. Family and personal medical history and risk of meningioma[J]. J Neurosurg, 2011, 115(6): 1072-1077. DOI:10.3171/2011.6.JNS11129 |
| [10] |
Harland TA, Freeman JL, Davern M, et al. Progesterone-only contraception is associated with a shorter progression-free survival in premenopausal women with WHO Grade I meningioma[J]. J Neurooncology, 2018, 136(2): 327-333. DOI:10.1007/s11060-017-2656-9 |
| [11] |
Kuroi Y, Matsumoto K, Shibuya M. Progesterone Receptor Is Responsible for Benign Biology of Skull Base Meningioma[J]. World neurosurgery, 2018, 118: e918-e924. DOI:10.1016/j.wneu.2018.07.100 |
| [12] |
Li Z, Meng ZH, Chandrasekaran R, et al. Biallelic inactivation of the thyroid hormone receptor beta1 gene in early stage breast cancer[J]. Cancer research, 2002, 62(7): 1939-1943. |
| [13] |
Joseph B, Ji M, Liu D, et al. Lack of mutations in the thyroid hormone receptor (TR) alpha and beta genes but frequent hypermethylation of the TRbeta gene in differentiated thyroid tumors[J]. Journal of Clinical Endocrinology & Metabolism, 2007, 92(12): 4766-4770. |
| [14] |
Kim YL, Jang YW, Kim JT, et al. A rare case of primary hyperparathyroidism associated with primary aldosteronism, Hürthle cell thyroid cancer and meningioma[J]. J Korean Med Sci, 2012, 27(5): 560-564. DOI:10.3346/jkms.2012.27.5.560 |
| [15] |
胡梅新, 刘家乐, 陈宣伯, 等. 人恶性脑膜瘤原代细胞的培养及小鼠颅内原位成瘤模型的建立[J]. 南方医科大学学报, 2018, 38(3): 340-345. DOI:10.3969/j.issn.1673-4254.2018.03.16 |
| [16] |
Suzuki H, Willingham MC. Mice with a mutation in the thyroid hormone receptor beta gene spontaneously develop thyroid carcinoma:a mouse model of thyroid carcinogenesis[J]. Thyroid, 2002, 12(11): 963-969. DOI:10.1089/105072502320908295 |
| [17] |
Zhu L, Tian G, Yang Q, et al. Thyroid hormone receptor β1 suppresses proliferation and migration by inhibiting PI3K/Akt signaling in human colorectal cancer cells[J]. Oncology Reports, 2016, 36(3): 1419-1426. DOI:10.3892/or.2016.4931 |
| [18] |
Martínez-Iglesias O, Olmeda D, Alonso-Merino E, et al. The nuclear corepressor 1 and the thyroid hormone receptor β suppress breast tumor lymphangiogenesis[J]. Oncotarget, 2016, 7(48): 78971-78984. |
| [19] |
Kim DW, Zhao L, Hanover J, et al. Thyroid hormone receptor β suppresses SV40-mediated tumorigenesis via novel nongenomic actions[J]. Am J Cancer Res, 2012, 2(5): 606-619. |
| [20] |
Martínez-Iglesias O, Garcia-Silva S, Tenbaum SP, et al. Thyroid hormone receptor beta1 acts as a potent suppressor of tumor invasiveness and metastasis[J]. Cancer research, 2009, 69(2): 501-509. DOI:10.1158/0008-5472.CAN-08-2198 |
| [21] |
Park JW, Zhao L. Inhibition of estrogen-dependent tumorigenesis by the thyroid hormone receptor β in xenograft models[J]. American journal of cancer research, 2013, 3(3): 302-311. |
| [22] |
Dunwell TL, Hesson LB, Pavlova TV, et al. Epigenetic analysis of childhood acute lymphoblastic leukemia[J]. Epigenetics, 2009, 4(3): 9. |
| [23] |
Park JW, Zhao L, Webb P, et al. Src-dependent phosphorylation at Y406 on the thyroid hormone receptor β confers the tumor suppressor activity[J]. Oncotarget, 2014, 5(20): 10002-10016. |
| [24] |
Jääskeläinen J, Haltia M, Servo A. Atypical and anaplastic meningiomas:Radiology, surgery, radiotherapy, and outcome[J]. Surgical Neurology, 1986, 25(3): 233-242. DOI:10.1016/0090-3019(86)90233-8 |
| [25] |
Achey RL, Gittleman H, Schroer J, et al.Non-malignant and malignant meningioma incidence and survival in the elderly from 2005-2015 using the Central Brain Tumor Registry of the United States[J]. Neuro Oncol. 2018 Oct 6. doi: 10.1093/neuonc/noy162.[Epubaheadofprint]
|
| [26] |
Dolecek TA, Propp JM, Stroup NE. CBTRUS statistical report:primary brain and central nervous system tumors diagnosed in the United States in 2005-2009[J]. Neuro-oncology, 2012, 14(suppl 5): v1-49. DOI:10.1093/neuonc/nos218 |
| [27] |
Champeaux C, Wilson E, Brandner S, et al. World Health Organization grade Ⅲ meningiomas. A retrospective study for outcome and prognostic factors assessment[J]. Br J Neurosurg, 2015, 29(5): 639-698. |
| [28] |
Carroll RS, Zhang J.Black PM. Expression of estrogen receptors alpha and beta in human meningiomas[J]. J Neurooncol, 1999, 42(2): 109-116. DOI:10.1023/A:1006158514866 |
 2019, Vol. 46
2019, Vol. 46




