扩展功能
文章信息
- 陈彬, 郑灿坤, 陈辉, 骆健明, 庄泽锐, 陈泽林, 杨傲冰, 刘斌
- CHEN Bin, ZHENG Can-Kun, CHEN Hui, LUO Jian-Ming, ZHUANG Ze-Rui, CHEN Ze-Lin, YANG Ao-Bing, LIU Bin
- 西洛他唑治疗动脉瘤性蛛网膜下腔出血后脑血管痉挛的Meta分析
- Clinical effect of cilostazol in treatment of cerebral vasospasm after aneurysmal subarachnoid hemorrhage: A meta-analysis
- 国际神经病学神经外科学杂志, 2019, 46(2): 166-171
- Journal of International Neurology and Neurosurgery, 2019, 46(2): 166-171
-
文章历史
收稿日期: 2018-12-11
修回日期: 2019-02-17
目前研究用于预防动脉瘤性蛛网膜下腔出血所致的脑血管痉挛的药物主要有钙离子通道阻滞剂、内皮素受体拮抗剂、镁剂、罂粟碱、他汀类药物、Rho激酶抑制剂如法舒地尔等,其中钙离子通道阻滞剂尼莫地平已被广泛应用于临床诊疗[1],然而其疗效也不是特别理想[2],因此,寻找新的治疗方法治疗动脉瘤性蛛网膜下腔出血后脑血管痉挛具有重大意义。有研究表明西洛他唑可以减少蛛网膜下腔出血后脑血管痉挛的发生[3]。本研究对目前国内、外所有有关西洛他唑治疗动脉瘤性蛛网膜下腔出血患者的临床随机对照试验结果进行系统评价,旨在探讨西洛他唑治疗动脉瘤性蛛网膜下腔出血后脑血管痉挛的疗效及其对患者预后的影响,为临床用药和进一步研究提供依据。
1 资料与方法 1.1 纳入标准与排除标准纳入标准:(1)研究类型为随机对照试验,无论试验是否采用分配隐藏或盲法。(2)病例选择均经CTA、MRA、DSA检查证实为aSAH患者,所有的患者均行动脉瘤夹闭或介入手术治疗;(3)对照组给予常规治疗,试验组在常规治疗基础上给予西洛他唑200 mg/d;(4)纳入文献以比较aSAH患者出现脑血管痉挛的并发症与预后为主要指标的研究。排除标准:(1)研究中没有设立对照组,研究对象是非aSAH患者,研究的例数案例少于10例。评论、会议、计划书、动物实验和尸体解剖类文献都不纳入本分析。
1.2 测量指标主要结局指标:症状性脑血管痉挛、重度脑血管痉挛以及迟发性脑梗塞;次要结局指标:预后良好以及西洛他唑发生药物不良反应。(症状性脑血管痉挛定义为新发的局灶性或全局性神经功能缺损;重度脑血管痉挛定义通过数字减影血管造影术(DSA)、计算机断层血管造影(CTA)、磁共振血管造影(MRA)或经颅多普勒超声(TCD)检测到血管直径减少60%[4],迟发性脑梗塞定义为病程治疗过程中头颅CT或MRI检查发现新发梗死灶,mRS评分为0-2分提示预后良好,3-5分提示预后差)。
1.3 检索策略以“Subarachnoid Hemorrhage”和“Cilostazol”为主题词配合自由词检索Pubmed、Cochrane Library;以“蛛网膜下腔出血”和“西洛他唑”为中文检索词,中国期刊网全文数据库、维普及万方数据库。由2位研究者独立检索,检索年限均从建库至2018年9月。检索过程未做任何限定,纳入文献主要包括英文与中文,但对于有英文摘要的非中、英文研究,也详细阅读,必要时请翻译人员或软件协助。为防止遗漏同时查阅各研究的参考文献。
1.4 资料提取与质量评价由2位研究员独立阅读文献标题及摘要,对符合纳入标准的文献阅读全文,提取研究设计中的具体方法及研究的基本情况并交叉核对。对于不一致数据请其他评价员重新提取。纳入研究的质量评价依据Cochrane评价手册提供的评价标准进行,包括:采用何种随机方法;是否进行分配隐藏,方法是否正确;是否对研究对象、治疗方案实施者、研究结果测量者施盲;结果数据是否完整,有无失访和退出,存在失访时是否进行意向性分析,是否报告其他偏倚来源,是否存在选择性报告研究结果。
1.5 统计学处理采用Cochrane官网推荐的RevMan5.3统计软件进行Meta分析,首先统计数据进行Q检验,若各研究间统计学异质性较小(P>0.05,I2<50%),则采用固定效应模型进行分析;若存在异质性(P<0.05,I2>50%),则首先分析异质性的来源,或进一步做敏感性分析,以确定是否需要采用随机效应模型进行数据合并。计数资料用相对危险度(OR)作为疗效分析统计量,各效量均以95%CI表示, 如果临床实验数据提供不足,则只进行描述性分析,最后采用漏斗图分析发表偏倚。
2 结果 2.1 检索结果根据检索策略,初检相关文献112篇,其中中文文献15篇,英文文献97篇,通过阅读标题、摘要,排除重复、综述、动物实验文章,最终纳入6篇[5-10],共618例患者。
2.2 纳入文献一般基线资料和质量评价| 纳入文献 | 研究类型 | 研究时间 | 病例数 | 年龄(男性/女性) | 手术(夹闭/栓塞) | 动脉瘤位置ant post | 治疗时间 | |
| Yoshimoto[7] | ||||||||
| 西洛他唑试验组 | qRCT | 2004-2006 | 26 | 60(3/23) | 22/4 | 23 | 3 | 术后200 mg/d维持2周 |
| 对照组 | 24 | 58(10/14) | 19/5 | 18 | 6 | - | ||
| Suzuki[8] | ||||||||
| 西洛他唑试验组 | RCT | 2006-2008 | 49 | 62(13/36) | 49/0 | 46 | 3 | 术后200 mg/d维持2周 |
| 对照组 | 51 | 64(11/40) | 51/0 | 47 | 4 | - | ||
| Senbokuya[9] | ||||||||
| 西洛他唑试验组 | RCT | 2009-2010 | 54 | 60(19/35) | 54/0 | 54 | 0 | 术后200 mg/d维持2周 |
| 对照组 | 55 | 61(22/33) | 55/0 | 55 | 0 | - | ||
| Murahashi[10] | ||||||||
| 西洛他唑试验组 | qRCT | 2008-2009 | 25 | 64.2(4/21) | 25/0 | 56 | 0 | 术后200 mg/d维持2-4周 |
| 对照组 | 56 | 60.6(19/37) | 56/0 | 24 | 1 | - | ||
| Kimura[11] | ||||||||
| 西洛他唑试验组 | RCT | 2008-2012 | 62 | 65.6(18/44) | 62/0 | 55 | 5 | 术后200 mg/d维持2周 |
| 对照组 | 68 | 65.0(14/54) | 68/0 | 62 | 6 | - | ||
| Matsuda[12] | ||||||||
| 西洛他唑试验组 | RCT | 2010-2013 | 74 | 58(20/54) | 61/13 | 70 | 4 | 术后200 mg/d维持2周 |
| 对照组 | 74 | 59(28/46) | 65/9 | 70 | 4 | - | ||
| 注:对照组均为无使用西洛他唑药物干预的阴性对照结果,qRCT:准随机对照试验;RCT:随机对照试验;ant:前循环动脉瘤;post:后循环动脉瘤。 | ||||||||
| 纳入文献 | 随机分配 | 隐藏方案 | 盲法 | 研究数据完整性 | 结果报告完整性 | 随访完整 | 其他偏移来源 |
| Yoshimoto | 随机 | 不清楚 | 开放性标记 | 是 | 是 | 是 | 不清楚 |
| Suzuki | 随机 | 不清楚 | 单盲 | 是 | 是 | 是 | 不清楚 |
| Senbokuya | 随机 | 不清楚 | 开放性标记 | 是 | 是 | 是 | 不清楚 |
| Murahashi | 随机 | 不清楚 | 不清楚 | 是 | 是 | 是 | 不清楚 |
| Kimura | 随机 | 不清楚 | 不清楚 | 是 | 是 | 是 | 不清楚 |
| Matsuda | 随机 | 不清楚 | 双盲 | 是 | 是 | 是 | 不清楚 |
有6个研究[5-10](合计618例患者)报道了症状性CVS的发生,各研究结果之间异质性差异无统计学意义(P>0.05,I2=0),故采用固定效应模型进行Meta分析。结果显示, 西洛他唑试验组患者发生症状性显著低于对照组,其差异有统计学意义(OR=0.31, 95%CI:0.21-0.48)(见图 1),提示西洛他唑能够减少aSAH后症状性脑血管痉挛发生。
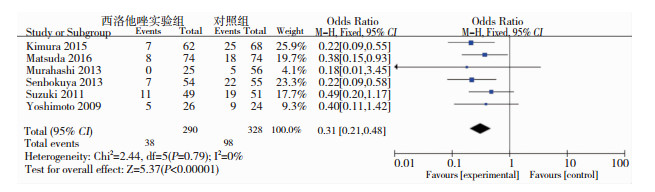
|
| 图 1 西洛他唑试验组与对照组aSAH患者发生症状性脑血管痉挛的比较 |
有5个研究[5, 7-10](合计518例患者)报道了重度脑血管痉挛的发生,各研究结果之间异质性差异无统计学意义(P>0.05,I2=0),故采用固定效应模型进行Meta分析。结果显示, 西洛他唑试验组患者发生严重脑血管痉挛显著低于对照组,其差异有统计学意义(OR=0.47, 95%CI:0.31-0.69)(见图 2),提示西洛他唑能够减少aSAH后重度脑血管痉挛发生。
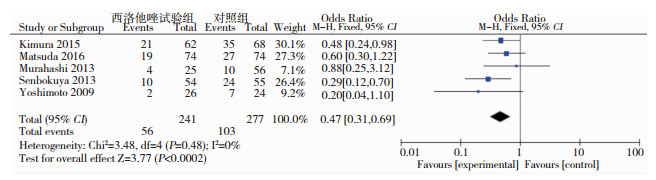
|
| 图 2 西洛他唑试验组与对照组aSAH患者发生重度脑血管痉挛的比较 |
有5个研究[5-7, 9, 10](合计537例患者)报道了迟发性脑梗塞事件的发生,各研究结果之间异质性差异无统计学意义(P>0.05,I2=0),故采用固定效应模型进行Meta分析。结果显示, 西洛他唑试验组患者发生迟发性脑梗塞显著低于对照组,其差异有统计学意义(OR=0.32, 95%CI:0.20-0.52)(见图 3),提示西洛他唑能够减少aSAH后迟发性脑梗塞发生。
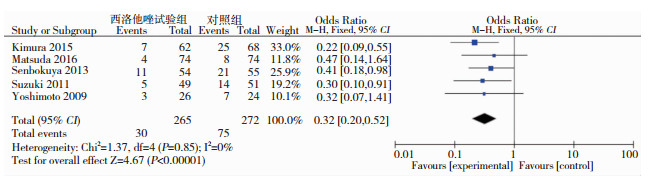
|
| 图 3 西洛他唑试验组与对照组aSAH患者发生迟发性脑梗塞的比较 |
有4个研究[5-7, 9](合计389例患者)统计了出院时mRS评分结果,其中预后良好(mRS评分=0-2)的指标结果之间异质性差异无统计学意义(P>0.05,I2=0),故采用固定效应模型进行Meta分析。结果显示, 西洛他唑能显著改善aSAH患者预后,提高患者生存治疗,其差异有统计学意义(OR=2.65,95%CI:1.66-4.21)。(见图 4)。
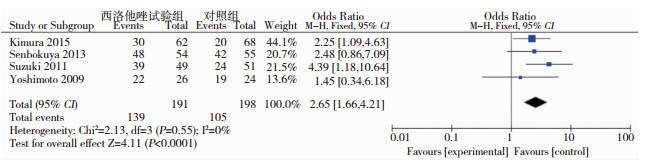
|
| 图 4 西洛他唑试验组与对照组aSAH患者预后良好的比较 |
本研究中包括的2项研究中提到了西洛他唑的不良反应,病例数目较少,故只采取描述性分析。Senbokuya[7]和Matsuda[10]等研究中,西洛他唑组出现了消化道出血、硬膜外血肿、脑出血、心律不齐、胃肠道反应、肝功能受损等不良反应,但是两组不良事件发生率并无显著统计学差异(P>0.05)。此外,研究表明抗血小板药物在治疗aSAH患者的过程中并未出现明显的副作用[11]。另外,研究表明西洛他唑在缺血性卒中的二级预防方面明显优于阿司匹林,不良事件发生明显较少[12],这说明西洛他唑在临床治疗还是相对安全的。
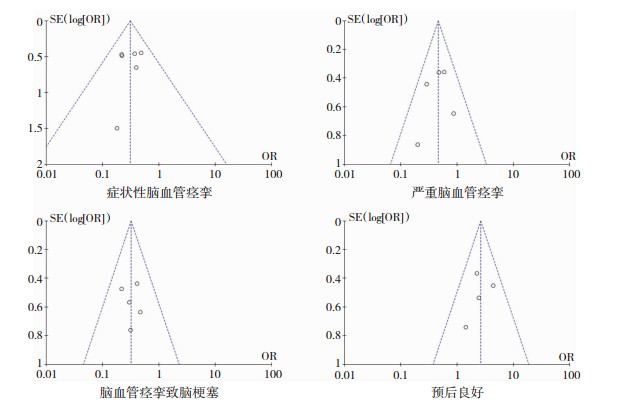
2.3.6 发表偏移情况我们通过比较症状性脑血管痉挛、严重脑血管痉挛、脑血管痉挛性脑梗塞以及预后指标的漏斗图(见图 5),结果显示各组数据漏斗图图形基本对称,提示无发表偏倚。
|
| 图 5 漏斗图 |
动脉瘤性蛛网膜下腔出血后出现的脑血管痉挛是神经外科领域危重疾病,具有极高的死亡率及致残率。脑血管痉挛的特点是蛛网膜下腔出血3天后开始出现的颅内动脉进行性狭窄,并在病程1周左右时间达到高峰,当颅内动脉持续收缩痉挛,局部脑组织供血不足,可进一步发展为迟发性的脑缺血及脑梗死[13]。目前认为脑血管痉挛的发生机制主要与蛛网膜下腔出血后血管持续收缩、大脑微循环障碍、自由基毒性、炎性因子级联反应、早期脑损伤、大脑皮层扩散抑制有关[14]。
西洛他唑是一种广泛应用于临床的抗血小板药物,通过抑制磷酸二酯酶-3活性, 增加细胞内cAMP水平,具有抗血栓形成、抑制血管平滑肌细胞增殖和对保护血管内皮细胞的作用,主要用于动脉硬化闭塞、间歇性跛行或缺血性卒中的二级预防[15]。近年来许多学者发现西洛他唑能够减轻动脉瘤性蛛网膜下腔出血后所致脑血管痉挛。Mitsuo等[16]通过狗的蛛网膜下腔出血模型实验发现西洛他唑可以预防脑血管痉挛的发生,并提出这可能通过改变血管平滑肌细胞表型,延缓血管内皮细胞的微损伤进展的机制。Kawanabe等[17]也通过小鼠离体颅内动脉的血管平滑肌细胞的培养实验,证实西洛他唑对内皮素诱导的血管收缩和细胞增殖的双重拮抗作用。此外西洛他唑还能通过增高cAMP激活内皮型一氧化氮合酶,诱导NO产生,进一步促进大脑血管扩张[18], 从而对早期预防脑血管痉挛的发生发挥作用。西洛他唑是目前唯一一种具有血管扩张的抗血小板药物,具有多种生物活性,功能广泛,出血风险低,安全等特点,在临床脑卒中疾病的治疗具有极大的潜力[19]。
本研究通过Meta分析得出,西洛他唑在治疗动脉瘤性蛛网膜下腔出血的患者过程中,可以明显减少脑血管痉挛等并发症的发生,并且对改善患者预后有一定帮助。本次研究纳入6篇相关文献均为临床对照试验,与既往研究的结果不同,宋锦宁等[20]研究表明西洛他唑的应用并不能改善患者预后,但其纳入的文献资料不多,可能存在发表偏移,本研究在既往研究的基础上,对评价指标进行重新定义,结果显示,西洛他唑对于改善aSAH患者的预后具有统计学意义。本研究存在以下局限性,6项研究中有2项试验未交代随机分配方法,2项试验未交代盲法,可能会产生选择偏移,1项研究未对患者出院或随访的mRS评分进行统计分析,这可能会导致信息偏移,虽然统计分析过程中未发现明显统计学异质性.也不能忽视纳入文献研究者采取统计方法学异质性带来的偏倚。故还需要更大规模的随机对照试验来证实这些结论,以及开展更多基础实验探讨西洛他唑的保护机制。
| [1] |
Hasegawa S, Hasegawa Y, Miura M. Current Therapeutic Drugs Against Cerebral Vasospasm after Subarachnoid Hemorrhage:A Comprehensive Review of Basic and Clinical Studies[J]. Current drug delivery, 2017, 14(6): 843-852. |
| [2] |
何宗泽, 黄光富. 尼莫地平治疗蛛网膜下腔出血后脑血管痉挛研究进展[J]. 实用医院临床杂志, 2010, 7(2): 139-141. DOI:10.3969/j.issn.1672-6170.2010.02.058 |
| [3] |
Bilginer B, Onal MB, Narin F, et al. The effects of intravenous cilostazol and nimodipine on cerebral vasospasm after subarachnoid hemorrhage in an experimental rabbit model[J]. Turk Neurosurg, 2009, 19: 374-379. |
| [4] |
Otawara Y, Ogasawara K, Ogawa A, et al. Evaluation of vasospasm after subarachnoid hemorrhage by use of multislice computed tomographic angiography[J]. Neurosurgery, 2002, 51: 939-942. |
| [5] |
Yoshimoto T, Shirasaka T, Fujimoto S, et al. Cilostazol may prevent cerebral vasospasm following subarachnoid hemorrhage[J]. Neurol. Med. Chir. (Tokyo), 2009, 49: 235-240. DOI:10.2176/nmc.49.235 |
| [6] |
Suzuki S, Sayama T, Nakamura T, et al. Cilostazol improves outcome after subarachnoid hemorrhage:a preliminary report[J]. Cerebrovasc. Dis., 2011, 32: 89-93. DOI:10.1159/000327040 |
| [7] |
Senbokuya N, Kinouchi H, Kanemaru K, et al. Effects of cilostazol on cerebral vasospasm after aneurysmal subarachnoid hemorrhage:a multicenter prospective, randomized, open-label blinded end point trial[J]. J. Neurosurg., 2013, 118: 121-130. DOI:10.3171/2012.9.JNS12492 |
| [8] |
Murahashi T, Kamiyama K, Hara K, et al. The efficiency of cilostazol for cerebral vasospasm following subarachnoid hemorrhage[J]. No Shinkei Geka, 2013, 41: 393-400. |
| [9] |
Kimura H, Okamura Y, Chiba Y, et al. Cilostazol administration with combination enteral and parenteral nutrition therapy remarkably improves outcome after subarachnoid hemorrhage[J]. Acta Neurochir. Suppl., 2015, 120: 147-152. |
| [10] |
Matsuda N, Naraoka M, Ohkuma H, et al. Effect of Cilostazol on Cerebral Vasospasm and Outcome in Patients with Aneurysmal Subarachnoid Hemorrhage:A Randomized, Double-Blind, Placebo-Controlled Trial[J]. Cerebrovasc. Dis., 2016, 42: 97-105. DOI:10.1159/000445509 |
| [11] |
Dorhout Mees SM, van den Bergh WM, Algra A, et al. Antiplatelet therapy for aneurysmal subarachnoid haemorrhage[J]. Cochrane Database Syst Rev, 2007. |
| [12] |
Dinicolantonio JJ, Lavie CJ, Fares H, et al. Meta-analysis of cilostazol versus aspirin for the secondary prevention of stroke[J]. Am. J. Cardiol., 2013, 112: 1230-1234. DOI:10.1016/j.amjcard.2013.05.067 |
| [13] |
邹长林. 炎症在蛛网膜下腔出血中的作用及机制研究进展[J]. 国际神经病学神经外科学杂志, 2017, 44(1): 83-86. |
| [14] |
Wan H, AlHarbi BM, Macdonald RL. Mechanisms, treatment and prevention of cellular injury and death from delayed events after aneurysmal subarachnoid hemorrhage[J]. Expert Opin Pharmacother, 2014, 15: 231-243. DOI:10.1517/14656566.2014.865724 |
| [15] |
Rogers KC, Oliphant CS, Finks SW. Clinical efficacy and safety of cilostazol:a critical review of the literature[J]. Drugs, 2015, 75: 377-395. DOI:10.1007/s40265-015-0364-3 |
| [16] |
Yamaguchi-Okada M, Nishizawa S, Mizutani A, et al. Multifaceted effects of selective inhibitor of phosphodiesterase Ⅲ, cilostazol, for cerebral vasospasm after subarachnoid hemorrhag e in a dog model[J]. Cerebrovasc. Dis., 2009, 28: 135-142. DOI:10.1159/000223439 |
| [17] |
Kawanabe Y, Takahashi M, Jin X, et al. Cilostazol prevents endothelin-induced smooth muscle constriction and proliferation[J]. PLoS ONE, 2012, 7: e44476. DOI:10.1371/journal.pone.0044476 |
| [18] |
Hashimoto A, Miyakoda G, Hirose Y, et al. Activation of endothelial nitric oxide synthase by cilostazol via a cAMP/protein kinase A-and phosphatidylinositol 3-kinase/Akt-dependent mechanism[J]. Atherosclerosis, 2006, 189: 350-357. DOI:10.1016/j.atherosclerosis.2006.01.022 |
| [19] |
徐晓玉. 西洛他唑防治脑卒中的研究进展[J]. 国际神经病学神经外科学杂志, 2013, 40(1): 62-67. |
| [20] |
宋锦宁, 张斌飞, 马旭东, 等. 西洛他唑用于动脉瘤性蛛网膜下腔出血患者疗效的meta分析[J]. 中华神经外科疾病研究杂志, 2013, 12(5): 400-404. DOI:10.3969/j.issn.1671-2897.2013.05.005 |
 2019, Vol. 46
2019, Vol. 46




