扩展功能
文章信息
- 张芹, 奥婷, 肖淑英, 许娜, 渠静, 张君, 张瑞华
- ZHANG Qin, AO Ting, XIAO Shu-Ying, XU Na, QU Jing, ZHANG Jun, ZHANG Rui-Hua
- 表皮生长因子协同体对大脑中动脉闭塞性脑梗死急性期的保护性作用研究
- Protective effect of epidermal growth factor coordination in the acute stage of middle cerebral artery occlusion
- 国际神经病学神经外科学杂志, 2019, 46(2): 127-131
- Journal of International Neurology and Neurosurgery, 2019, 46(2): 127-131
-
文章历史
收稿日期: 2018-11-05
修回日期: 2019-01-12
脑梗死已成为人类主要死因之一,存活者75%遗留不同程度的残疾,造成沉重的社会和经济负担[1, 2]。其病理生理涉及氧自由基损伤[3]、炎症反应[4]、氧化应激[5]、细胞坏死和凋亡[6]等多个环节,直接或间接导致神经元坏死或凋亡。目前除4.5 h内rt-PA静脉溶栓外,临床尚缺乏有效的药物,探索有效的神经保护措施,改善病理损害和临床预后是亟待解决的问题。
近期研究发现表皮生长因子(epidermal growth factor, EGF)在多种组织愈合过程中发挥作用。目前认为在缺血性脑卒中中EGF是强效的有丝分裂原,具有保护缺血神经元,维持其生存的作用,与中枢神经系统细胞、组织的增殖、生长、分化及再生密切相关[7, 8]。表皮生长因子协同体(epidermal growth factor-coordination, EGFC)是由毛叶绞股兰萃取物与EGF融合形成的一种能长期保持EGF活性的EGF协同共生体[9]。目前EGFC为应用于化妆品、保健品等的功能性生物原料,尚未有关于EGFC对脑卒中影响的相关研究。本研究通过建立大鼠大脑中动脉闭塞(acute middle cerebral artery occlusion, MCAO)/再灌注模型,观察各组动物脑梗死体积、脑组织含水量、脑组织中TNF-α、IL-1β、IL-6炎症因子含量的变化,探讨EGFC对大鼠大脑中动脉闭塞急性期的影响。
1 材料和方法 1.1 实验动物50只清洁级雄性SD大鼠(8~10周龄,体重280~300 g),购自北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】,所有动物均于动物房检疫合格。标准化饲养房饲养动物,室温20~22℃,相对湿度50%,每天交替进行12 h光照、12 h黑暗处理,喂养1周后进行实验。50只大鼠随机分为5组Sham组、MCAO组、低剂量EGFC组(2 μg)、中剂量EGFC组(20 μg)、高剂量EGFC组(200 μg),每组10只。各组大鼠周龄、体重比较差异无统计学意义(P>0.05),具有可比性。本实验大鼠处置方法经过本单位实验动物福利伦理委员会批准(编号:20170201)。
1.2 主要试剂EGFC由高美谷生物技术有限公司提供,用0.9%生理盐水稀释,配制成所需的EGFC溶液。
1.3 实验方法 1.3.1 动物模型制备MCAO模型制作方法:术前12 h禁食水,采用改良Zea-Longa法制备大鼠MCAO模型。手术过程如下:SD大鼠经异氟烷诱导并维持麻醉,仰卧位固定,颈正中线切口,沿胸锁乳突肌内缘分离肌肉和筋膜,暴露右侧颈总动脉(common carotid artery, CCA)、颈外动脉(external carotid artery, ECA)和颈内动脉(internal carotid artery, ICA),在CCA远心端和近心端及ECA处挂线备用。用动脉夹暂时夹闭ICA,然后近心端结扎CCA、ECA。然后在距CCA分叉部4 mm处剪一小口,将线栓插入到ICA,用绕在CCA远心端的细线轻轻系牢线栓,用眼科镊轻推线栓,从血管分叉处开始计算,当插入深度在18 mm时,系牢CCA远心端的细线,缝合伤口,单笼饲养观察。2 h后拔出线栓实现缺血/再灌注。术中监测体温、血压等生命体征,应用激光多普勒(PERIMED, PF5001)监测大鼠大脑中动脉分布区的血流量以保证模型成功。
Sham组模型制作同MCAO组,但分离血管后不进行线栓插入。
1.3.2 EGFC干预手术后3 h,EGFC组分别予腹腔注射2 μg、20 μg、200 μg的EGFC,每组10只大鼠。Sham组(10只)和MCAO组(10只)则腹腔注射生理盐水。给药体积恒定,为5 ml/kg。
1.3.3 脑梗死体积计算手术后24 h,麻醉动物,断头取出大鼠的脑组织,切成2 mm厚的冠状切片,行三苯基氯化四氮唑(2, 3, 5-triphenyltetrazolium chloride, TTC)染色。用Image J1.42加以分析(NIH图像分析软件)。为尽可能减少脑水肿带来的误差,计算脑梗死体积上采用间接计算法,即梗死体积占非脑梗死半球体积的百分比表达[10]。
1.3.4 脑组织含水量的测定本实验采用干湿重法测定脑组织含水量。术后24 h将大鼠断头处死,迅速取脑,取额极后约2 mm厚的脑组织用于脑含水量测定。将脑组织分为病变侧及病变对侧两部分。①将脑组织放于事先称重(A)的锡纸中,立即称重(B),B-A即得湿重;②用锡纸包裹脑组织,置入100℃烤箱内烘干24 h后取出恢复到室温,称重(C),C-A即得干重;③代入下列公式分别计算两侧脑组织含水量:(湿重-干重)/湿重×100%,即(B-C)/(B-A)×100%。
1.3.5 ELISA法检测脑组织中TNF-α、IL-1β、IL-6炎症因子采用ELISA法检测脑组织中TNF-α、IL-1β、IL-6含量,具体实验步骤按照试剂盒说明书操作进行。
1.4 统计学分析采用GraphPad Prism 6软件进行统计分析,多组间均数比较采用One-way ANOVA分析,组间两两比较采用SNK法。P<0.05为差异有统计学意义。
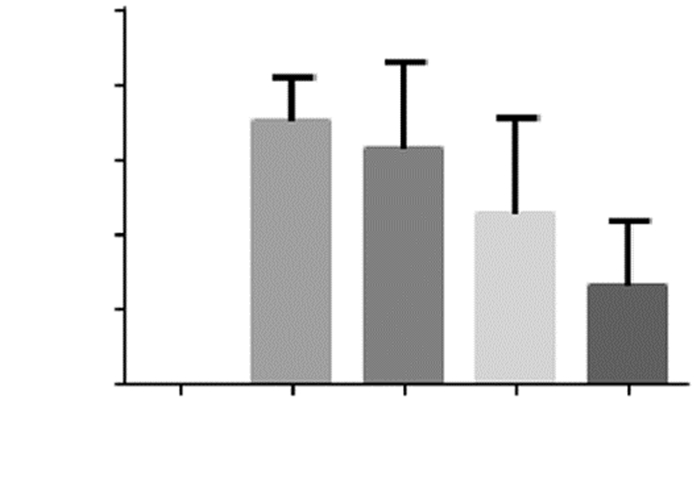
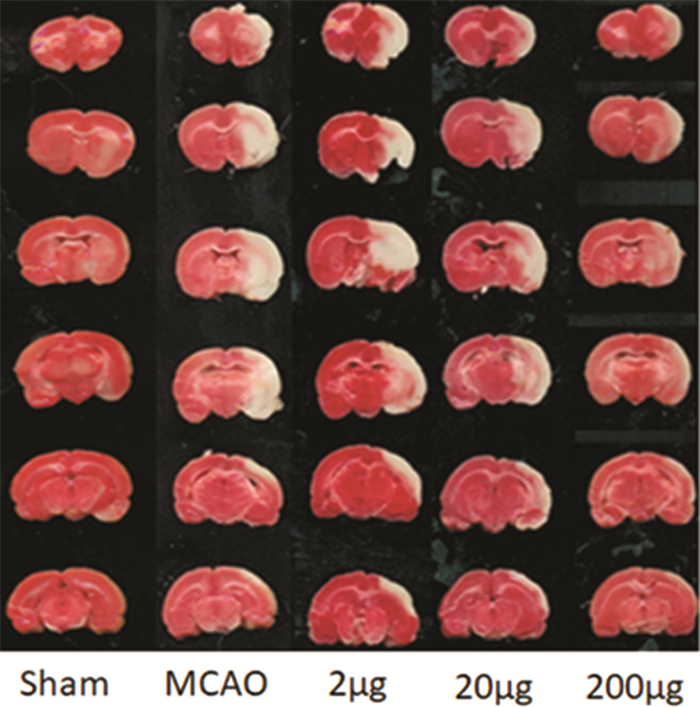
2 结果 2.1 各组大鼠脑梗死体积Sham组右侧脑组织红染,未见梗死灶,梗死体积为零;MCAO组及低剂量EGFC组(2 μg)、中剂量EGFC组(20 μg)、高剂量EGFC组(200 μg)大鼠可见苍白色梗死灶。与MCAO组相比,低剂量EGFC组、中剂量EGFC组、高剂量EGFC组大鼠梗死体积均减小,且随着给药剂量的增加,大鼠脑梗死体积呈减小趋势,当予200 μg时,差异有统计学意义(P<0.01)。与低剂量EGFC组相比,中剂量EGFC组、高剂量EGFC组大鼠脑梗死体积均呈减小趋势,予200 μg时,差异有统计学意义(P<0.01)。见图 1、图 2。
|
| 注:与Sham组比较,*P<0.05,**P<0.01;与MCAO组比较,##P<0.01;与低剂量EGFC组比较,& & P<0.01。 图 1 各组大鼠脑组织梗死体积 |
|
| 图 2 各组大鼠脑组织梗死体积(实体) |
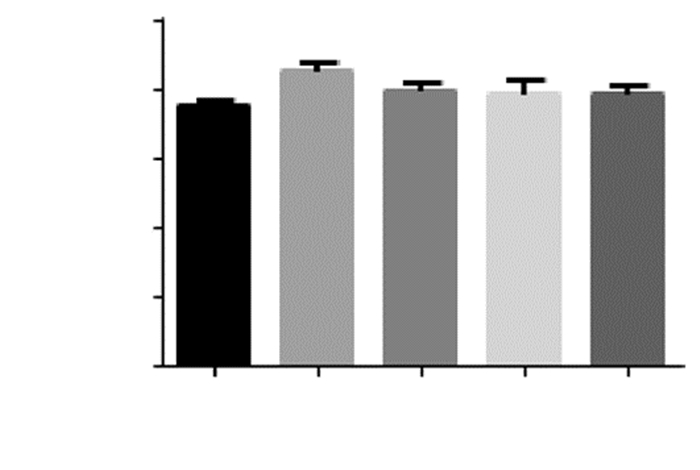
Sham组脑组织含水量正常,与Sham组相比,MCAO组脑组织含水量明显增加,出现严重的水肿(P<0.01);与MCAO组相比,低剂量EGFC组(2 μg)、中剂量EGFC组(20 μg)、高剂量EGFC组(200 μg)脑组织含水量均降低,差异有统计学意义(P<0.05),而在三组间无差异。见图 3。
|
| 注:*为与MCAO组比较,P<0.05;**为与Sham组比较,P<0.01。 图 3 各组大鼠脑组织含水量测定 |
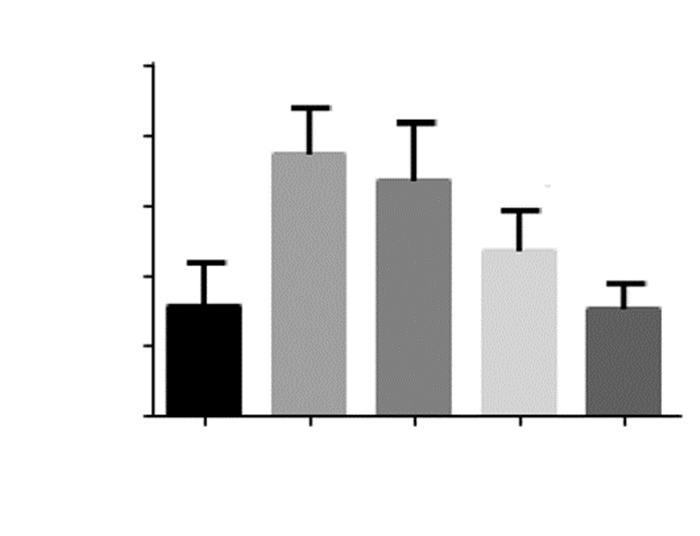
与Sham组相比,在MCAO组和低剂量EGFC组中TNF-α的含量明显升高,差异具有统计学意义(P<0.01)。MCAO模型建立后,与MCAO组相比,给予不同剂量的EGFC,实验大鼠脑组织中TNF-α含量均降低,给予中、高剂量EGFC时,差异有统计学意义(P<0.01)。与低剂量EGFC组相比,中剂量EGFC组、高剂量EGFC组TNF-α的含量均降低,差异均具有统计学意义(P<0.05, P<0.01),而高剂量EGFC组降低更明显。见图 4。
|
| 注:与Sham组比较,**P<0.01;与MCAO组比较,##P<0.01;与低剂量EGFC组比较,& P<0.05,& & P<0.01。 图 4 各组大鼠脑组织中TNF-α的含量 |
与Sham组相比,在MCAO组和低剂量EGFC组IL-1β的含量明显升高,差异具有统计学意义(P<0.01)。MCAO模型建立后,与MCAO组相比,中剂量EGFC组、高剂量EGFC组大鼠脑组织中IL-1β含量均降低,差异均有统计学意义(P<0.01)。与低剂量EGFC组相比,中剂量EGFC组、高剂量EGFC组IL-1β的含量均降低,差异均具有统计学意义(P<0.01),而高剂量EGFC组降低更明显。见图 5。
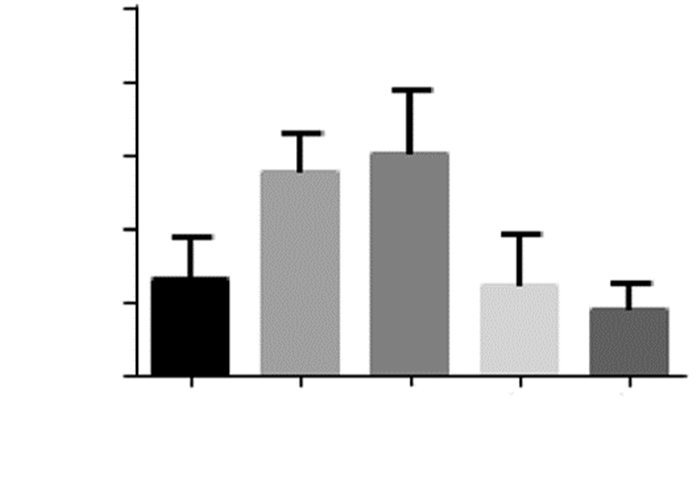
|
| 注:与Sham组比较,**P<0.01;与MCAO组比较,##P<0.01;与低剂量EGFC组比较,& & P<0.01。 图 5 各组大鼠脑组织中IL-1β的含量 |
与Sham组相比,MCAO组和低剂量EGFC组IL-6的含量明显升高,差异具有统计学意义(P<0.01)。MCAO模型建立后,与MCAO组相比,中剂量EGFC组、高剂量EGFC组大鼠脑组织中IL-6含量均降低,差异均有统计学意义(P<0.05, P<0.01)。与低剂量EGFC组相比,中剂量EGFC组、高剂量EGFC组IL-6含量均降低,差异均有统计学意义(P<0.05, P<0.01),而高剂量EGFC组降低更明显。见图 6。
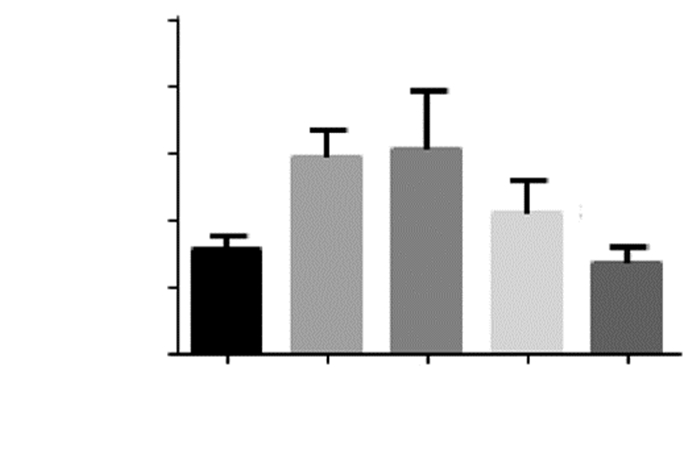
|
| 注:与Sham组比较,**P<0.01;与MCAO组比较,#P<0.05,##P<0.01;与低剂量EGFC组比较,& P<0.05,& & P<0.01。 图 6 各组大鼠脑组织中IL-6的含量。 |
EGF是由Cohen[11]在1986年首次报道的一种体内广泛表达的多肽生长因子,具有促进细胞增殖、抑制细胞凋亡等生物学作用。EGF是表皮生长因子受体(epidermal growth factor receptor, EGFR)/细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)信号转导通路的上游因子,与EGFR结合后,磷酸化激活ERK,产生级联反应,启动信号转导途径,发挥其生物学效应。
近年来研究发现EGF在脑梗死后脑保护方面发挥积极作用。脑梗死后的缺血再灌注,启动了ERK信号转导通路,导致N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid, NMDA)受体活性降低,阻止Ca2+内流,在神经元功能保护中发挥了重要作用[12]。在脑缺血后12 h,EGF在缺血中心区及半暗带区的表达达高峰,在缺血48 h时仍可维持较高水平,且其在缺血半暗带区的表达量明显高于缺血中心区[13]。EGF联合生长激素释放肽-6可以显著改善急性脑梗死的病理改变和临床表现,促进神经功能的恢复[14]。对于亚急性期大脑中动脉梗死大鼠,EGF亦可明显缩短其康复时间[15]。
笔者认为,作为EGF的协同体,EGFC可能与EGF具有类似的生物学作用。本研究中,腹腔注射EGFC后,大鼠脑组织的梗死体积减小,且在TTC染色法中观察到给药剂量为200 μg时,梗死体积减小最为显著,表明EGFC对大鼠大脑中动脉闭塞急性期的脑组织具有保护作用,且在一定范围内,随着给药剂量的增加,保护作用增强。EGFC的脑保护作用与文献报道中EGF的作用相一致。笔者还发现,腹腔注射EGFC后,大鼠脑组织的含水量均较对照组降低,说明脑水肿程度均降低,但低剂量组、中剂量组、高剂量组之间差异无统计学意义,说明EGFC对脑缺血再灌注损伤组织具有保护作用。但本实验组间差异无统计学意义可能与观察时间较短(因仅观察了术后24 h脑组织水肿程度的变化),尚未达到脑梗死病理过程中脑组织水肿最严重的时期——坏死期(24~48 h)有关,这为后续实验提供了方向。
有研究表明,在机体组织受损、缺氧和氧化应激等情况下,EGF表达水平显著升高。EGF可以减轻肠道缺血再灌注损伤后的细菌移位和炎症因子的表达,可增加坏死性肠炎时肠道微血管血流量,改善失血性休克后肠道的微循环[16, 17]。在缺血性脑卒中中EGF可减少氧自由基的产生,保护缺血神经元。脑缺血再灌注损伤可以导致大量炎性因子的释放,包括IL-1,IL-6、TNF-a及活性氧等,它们在缺血再灌注损伤中发挥了重要作用[18, 19],抑制其表达可减轻缺血性脑损伤[20]。本研究中发现,腹腔注射EGFC后,采用ELISA法检测脑组织中TNF-α、IL-1β、IL-6的含量,与MCAO组相比,中剂量EGFC组、高剂量EGFC组大鼠脑组织中TNF-α、IL-1β、IL-6的含量均降低,且在一定范围内,高剂量EGFC组降低更明显,但中剂量组与高剂量组之间差异无统计学意义,推测,EGFC可能通过抑制脑组织缺血再灌注损伤后的炎症反应来发挥其保护缺血神经元的作用,这与EGF相关的文献报道相符。本研究还发现,随着EGFC剂量的增加,脑组织中炎性因子的含量降低更显著,说明对缺血脑组织炎性反应的抑制作用越强,但中剂量组与高剂量组之间无统计学意义,笔者认为可能与样本量较少,EGFC的给药剂量梯度较小有关,在今后的实验中,需增加实验样本量,增大EGFC的剂量梯度,这为团队今后的研究提供了方向。
综上所述,EGFC对大鼠大脑中动脉闭塞急性期的脑组织具有一定的保护作用,在今后的研究中,可以从炎症反应、氧化应激等方面进一步探讨EGFC保护作用的产生机制,为其临床转化进一步提供理论依据。
| [1] |
Minnerup J, Sutherland BA, Buchan AM, et al. Neuroprotection for stroke:current status and future perspectives[J]. Int J Mol Sci, 2012, 13(9): 11753-11772. |
| [2] |
Neuhaus AA, Couch Y, Hadley G, et al. Neuroprotection in stroke:the importance of collaboration and reproducibility[J]. Brain, 2017, 140(8): 2079-2092. DOI:10.1093/brain/awx126 |
| [3] |
Suzuki G, Okamoto K, Kusano T, et al. Evaluation of neuronal protective effects of xanthine oxidoreductase inhibitors on severe whole-brain ischemia in mouse model and analysis of xanthine oxidoreductase activity in the mouse brain[J]. Neurol Med Chir (Tokyo), 2015, 55(1): 77-85. DOI:10.2176/nmc.oa.2013-0307 |
| [4] |
Sodha NR, Sellke FW. Attenuation of inflammatory responses by hydrogen sulfide (H(2)S) in ischemia/reperfusion injury[J]. Methods Enzymol, 2015, 555: 127-144. DOI:10.1016/bs.mie.2014.11.041 |
| [5] |
Kalaivani P, Ganesh M, Sathiya S, et al. Alteration in bioenergetic regulators, SirT1 and Parp1 expression precedes oxidative stress in rats subjected to transient cerebral focal ischemia:molecular and histopathologic evidences[J]. J Stroke Cerebrovasc Dis, 2014, 23(10): 2753-2766. DOI:10.1016/j.jstrokecerebrovasdis.2014.06.026 |
| [6] |
Liu B, Zhang Y H, Jiang Y, et al. Gadd45b is a novel mediator of neuronal apoptosis in ischemic stroke[J]. Int J Biol Sci, 2015, 11(3): 353-360. DOI:10.7150/ijbs.9813 |
| [7] |
Wang Y, Cooke M J, Lapitsky Y, et al. Transport of epidermal growth factor in the stroke-injured brain[J]. J Control Release, 2011, 149(3): 225-235. DOI:10.1016/j.jconrel.2010.10.022 |
| [8] |
Cooke MJ, Wang Y, Morshead CM, et al. Controlled epi-cortical delivery of epidermal growth factor for the stimulation of endogenous neural stem cell proliferation in stroke-injured brain[J]. Biomaterials, 2011, 32(24): 5688-5697. DOI:10.1016/j.biomaterials.2011.04.032 |
| [9] |
冯耀宗.能长期保持表皮细胞生长因子EGF活性的EGF协同共生体及其制备方法[P].中国, CN201310282841.1, 2013-09-25.
|
| [10] |
Geng X, Elmadhoun O, Peng C, et al. Ethanol and normobaric oxygen:novel approach in modulating pyruvate dehydrogenase complex after severe transient and permanent ischemic stroke[J]. Stroke, 2015, 46(2): 492-499. |
| [11] |
Cohen S. Nobel lecture. Epidermal growth factor[J]. Biosci Rep, 1986, 6(12): 1017-1028. DOI:10.1007/BF01141022 |
| [12] |
Yang SI, Yuan Y, Jiao S, et al. Calcitonin gene-related peptide protects rats from cerebral ischemia/reperfusion injury via a mechanism of action in the MAPK pathway[J]. Biomed Rep, 2016, 4(6): 699-703. DOI:10.3892/br.2016.658 |
| [13] |
沈顺姬, 杨净, 李婧, 等. 大鼠局灶性脑缺血损伤中表皮生长因子的表达变化的意义[J]. 中国临床康复, 2003, 7(31): 4180-4181. DOI:10.3321/j.issn:1673-8225.2003.31.024 |
| [14] |
Garcia DBD, Martinez NS, Coro-Antich RM, et al. Epidermal growth factor and growth hormone-releasing peptide-6:combined therapeutic approach in experimental stroke[J]. Restor Neurol Neurosci, 2013, 31(2): 213-223. |
| [15] |
Jeffers MS, Hoyles A, Morshead C, et al. Epidermal growth factor and erythropoietin infusion accelerate functional recovery in combination with rehabilitation[J]. Stroke, 2014, 45(6): 1856-1858. DOI:10.1161/STROKEAHA.114.005464 |
| [16] |
Rocourt DV, Mehta VB, Besner GE. Heparin-binding EGF-like growth factor decreases inflammatory cytokine expression after intestinal ischemia/reperfusion injury[J]. J Surg Res, 2007, 139(2): 269-273. |
| [17] |
Zhang HY, Radulescu A, Chen Y, et al. HB-EGF improves intestinal microcirculation after hemorrhagic shock[J]. J Surg Res, 2011, 171(1): 218-225. DOI:10.1016/j.jss.2010.01.024 |
| [18] |
Iadecola C, Alexander M. Cerebral ischemia and inflammation[J]. Curr Opin Neurol, 2001, 14(1): 89-94. |
| [19] |
Stoll G, Jander S, Schroeter M. Detrimental and beneficial effects of injury-induced inflammation and cytokine expression in the nervous system[J]. Adv Exp Med Biol, 2002, 513: 87-113. |
| [20] |
Wang ZQ, Chen XC, Yang GY, et al. U0126 prevents ERK pathway phosphorylation and interleukin-1beta mRNA production after cerebral ischemia[J]. Chin Med Sci J, 2004, 19(4): 270-275. |
 2019, Vol. 46
2019, Vol. 46




