扩展功能
文章信息
- 易海波, 林瑞生, 林巧珍, 李榕, 于涛, 陈明
- YI Hai-bo, LIN Rui-sheng, LIN Qiao-zhen, LI Rong, YU Tao, CHEN Ming
- 神经电生理监测与术中彩超辅助下经侧裂显微手术治疗岛叶胶质瘤
- Clinical efficacy of neurophysiological monitoring and intraoperative color Doppler ultrasound-assisted microsurgery via lateral fissure approach in treatment of insular glioma
- 国际神经病学神经外科学杂志, 2019, 46(1): 7-11
- Journal of International Neurology and Neurosurgery, 2019, 46(1): 7-11
-
文章历史
收稿日期: 2018-10-27
修回日期: 2019-01-22
2. 福建医科大学附属漳州市医院超声科, 福建 漳州 363000
2. Department of Neurosurgery the Affiliated Zhangzhou Municipal Hospital, Fujian Medical University, Fujian Zhangzhou 363000, China
因岛叶胶质瘤位置深且与重要结构、血管关系密切,故岛叶胶质瘤手术全切率低而导致短期内复发,手术后的偏瘫、失语等并发症高。如何在保护重要血管及降低对功能区的损伤而减少并发症的同时,提高手术全切除率,是我们神经外科医师所不断努力的方向。本文通过分析福建医科大学附属漳州市医院神经外科采用术中神经电生理监测联合术中彩超经侧裂入路显微外科手术岛叶胶质瘤病例21例,其疗效总结如下。
1 资料与方法 1.1 临床资料福建医科大学附属漳州市医院神经外科2015年1月~2018年1月手术并经病理证实的岛叶胶质瘤病例21例,男9例,女12例;初发20例,复发1例(女性);年龄34~71岁,平均45.8岁;病程1月~9年,平均21个月。首发症状:癫痫9例,头痛6例,肢体运动感觉障碍4例,混合性失语2例。患者术前常规行颅脑MRA平扫+增强、DTI、MRS。纯岛叶胶质瘤7例, 岛叶累及额叶胶质瘤5例, 岛叶累及颞叶胶质瘤6例, 岛叶累及额叶、颞叶胶质瘤3例。以2013年1月至2014年12月福建医科大学附属漳州市医院神经外科未采用神经电生理监测及术中彩超且经皮质入路切除的19例岛叶肿瘤患者为对照组,其中男12例,女7例,年龄20~67岁,平均46.2岁。首发症状:癫痫6例,头痛7例,肢体运动感觉障碍3例,失语2例,记忆力减退1例。纯岛叶胶质瘤5例, 岛叶累及额叶胶质瘤7例, 岛叶累及颞叶胶质瘤5例, 岛叶累及额叶、颞叶胶质瘤2例。
1.2 手术方法患者采取仰卧位,头部向对侧旋转45°~60°,用头架或头托固定头部。根据肿瘤大小和累及范围,采用改良翼点或扩大翼点入路开颅,骨窗大小要根据病变情况彻底显露出外侧裂及受累及的岛盖部。术中神经电生理监测四肢体感诱发电位(SSEP)、经颅四肢运动诱发电位(TCeMEP)、四肢肌自发肌电图(Free EMG)。硬脑膜剪开后先使用术中彩超明确术前图像,定位出肿瘤大小、范围及与周边结构的关系,并以此确定分离打开外侧裂的范围。显微镜下于额侧解剖分离外侧裂,打开外侧裂后先暴露出岛尖部,自岛尖向深部分离,暴露出大脑中动脉M1段及其分叉,明确最外侧豆纹动脉的位置。M2段及其分支常与肿瘤关系密切,手术时应仔细辨认并保护M2及其较粗的穿动脉。使用超声刀(CUSA)行瘤内切除,肿瘤切除的范围和深度应根据神经电生理监测、术中彩超、肿瘤组织与正常组织的差异及影像学分析等综合判断。对于累及颞极的肿瘤,可加做前颞叶切除。对于累及眶额叶的肿瘤,可加做眶额叶切除。术中注意事项:(1)解剖外侧裂时应注意保护外侧裂血管,尤其是外侧裂静脉。如果脑压高,可以先打开外侧裂池、视交叉池、颈内动脉池放出脑脊液,待脑压下降后再解剖外侧裂;(2)建议使用超声刀(CUSA)行瘤内切除,使用超声刀大大增加了肿瘤的切除效率,同时也减少了热损伤;(3)打开外侧裂后要先暴露并识别大脑中动脉及其分支,穿瘤体正常血管、过路血管应予以保留,应重点保护豆纹动脉;(4)运动诱发电位的波幅降低(波幅下降最多不能超过50%),应停止该处切除平面的深部切除。
1.3 术后处理术后常规予预防感染、预防(抗)癫痫、控制颅内压、抗血管痉挛等治疗。术后均行MGMT、IDH1、IDH2、1p/19q等常规分子病理检测,术后复查发现肿瘤残留,应根据常规病理及分子病理结果,个体化化疗和放疗。如出现肢体活动障碍、失语等功能障碍,应积极康复功能锻炼及药物治疗。
2 结果 2.1 手术疗效术后3天内复查颅脑MRI平扫+增强,与术前颅脑MR对比以评估切除程度(见图 1)。2组手术切除效果比较(见表 1),电生理彩超组手术全切率为66.66%,明显高于对照组(15.79%),具有显著性差异。2组均无死亡病例。21例患者中4例术后新出现对侧肢体运动功能障碍,术后1个月有3例完全恢复,1例出现远期运动功能障碍。其中3例术后新出现语言功能障碍,术后1个月2例恢复至术前水平,1例明显好转。术前存在肢体运动感觉障碍和语言功能障碍的患者,术后均有不同程度的好转。
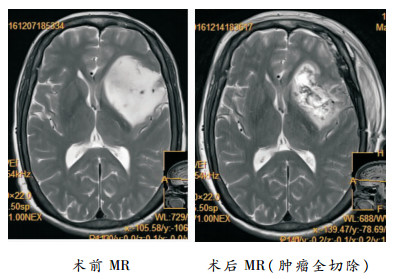
|
| 图 1 左岛叶胶质瘤术前、术后MR图像 |
弥漫性星形细胞瘤(WHO Ⅱ级)12例, 少突胶质细胞瘤(WHO Ⅱ级)2例,间变性星形细胞瘤(WHO Ⅲ级)5例, 胶质母细胞瘤(WHO Ⅳ级)2例。
2.3 随访术后随访6~36个月,低级别胶质瘤全部生存,14例Ⅱ级胶质瘤未复发,5例Ⅲ级胶质瘤中有1例术后2年复发,2例胶质母细胞瘤术后1年均复发,这2例2年内均死亡。21例患者中有5例全切除低级别胶质瘤(低风险组)患者未行放疗,但有化疗(替莫唑胺单药化疗6疗程),其余16例患者术后均行同步放化疗及之后至少6个疗程的化疗(替莫唑胺单药化疗)。
3 讨论胶质瘤的手术原则是以最小程度的组织和神经功能损伤获得最大程度的肿瘤切除。胶质瘤的切除程度是预后最为关键的因素之一,肿瘤的全切除是预防和延缓复发最有效的手段[1]。岛叶胶质瘤中以低级别胶质瘤较常见。低级别胶质瘤的手术目标是全切肿瘤而又不明显致残。最大范围安全切除肿瘤有助于延长低级别胶质瘤的复发间期。低级别胶质瘤部分切除与全切除相比,病变复发风险为1.4倍,死亡风险为4.9倍[2]。岛叶位于外侧裂深处且构成外侧裂的底部,完全被功能性额眶盖、额顶盖及颞盖所覆盖,岛叶皮层下有内囊、屏状核、豆状核、尾状核和丘脑等重要结构,岛叶表面有大脑中动脉M2段(岛段)。因此,岛叶胶质瘤的手术目前仍然是我们神经外科医生所面临的难点之一。岛叶病变的手术首先要考虑选择事宜的手术入路,就是要考虑如何距离病变最近、如何最大程度暴露病变、如何尽早阻断病变血供,这对治疗岛叶病变至关重要。经额或颞部皮质入路是岛叶病变传统的手术入路,这种入路最大限度地减少对侧裂血管的骚扰,从而减少了血管损伤和血管痉挛的发生。但同时导致了大脑中动脉及其分支发现晚、距离病变远、解剖关系欠清楚,这样就导致了肿瘤全切率低、短期内肿瘤复发和术后的偏瘫、失语等并发症增高。经外侧裂入路能在早期对大脑中动脉主干及其分支进行辨识,并识别外侧豆纹动脉和岛叶动脉。这样就能够尽早的保护正常血管,阻断病变的血液供应。分离打开外侧裂这个自然间隙,随着手术的进行,外侧裂隙逐渐扩大,常不需过度牵拉额、颞叶,减少了额、颞叶的损伤,即减少了失语等并发症。目前,对于岛叶胶质瘤的手术大多数学者主张采用经外侧裂入路,但对手术者的显微外科操作技术提出了更高的要求。随着显微神经外科技术、神经导航技术、术中神经电生理监测、术中彩超、功能导航及术中磁共振技术的发展,岛叶胶质瘤的手术结果得到了显著改善。目前,国内外对于岛叶胶质瘤手术主要采用术中神经电生理监测、神经导航、术中彩超、术中唤醒等辅助手术技术,有条件的医院采用术中磁共振实时影像导航、DTI导航等辅助技术,可以达到最大程度地安全切除岛叶胶质瘤[3]。但对于大部分医院来说,这些硬件费用昂贵,无法普及。
术中神经电生理监测在神经外科功能区的手术中已得到了普遍的常规应用,已是功能区胶质瘤手术中脑功能保护的最重要辅助技术。对于岛叶胶质瘤的手术,术中神经电生理监测可以精准的确定肿瘤切除范围的功能界限,而不是主观的依靠解剖界限,减少了手术的盲目性,降低了神经功能的损伤。在术中神经电生理监测下,如果运动诱发电位的波幅降低(波幅下降最多不能超过50%),应停止该处切除平面的深部切除,这样可以有效避免术后发生严重功能障碍。本组21例病例中有3例出现了术中运动诱发电位的波幅降低(见图 2),立即停止了该处的深部切除,术后出现了轻瘫,经治疗完全恢复。
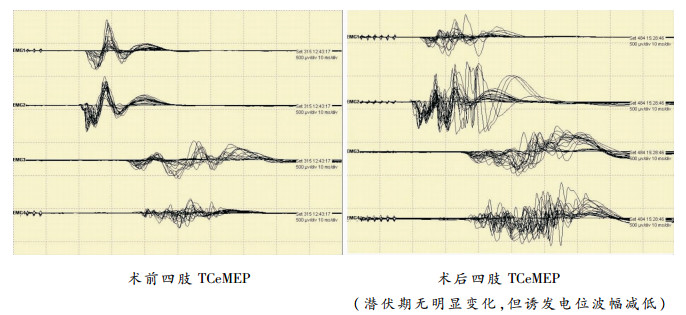
|
| 图 2 术中神经电生理监测术前、术中结果(EMG1左侧踇展肌、EMG2右侧踇展肌、EMG3左侧拇短展肌、EMG4右侧拇短展肌) |
术中彩超由于其操作简便、容易推广、便携等独特优势,已被广泛应用于神经外科手术中[4]。脑胶质瘤手术中利用彩超具有以下优势: (1)能准确定位病灶,测量病变距脑皮层的距离,引导手术路径,避免不必要的损伤;(2)可提供实时图像,可纠正由于术中脑组织移位而引起定位偏差的问题;(3)能确定脑胶质瘤边界,对低级别胶质瘤更有价值[5];(4)术中可多次反复扫描与切除前超声影像对比,以此来监测病灶的切除情况[6]。在本组患者中,分离外侧裂前常规彩超扫描,确定出肿瘤的大小、深度、范围、与周边结构的关系,并以此确定分离打开外侧裂的范围。术中根据解剖和临床经验判断肿瘤切除情况出现困难时,可利用术中彩超对肿瘤切除的程度进行评估,必要时可与术前超声图像进行对比。如果发现肿瘤残留,可再次明确残余肿瘤的大小、位置、深度等情况,从而指导再次切除,这样可多次术中彩超监测肿瘤切除情况直至肿瘤最大程度的安全的切除(见图 3)。但是超声的图像易受到出血、空气等影响,同时操作者、仪器设备也影响了术中超声的判断[7]。如出现不易判断是否肿瘤残留,应仔细对比术前超声图像加以判断,同时应根据术前影像学分析、肿瘤组织与正常组织的差异、术中电生理监测等综合判断。虽然术中彩超的实时图像与术中磁共振图像相比存在不直观、较易受干扰等不足,但术中彩超能减少肿瘤的残留及提高肿瘤的全切率,仍不失为一种有效的安全的易普及的辅助手术技术。应用神经导航可以准确定位出病灶的位置、范围及边界,并能根据病变位置设计到达病灶区域最短路径。但本组手术均采用经侧裂入路,手术切口、入路也相对固定,无需根据神经导航来设计。另外,侧裂打开后脑脊液流出而引起脑移位,同时随着肿瘤的切除,脑移位越来越明显,如果没有术中的实时图像数据(如术中磁共振),神经导航图像将会产生明显的漂移,这样神经导航在术中就会失去相应的作用。术中彩超提供的是实时图像,很好的解决了这一问题。
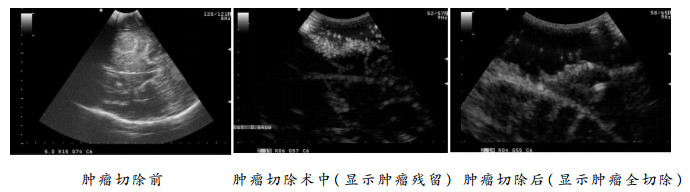
|
| 图 3 术中肿瘤切除前、中、后彩超 |
岛叶胶质瘤术后最常见的并发症是对侧肢体运动障碍和语言障碍。大多数永久性功能障碍是因血管因素所致,术后永久性神经功能障碍的客观原因是豆纹动脉供血的岛叶深部区域脑梗塞。最常见的是外侧豆纹动脉的损伤所致[8]。早期识别和保护豆纹动脉至关重要,我们可以术前行MRA或DSA检查掌握豆纹动脉与胶质瘤内侧界的关系来保护豆纹动脉。
偏瘫也可能是损伤了内囊后支,对于此种情况的预防主要是掌握肿瘤切除的深度。语言障碍也可能是对功能性岛盖(额盖、颞盖)的牵拉,损伤了Broca区或(和)Wernick区,导致失语。Yasargil建议术中尽量不使用或少使用牵开器,使用棉团衬垫显露;根据肿瘤大小和范围充分解剖外侧裂,以减少对功能性岛盖的牵拉。因此,防止术后并发症的关键是精确控制切除深度和切除范围、避免损伤豆纹动脉和深部传导束、避免过度牵拉功能性岛盖。
术中神经电生理监测联合术中彩超经侧裂入路下显微外科手术治疗岛叶胶质瘤,提高了肿瘤手术切除的安全系数和全切率,效果更为理想。且可以在完全切除肿瘤的同时,能有效的保护周围重要结构和血管,减少了术后并发症的发生。
| [1] |
Filippini G, Falcone C, Boiardi A, et al. Prognostic factors for survival in 676 consecutive patients with newly diagnosed primary glioblastoma[J]. Neuro Oncol, 2008, 10(1): 79-87. DOI:10.1215/15228517-2007-038 |
| [2] |
Smith JS, Chang EF, Lamborn KR, et al. Role of Extent of Resection in the Long-Term Outcom of Low-Grade Hemispheric Gliomas[J]. J Clin Oncol, 2008, 26(8): 1338-1345. DOI:10.1200/JCO.2007.13.9337 |
| [3] |
庄冬晓, 吴劲松, 姚成军, 等. 3.0T术中磁共振实时影像功能导航联合术中神经电生理监测技术在岛叶胶质瘤手术中的应用[J]. 中国神经精神疾病杂志, 2012, 38(4): 207-211. DOI:10.3969/j.issn.1002-0152.2012.04.003 |
| [4] |
秦立森, 郭俊, 张新源, 等. 术中B超辅助经侧裂入路岛叶胶质瘤显微外科治疗[J]. 临床神经外科杂志, 2013, 10(2): 100-102. DOI:10.3969/j.issn.1672-7770.2013.02.011 |
| [5] |
田永, 吉林松, 刘会昭, 等. 术中超声判定脑胶质瘤边界的应用价值[J]. 中华医学杂志, 2009, 89(19): 1305-1305. DOI:10.3760/cma.j.issn.0376-2491.2009.19.004 |
| [6] |
阮航, 杨国平, 吴京雷, 等. 术中B超定位在深部脑占位病变手术中的应用[J]. 临床神经外科杂志, 2011, 8(3): 162-162. |
| [7] |
Li ZH, Chen XS, Shi ZS, et al. Ultrasonography guided volumetric resection of supratentorial gliomas[J]. Clin Med, 2012, 32(3): 17-19. |
| [8] |
张方成, 陈俊瑜, 王孟阳. 岛叶胶质瘤的手术治疗[J]. 华中科技大学学报(医学版), 2013, 42(1): 103-105. DOI:10.3870/j.issn.1672-0741.2013.01.022 |
 2019, Vol. 46
2019, Vol. 46


