扩展功能
文章信息
- 马宗艳, 蔡宏斌, 裴丽娟, 郭文婷, 范祯祯, 杨玉, 葛朝明
- MA Zong-Yan, CAI Hong-Bin, PEI Li-Juan, GUO Weng-Ting, Fan Zhen-Zhen, Yang Yu, GE Zhao-Ming
- 血清晚期糖基化终末产物和可溶性晚期糖基化终末产物受体与阿尔茨海默病及血管性痴呆关系的研究
- Association of serum advanced glycation end products and soluble receptor for advanced glycation end products with Alzheimer's disease and vascular dementia
- 国际神经病学神经外科学杂志, 2019, 46(1): 55-59
- Journal of International Neurology and Neurosurgery, 2019, 46(1): 55-59
-
文章历史
收稿日期: 2018-07-31
修回日期: 2018-10-28
2. 甘肃省第三人民医院神经内科, 甘肃省兰州市 730000
痴呆已成为全球范围内严重的公共卫生负担,根据2016年世界老年痴呆报告,全世界超过4 700万人患有此病,预计到2050年将增加到1.31亿,每年约有770万新发痴呆患者,严重影响老年人的生活质量和身心健康,同时加重了家庭和社会的负担[1, 2]。其中发病率最高的为阿尔茨海默病(Alzheimer's disease, AD),在75岁以上老年痴呆患者中约占69%[3],血管性痴呆(vascular dementia, VaD)在痴呆患者中占第二位,约占全球痴呆病例的17%~25%。越来越多的研究结果表明AD和VaD在发病机制及病理学改变上存在很多的重叠现象[4, 5]。近年来,晚期糖基化终末产物(advanced glycation end products, AGEs)与认知功能障碍的关系越来越被关注,并认为AGEs可能也是引起AD的原因之一[6]。闫福岭等[7]研究表明,AGEs可能是VaD和急性脑梗死患者发病的共同危险因素,推测两因素通过参与脑血管损伤导致脑梗死,进一步引发VaD。有研究证实,血清可溶性RAGE(soluble RAGE, sRAGE)水平与痴呆明显相关[8, 9],但因为对sRAGE水平可造成影响的因素较多,关于sRAGE是否可以作为诊断痴呆的生物标志物,尚存在争议。在同一研究中描述AGEs与sRAGE在VaD、AD、N-VaD及正常对照组间的水平及差异的研究较少。本研究就上述指标在AD、VaD、N-VaD和正常人群之间的差异进行比较,旨在探索不同指标与AD、VaD之间可能的联系,探寻可能的具有诊断价值的生物标志物,为早期发现、诊断、预防疾病提供临床参考依据。
1 对象与方法 1.1 研究对象收集同期兰大二院神经内科就诊的符合纳入排除标准的34例阿尔茨海默病患者为AD组,其中男14例,女20例,年龄分布为65~87岁,平均年龄为73.35±6.21岁;脑梗死后血管性痴呆的64例患者为VaD组,其中男39人,女25人,年龄分布65~88岁,平均年龄为75.20±6.30岁;脑梗死非痴呆组患者51例为N-VaD组,其中男31例,女20例,年龄分布为65~86岁,平均年龄为73.27±5.59岁;收集同期的31例健康体检者为对照组,其中男20例,女11例,年龄分布为65~82岁,平均年龄为73.29±4.50岁,符合正常对照组的纳入排除标准。
纳入标准:阿尔茨海默病参照美国国家神经病及语言障碍和卒中研究所——阿尔茨海默病及相关疾病协会(NINCDS-ADRDA)标准及美国国立衰老研究院和阿尔茨海默病协会(National Institute on Aging and Alzheimer’s Association, NIA-AA)标准;血管性痴呆参照美国精神医学会的《精神诊断和统计手册》第四版修订版的诊断标准或符合美国国立精神病与卒中研究所/瑞士神经科学研究国际协会(NINDS-AIREN)的血管性痴呆诊断标准;脑梗死非痴呆组有符合全国第四届脑血管病学术会议制定的诊断标准的脑卒中病史,并符合经头颅MR或头颅CT明确有一个或多个缺血病灶,复发性脑梗死或初次梗死后病程≥3月,MMSE量表评定在正常范围。正常对照组为无脑卒中病史及神经系统的症状及体征,头颅CT和头颅MR证实无异常,无认知功能减退主诉,MMSE评分在正常范围内,无严重疾病的住院体检者。
排除标准:①额颞叶痴呆、路易体痴呆、脑积水、帕金森病、甲状腺疾病等影响认知功能的疾病;②抑郁、焦虑等精神疾病;③颅内感染及其他严重自身免疫性疾病史;④过去3个月使用影响认知能力的药物;⑤严重疾病(恶性肿瘤,严重的肝肾功能损伤);⑥任何由于其他原因不适合参加。
该研究已得到伦理委员会批准,并已取得研究对象的知情同意。
1.2 研究方法研究对象于入院4 h内由专业神经科医师询问病史并记录人口学资料,同时行神经系统体格检查;入院第2日清晨空腹肘静脉采血。标本置于无抗凝剂离心管中,1 h后以3 000 r/min离心10 min后分离出血清,将分离的血清用冻存管分装后于-80度冰箱冻存,用于血清AGEs及sRAGE等指标的检测。将冻存的标本置于37℃水浴箱中速溶后检测血清AGEs、sRAGE水平,使用全波长GeminiXPS荧光型酶标仪进行分析。
完善头颅CT或头颅MR、心电图、胸片等检查。收集纳入研究对象的姓名、性别、年龄、身高、体重、糖尿病史、脑卒中病史;评定简易智力状态检查(Mini-mental State Examination, MMSE)及缺血指数量表(HachinskiInchemicScore, HIS)评分;计算体重指数(BMI)=体重/身高2(kg/m2)。
1.3 统计学分析采用SPSS 22.0软件进行分析,对所有计量资料在分析前进行正态性检验。满足正态分布者以均数±标准差(x±s)表示,采用两独立样本t检验进行两组间比较,采用单因素方差分析进行多组间比较;对不满足正态分布者以中位数[M(P25, P75)]表示,组间及组内比较采用非参数检验。计数资料采用例数或百分比(%)表示,组间比较采用卡方检验。相关性分析采用Spearman秩相关分析法;绘制ROC曲线,计算AGEs对AD、VaD的诊断价值。
2 结果 2.1 4组间基本资料比较四组患者在性别、年龄、糖尿病史、BMI方面无显著性差异(P>0.05)。在MMSE评分上存在显著性差异,其中VaD组、AD组的MMSE评分明显低于N-VaD组和正常对照组(P < 0.05);N-VaD组和正常对照组的MMSE评分无显著性差异(P>0.05)。见表 1。
| 项目 | VaD组(n=64) | AD组(n=34) | N-VaD组(n=51) | 正常对照组(n=31) | χ2/t | P |
| 男性 | 39 | 14 | 31 | 20 | 4.869 | 0.182 |
| 年龄(岁) | 75.20±6.30 | 73.35±6.21 | 73.27±5.59 | 73.29±4.50 | 1.474 | 0.223 |
| BMI(kg/m2) | 22.70±2.70 | 23.52±3.37 | 23.95±3.45 | 23.50±3.52 | 1.521 | 0.211 |
| 糖尿病 | 26 | 8 | 17 | 7 | 4.594 | 0.204 |
| AGEs(ng/L) | 425.97(362.19, 488.24)bc | 510.85(414.32, 646.02)ad | 531.14(454.20, 617.27)ad | 438.30(335.68, 487.39)bc | 23.267 | 0.000 |
| sRAGE(ng/L) | 250.17(193.56, 293.43) | 221.02(182.24, 275.73) | 246.01(178.81, 321.57) | 238.31(179.75, 280.51) | 1.417 | 0.702 |
| MMSE评分 | 13.55±6.68bcd | 18.12±5.36acd | 27.67±1.52ab | 27.74±1.21ab | 112.370 | 0.000 |
| 注:a为与VaD组比较;b为与AD组比较;c为与N-VaD组比较;d为与正常对照组比较。 | ||||||
血清AGEs在四组间差异有统计学意义(P < 0.05)。AD组AGEs水平高于VaD组和正常对照组,差异有统计学意义(P < 0.05);N-VaD组AGEs水平高于VaD组和正常对照组,差异有统计学意义(P < 0.05);其中VaD组和正常对照组之间,AD组和N-VaD组之间无显著性差异(P>0.05)。sRAGE水平在4组间比较,差异无统计学意义(P>0.05)。见表 1。
2.3 相关性分析采用Spearman秩相关法,对年龄、糖尿病、BMI、AGEs、sRAGE等指标与MMSE评分进行相关性分析,结果显示,年龄与MMSE评分呈负相关;BMI与MMSE评分呈正相关;糖尿病史、AGEs、sRAGE与MMSE评分无明显相关性。见表 2。
| 统计值 | 年龄 | 糖尿病史 | BMI | AGEs | sRAGE |
| r | -0.168 | -0.094 | 0.151 | 0.135 | 0.001 |
| P | 0.023 | 0.210 | 0.043 | 0.700 | 0.986 |
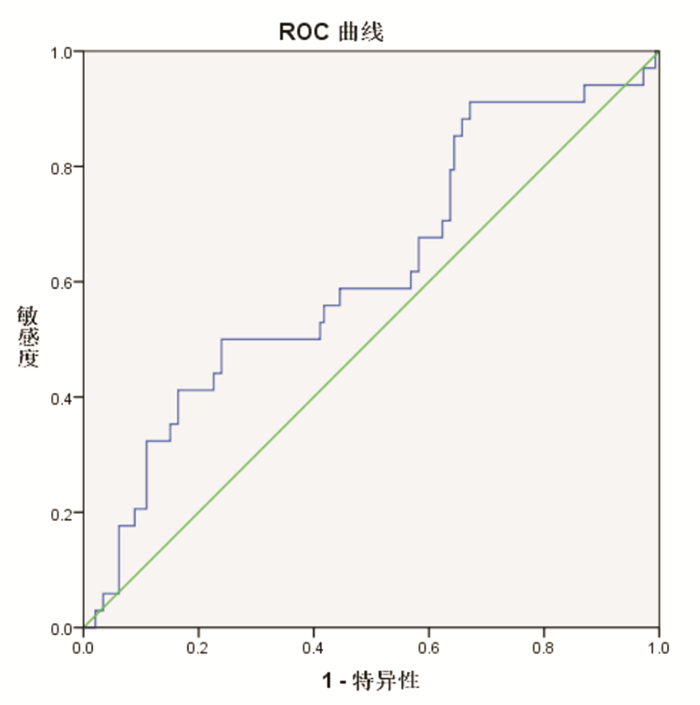
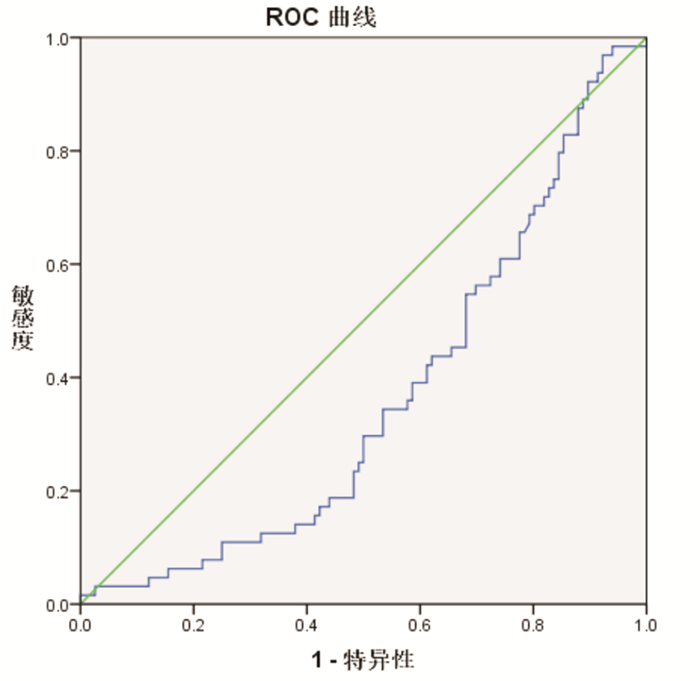
血清AGEs诊断AD的受试者工作特征曲线(receiver operating characteristic curve, ROC curve),曲线下面积(area under curve, AUC)为0.617,P < 0.05,95%CI为0.510~0.725,说明血清AGEs对AD有较低诊断价值,血清AGEs诊断AD的临界值为541.1364,对应的诊断灵敏度为50%,特异度为76%(图 1)。血清AGEs诊断VaD的ROC曲线,AUC为0.364,P < 0.05,95%CI为0.282~0.446,AUC小于0.5,说明血清AGEs对VaD不具有诊断价值(图 2)。
|
| 图 1 AGEs诊断AD的ROC曲线 |
|
| 图 2 AGEs诊断VaD的ROC曲线 |
在正常情况,AGEs修饰蛋白可以作为一种信号参与机体清除衰老组织及结构重建的过程;病理状态下,AGEs可引起组织的细胞结构和功能异常,从而产生一系列病理变化[10]。关于AGEs与AD关系的研究较多,其主要导致发病的机制可能表现在AGEs通过对Aβ和Tau蛋白的修饰,影响细胞代谢;影响神经元的细胞周期;导致线粒体功能障碍;产生氧化应激损伤;影响自噬过程;影响血脑屏障的通透性;引发炎症反应等[11]。关于AGEs与VaD的研究较少,多表现在AGEs通过损伤血管内皮,促进血小板的黏附聚集,促进血栓形成,使一氧化氮的生成和释放减少,导致血管壁水肿、影响血脑屏障的通透性等,即AGEs通过其直接作用及其和受体相互作用促进脑卒中和VaD的发生和发展[12-15]。在本研究中发现,AGEs在AD组和N-VaD组明显高于正常对照组,这与文献报道[6, 16]相符,提示AGEs可能通过上述多种机制促进AD的发生、发展。在本研究中AGEs在AD患者中的ROC曲线显示AUC为0.617,说明血清AGEs对AD有较低诊断价值,血清AGEs诊断AD的临界值为541.1364,对应的诊断灵敏度为50%,特异度为76%。提示AGEs参与了AD的发病过程,可能通过阻断AGEs作用途径而达到治疗AD的目的。在本次研究中,AGEs在VaD组与正常对照组之间无显著性差异,提示AGEs不能作为诊断VaD的实验室标志物。也有研究表明AGEs在VaD组水平明显高于正常对照组[7],因为关于AGEs与VaD关系的研究较少,脑梗死后时间长短和病情严重程度不同均可能会影响AGEs水平,尚需要更多的研究进一步明确AGEs在VaD患者中的水平及可能的作用机制。
晚期糖基化终末产物受体(receptor for advanced glycation end products, RAGE)是AGEs受体,其细胞外域含3个免疫球蛋白样区域:一个V型结构域和紧连的两个C型结构域(C1/C2),V结构域为配体结合区域[17],sRAGE即RAGE细胞外段,为配体结合部位,具有V型片段紧接着两个C型片段的免疫球蛋白样结构[18],是构成RAGE的重要结构。同前所述,研究证实血清sRAGE水平与痴呆明显相关,有研究发现AD组血清sRAGE水平明显低于VaD组和正常对照组[19]。但由于sRAGE广泛参与人体内的炎症反应,其是否可以作为AD和VaD的特异生物标记物仍需进一步研究。在本研究中我们发现,虽然sRAGE水平在AD组低于VaD组,但差异不具有统计学意义,其中VaD组sRAGE水平与N-VaD组和正常对照组比较差异也没有统计学意义,提示sRAGE并不能作为诊断AD及VaD的实验室标志物。Liang等[20]研究表明sRAGE在AD组和VaD组低于正常对照组,在AD组低于VaD组,差异有统计学意义,使用ROC曲线进行绘图分析,发现其对AD具有诊断价值,但sRAGE不能用于区别AD与VaD和其他类型的痴呆。Tang等[21]的研究表明,在脑卒中后不同时间sRAGE波动在不同水平。有研究在关于糖尿病血管并发症的研究中发现,正常对照组sRAGE水平低于伴有轻度血管并发症的糖尿病患者,然而在伴有严重血管并发症的糖尿病患者中,sRAGE水平比正常对照组反而更低,提示sRAGE水平最初可能会减少AGEs的有害影响,但还不足以阻碍其进展,有可能在反应中逐渐耗竭,而AGEs继续累积[22, 23]。本研究结果和Liang等文献报道不符,我们所观察到的sRAGE与AD和VaD的关系可能只代表了真实关系的一部分,这可能与干扰sRAGE水平的因素过多,所纳入研究对象认知障碍的严重程度,样本量小等有关,脑梗死后时间长短可能也会影响其水平。关于sRAGE是否能作为诊断AD与VaD的血清标志物及其在AD和VaD患者中水平的差异仍需多中心、大样本排除干扰因素的研究进一步评估。
综上所述,血清AGEs可能与AD、脑卒中的发生有关;AGEs对AD有较低的诊断价值。但由于样本量少,可能导致结果的偏差,需进行大样本、多中心的研究进一步明确上述指标与AD及VaD的关系及可能的发病机制,为临床早期预防,早期诊断和治疗痴呆症提供依据。
| [1] |
Adams ML, Grandpre J. Dose-response gradients between a composite measure of six risk factors and cognitive decline and cardiovascular disease[J]. Prev Med, 2016, 91: 329-334. DOI:10.1016/j.ypmed.2016.09.004 |
| [2] |
10 facts on dementia. World Health Organisation. https://www.who.int/features/factfiles/dementia, April 2017.
|
| [3] |
Hishikawa N, Fukui Y, Sato K, et al. Characteristic features of cognitive, affective and daily living functions of late-elderly dementia[J]. Geriatr Gerontol Int, 2016, 16(4): 458-465. DOI:10.1111/ggi.2016.16.issue-4 |
| [4] |
Andin U, Gustafson L, Passant U, et al. A Clinico-Pathological Study of Heart and Brain Lesions in Vascular Dementia[J]. Dement Geriatr Cogn Disord, 2005, 19(4): 222-228. DOI:10.1159/000083801 |
| [5] |
Kalaria RN. Comparison between Alzheimer's disease and vascular dementia:Implications for treatment[J]. Neurol Res, 2003, 25(6): 661-664. DOI:10.1179/016164103101201968 |
| [6] |
Ko SY, Ko HA, Chu KH, et al. The Possible Mechanism of Advanced Glycation End Products (AGEs) for Alzheimer's Disease[J]. Plos One, 2015, 10(11): e0143345. DOI:10.1371/journal.pone.0143345 |
| [7] |
闫福岭, 韩国玲, 洪震. 血管性痴呆患者的血清AGEs和Aβ水平研究[J]. 中国神经精神疾病杂志, 2005, 31(6): 464-465. DOI:10.3969/j.issn.1002-0152.2005.06.021 |
| [8] |
Geroldi D, Falcone C, Emanuele E, et al. Decreased plasma levels of soluble receptor for advanced glycation end-products in patients with essential hypertension[J]. J Hypert, 2008, 115(7): 1047-1050. |
| [9] |
Xu XY, Deng CQ, Wang J, et al. Plasma levels of soluble receptor for advanced glycation end products in Alzheimer's disease[J]. Int J Neurosci, 2017, 127(5): 454-458. DOI:10.1080/00207454.2016.1193861 |
| [10] |
Salahuddin P, Rabbani G, Khan RH. The role of advanced glycation end products in various types of neurodegenerative disease:a therapeutic approach[J]. Cell Mol Biol Letters, 2014, 19(3): 407-437. |
| [11] |
马宗艳, 蔡宏斌, 葛朝明. 晚期糖基化终末产物与阿尔茨海默病的关系[J]. 解放军医学杂志, 2018, 43(1): 79-84. |
| [12] |
Hangaishi M, Taguchi J, Miyata T, et al. Increased Aggregation of Human Platelets Produced by Advanced Glycation End Products in Vitro[J]. Biochem Biophys Res Commun, 1998, 248(2): 285-292. DOI:10.1006/bbrc.1998.8945 |
| [13] |
郑智楷, 关瑞锦. 晚期糖基化终末产物致动脉硬化的研究及药物干预[J]. 中外医学研究, 2011, 9(16): 163-164. DOI:10.3969/j.issn.1674-6805.2011.16.124 |
| [14] |
Hoyer S. The brain insulin signal transduction system and sporadic (type Ⅱ) Alzheimer disease:an update[J]. J Neural Transmission, 2002, 109(3): 341-360. DOI:10.1007/s007020200028 |
| [15] |
Hussain M, Bork K, Gnanapragassam VS, et al. Novel insights in the dysfunction of human blood-brain barrier after glycation[J]. Mechan Ageing Dev, 2016, 155: 48-54. DOI:10.1016/j.mad.2016.03.004 |
| [16] |
Kuhla A, Ludwig SC, Kuhla B, et al. Advanced glycation end products are mitogenic signals and trigger cell cycle reentry of neurons in Alzheimer's disease brain[J]. Neurobiol Aging, 2015, 36(2): 753-761. DOI:10.1016/j.neurobiolaging.2014.09.025 |
| [17] |
Sasaki N, Toki S, Chowei H, et al. Immunohistochemical distribution of the receptor for advanced glycation end products in neurons and astrocytes in Alzheimer's disease[J]. Brain Res, 2001, 888(2): 256-262. DOI:10.1016/S0006-8993(00)03075-4 |
| [18] |
Boulanger E, Dequiedt P, Wautier JL. Advanced glycosylation end products (AGE):new toxins?[J]. Néphrologie, 2002, 23(7): 351. |
| [19] |
Southern L, Williams J, Esiri MM. Immunohistochemical study of N-epsilon-carboxymethyl lysine (CML) in human brain:relation to vascular dementia[J]. BMC Neurol, 2007, 7(1): 1-8. DOI:10.1186/1471-2377-7-1 |
| [20] |
Liang F, Jia J, Wang S, et al. Decreased plasma levels of soluble low density lipoprotein receptor-related protein-1(sLRP) and the soluble form of the receptor for advanced glycation end products (sRAGE) in the clinical diagnosis of Alzheimer's disease[J]. J Clin Neurosci, 2013, 20(3): 357-361. DOI:10.1016/j.jocn.2012.06.005 |
| [21] |
Tang SC, Wang YC, Li YI, et al. Functional role of soluble receptor for advanced glycation end products in stroke[J]. Arterioscler Thromb Vasc Biol, 2013, 33(3): 585-594. DOI:10.1161/ATVBAHA.112.300523 |
| [22] |
Aubert CE, Michel PL, Gillery P, et al. Association of peripheral neuropathy with circulating advanced glycation end products, soluble receptor for advanced glycation end products and other risk factors in patients with type 2 diabetes[J]. Diabetes Metab Res Rev, 2014, 30(8): 679-685. DOI:10.1002/dmrr.v30.8 |
| [23] |
El-Mesallamy HO, Hamdy NM, Ezzat OA, et al. Levels of soluble advanced glycation end product-receptors and other soluble serum markers as indicators of diabetic neuropathy in the foot[J]. J Investig Med, 2011, 59(8): 1233-1238. DOI:10.2310/JIM.0b013e318231db64 |
 2019, Vol. 46
2019, Vol. 46




