扩展功能
文章信息
- 刘佳丽, 王晔
- Liu Jia-Li, Wang Ye
- 缺血后处理对脑缺血大鼠学习记忆能力的影响
- Effect of ischemic postconditioning on learning and memory in rats with cerebral ischemia
- 国际神经病学神经外科学杂志, 2019, 46(1): 50-54
- Journal of International Neurology and Neurosurgery, 2019, 46(1): 50-54
-
文章历史
收稿日期: 2018-06-13
修回日期: 2018-11-23
2. 哈尔滨医科大学附属第一医院神经内科, 黑龙江省哈尔滨市 150081
目前中国每年因脑卒中死亡的人数已超过肿瘤和心血管疾病,成为第1位致死原因[1]。尽早的恢复缺血区的血流再灌注是急性缺血性脑卒中治疗的重要措施[2]。超早期介入动脉溶栓治疗是目前急性脑梗死最重要的治疗方法之一。然而,闭塞的动脉溶栓再通后可造成缺血再灌注损伤,严重制约了该项措施的应用[3]。近年来,研究人员发现缺血后处理(ischemic postconditioning, IP)可减轻缺血性脑卒中后的缺血再灌注损伤[4],IP是指在再灌注的早期,给予几次重复短暂的非致命性的血管闭塞与再通的过程,是一种缺血耐受[5]。缺血再灌注损伤是血管性痴呆(VD)重要机制[6]。研究表明,脑卒中之后可出现血管性(缺血性或出血性)认知损伤和痴呆[7]。缺血性脑卒中可上调淀粉样前体蛋白(amyloid precursor protein, APP)的表达,并损害血脑屏障(BBB),影响β-淀粉样蛋白(amyloid β-protein, Aβ)从脑中清除[8]。本研究通过测定大鼠海马CA1区APP含量,探讨IP在大鼠局灶性脑缺血再灌注损伤中的保护作用及其机制。
1 材料和方法 1.1 材料健康雄性SD大鼠48只,体质量250~300 g。SABC免疫组化试剂盒、APP免疫组化试剂盒均为武汉博士得公司产品。水迷宫及配套分析软件。OLYMPUS BX41显微图像分析系统。
1.2 方法 1.2.1 动物分组SD大鼠48只,随机分为3组:假手术组、对照组和缺血后处理组(IP组),每组16只。
1.2.2 模型制作所有实验动物术前24 h禁食,自由饮水。水合氯醛0.35 g/kg,腹腔麻醉,剪去颈正中位皮毛,消毒,铺巾,取颈正中皮肤切口,钝性分离肌肉及皮下组织,暴露颈总动脉(CCA),分离迷走神经,切忌钳夹,钝性分离右侧颈外动脉(ECA)和颈内动脉(ICA),结扎分支,用手术剪剪开ECA一小口,将一预先用酒精灯烧成圆头的320尼龙线置入颈内动脉14~15 mm,直到有轻微阻力感为止。
假手术组:仅暴露颈总动脉及分叉处。对照组:行单纯大脑中动脉缺血,阻闭60 min后抽出尼龙线,恢复再灌注,144 h(6 d)后处死。缺血后处理组(IP组):于大脑中动脉线栓阻闭(middle cerebralartery occlusion, MCAO)60 min后,将尼龙线拔出5~8 mm,再灌注时间30 s,再将尼龙线放入原位置,缺血时间为30 s,反复3次,恢复再灌注,144 h(6 d)后处死。
术后6 d共存活40只MCAO大鼠,其中假手术组16只,对照组12只,IP组14只,以下测定每组均随机选取12只大鼠。
1.2.3 Morris水迷宫测定水迷宫为直径130 cm,高50 cm的圆形水池,水深30 cm,水温保持(23±2)℃,水中加氨黑蓝颗粒。池壁上有4个入水点,水池等分为4个象限,在第Ⅰ象限正中离池壁30 cm处放一个直径为9 cm的圆形平台,平台顶低于水面1 cm。迷宫上方安置摄像机同步记录大鼠运动轨迹。训练期间迷宫外参照物保持不变。实验历时6 d。
定位航行实验:第1天让大鼠自由游泳2 min;从第2天起,每天训练2次,每次训练大鼠时随机分别从4个不同的入水点入水,将大鼠面向池壁放入水中。每次训练间隔15 s。如果大鼠在120 s内找不到平台,记潜伏期为120 s。记录实验第2、3、4、5天大鼠寻找平台的逃避潜伏期。
空间搜索实验:第6天撤除平台,观察并记录60 s内各组大鼠跨越原平台(第Ⅰ象限)次数。
1.2.4 HE染色及免疫组化标本取材与制备模型制作144 h(6 d)后大鼠经10%水合氯醛腹腔麻醉,打开胸腔,先后用生理盐水和4%多聚甲醛行心脏灌流,断头取脑,置于4%多聚甲醛中固定24 h。自视交叉处向后行冠状切片,取中间切块逐级脱水、透明、浸蜡,常规石蜡包埋制作石蜡标本,保存于4℃冰箱中备用。将蜡块通过石蜡切片机进行连续冠状切片,每片厚度为4 μm,并将其贴附于载玻片上,烤干后以备应用于后续的HE染色及免疫组化。
1.2.5 HE染色① 将切片在二甲苯中脱蜡10 min。②移入二甲苯和纯酒精(1 : 1)混合液中5 min。③100%、95%、85%、70%酒精脱水,各级为5 min。经蒸馏水转入染液。④苏木精染色15 min。二甲苯浸泡15 min,重复3次;无水酒精浸泡5 min,重复2次,95%酒精5 min,重复2次;75%酒精5 min,重复2次;至蒸馏水浸泡5 min。⑤水洗玻片上多余染液,0.5%盐酸酒精分色5 min。⑥清水冲洗15 min。⑦0.5%伊红染色5 min。⑧依次经70%、85%、95%、100%酒精脱水,各级为3 min。⑨二甲苯二次浸泡。⑩封片:擦去切片周围多余二甲苯,迅速滴加适量中性树胶,再加盖玻片封固。光学显微镜下观察脑组织病理形态学改变,并在高倍镜下采取盲法对海马CA1区的锥体细胞进行计数,取平均值。
1.2.6 免疫组织化学检测取连续3张鼠脑切片, 按试剂盒说明书的步骤进行APP的免疫组织化学反应。切片经3% H2O2和10%正常兔血清各处理30 min后,分别入羊抗NMDA亚受体APP(武汉博士德生物工程有限公司)多克隆抗体(稀释度1 : 400),室温2 h,4℃ 24 h,再入生物素化兔抗羊抗体(1 : 200),室温1 h,复入ABC复合物(1 : 100),室温2 h,用DAB显色,苏木素复染,盐酸酒精分化。最后常规脱水、透明、封片。显微镜下观察细胞浆呈棕黄色为阳性细胞。OLYMPUS BX41显微图像分析系统测定海马CA1区阳性反应物的光密度值,取平均值作为测量值。
1.3 统计学分析应用SPSS17.0统计软件进行统计学分析,计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 大鼠水迷宫空间学习记忆能力测定 2.1.1 定位航行实验训练第1~4天的假手术组、对照组、IP组之间的平均逃避潜伏期差异有统计学意义(P < 0.05)。对照组大鼠搜寻隐藏平台的逃避潜伏期与假手术组相比,差异有统计学意义(P < 0.01);IP组在训练第4天时搜索平台的逃避潜伏期明显减少,与对照组相比有显著区别(P < 0.05)。见图 1A。
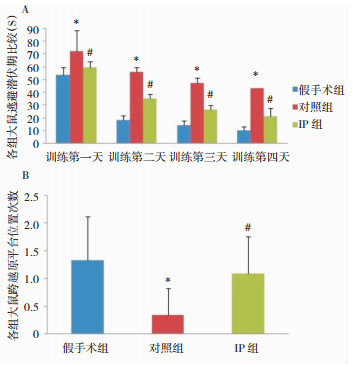
|
| 图 1 各组大鼠水迷宫空间学习记忆能力测定结果 注:A:各组大鼠逃避潜伏期比较;B:各组大鼠跨越原平台次数比较;*为与假手术组相比较,P < 0.01;#为与对照组比较,P < 0.05。 |
撤离平台后,对照组准确穿越原平台所在位置的次数比假手术组明显减少(P < 0.01),IP组准确穿越平台次数较对照组增多,表明IP后大鼠的空间记忆能力有明显的改善(P < 0.05)。见图 1B。
2.2 HE染色假手术组海马CA1区可见神经元呈层状分布,各层细胞数量较多,胞核染色清晰,血管内皮细胞之间紧密相连,形态完整。对照组细胞体积变小,神经元消失,排列紊乱,细胞数量减少,核固缩、深染胞体缩小,其嗜酸性明显增加。IP组神经元略有消失,核固缩,深染细胞较少。与假手术组比较,IP组呈不同程度锥体细胞数减少,差异有统计学意义(P < 0.01);IP组锥体细胞数较对照组明显增加(P < 0.01)。见图 2、表 1。
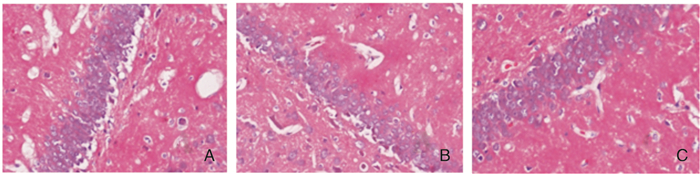
|
| 图 2 各组大鼠海马CA1区HE染色(×400) 注:A:假手术组;B:对照组;C:IP组。 |
| 组别 | 例数(n) | 锥体细胞计数(个/mm2) |
| 假手术组 | 12 | 33.08±2.47 |
| 对照组 | 12 | 49.17±3.66* |
| IP组 | 12 | 41.83±3.38# |
| 注:3组间比较,F=71.632,P < 0.001;*为IP组与对照组比较,P < 0.01;#为假手术组与IP组比较,P < 0.01。 | ||
对照组大鼠海马CA1区APP阳性神经元增多,多数APP阳性神经元分布于锥体细胞层,阳性反应产物主要位于神经元胞质和突起,细胞核为阴性反应。IP组大鼠海马CA1区APP阳性神经元较对照组明显减少。假手术组平均光密度值与IP组比较明显降低,差异有统计学意义(P < 0.01);IP组平均光密度值比对照组降低,差异有统计学意义(P < 0.01)。见图 3、表 2。
| 组别 | 例数(n) | APP光密度值 |
| 假手术组 | 12 | 0.1562±0.0240 |
| 对照组 | 12 | 0.5344±0.0533* |
| IP组 | 12 | 0.2698±0.0252# |
| 注:3组比较,F=475.435,P < 0.001;*为IP组与对照组比较,P < 0.01;#为假手术组与IP组比较,P < 0.01。 | ||
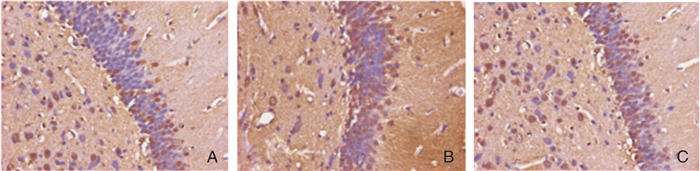
|
| 图 3 各组大鼠海马CA1区APP的表达(×400) 注:A:假手术组;B:对照组;C:IP组。 |
VD是由脑血管损伤引起的以记忆认知功能丧失为特征的痴呆,约占老年痴呆患者的16%[9]。在一项回顾性研究中,缺血性脑卒中后痴呆的发病率在住院患者中估计为20.3%,在排除了卒中前患有痴呆患者之后约为7.4%(4.8%~10%)[10]。有研究证实,大鼠短暂的大脑中动脉梗死会导致长期的认知功能缺陷[11],中老年初次脑梗死会增大痴呆发生的风险[12]。Morris水迷宫[13]是检测实验动物学习记忆能力的重要工具。大鼠在多次训练中会学会用环境标记物寻找固定位置的隐蔽平台,形成稳定的空间位置认知,这种空间认知是依赖于海马的陈述性记忆,临床患有痴呆的病人,正是以陈述性记忆受损为主要首发临床表现[14]。
在本研究中,MCAO后大鼠与假手术组比较,寻找固定位置的隐蔽平台的能力下降,提示大鼠空间参考记忆明显受损,IP组大鼠逃避潜伏期时间明显短于对照组,提示IP可改善缺血再灌注后大鼠的空间学习记忆能力。在空间探索实验中,IP组跨越原平台象限次数多于对照组,提示IP改善了大鼠的记忆保持能力。综上所述,IP可在一定程度上改善脑缺血后大鼠的记忆认知功能,减少VD的发生。
缺血再灌注是脑损伤的重要机制。海马是认知功能相关的重要区域,是空间学习、记忆能力的基础[15]。海马受损可影响大鼠的学习记忆,这和临床VD患者学习记忆能力减退等表现是一致的[16]。本实验用HE染色发现,IP组海马CA1区存活神经元细胞数较对照组明显增加,证实IP可以减轻脑卒中后的脑损伤。APP作为Aβ的前体蛋白,是一种跨膜糖蛋白,正常情况下, APP可在大多数细胞中表达,普遍存在于血液和脑脊液中,脑缺血再灌注后APP表达增加, 引起神经元细胞损伤,损伤又可以加重Aβ的生成,形成瀑布式反应,加重局部脑缺血损伤[17]。以往研究表明,APP具有促神经细胞凋亡的作用,其过度表达可直接导致神经细胞的损害[18]。本研究显示, 缺血各组海马CA1区APP表达较假手术组明显上升。IP组APP表达较对照组减弱,表明其可以抑制APP在海马CA1区的表达,降低梗死灶内淀粉样物质的沉积,抑制神经细胞凋亡,改善MCAO大鼠的缺血后神经功能损伤。
本实验采用大鼠MCAO模型,研究了IP对缺血再灌注后大鼠的脑保护作用。证实了IP可减轻MCAO大鼠的缺血再灌注损伤,同时降低APP的表达,改善脑缺血后大鼠的学习记忆能力。
总之,IP有明确的脑保护作用,可以通过降低大鼠缺血再灌注24 h后APP的表达,改善缺血再灌注损伤后的记忆认知功能减退。
| [1] |
中华医学会神经病学分会, 中华医学会神经病学分会神经血管介入协作组, 急性缺血性脑卒中介入诊疗指南撰写组. 中国急性缺血性脑卒中早期血管内介入诊疗指南[J]. 中华神经科杂志, 2015, 48(5): 356-361. DOI:10.3760/cma.j.issn.1006-7876.2015.05.002 |
| [2] |
中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2018[J]. 中华神经科杂志, 2018, 51(9): 666-682. DOI:10.3760/cma.j.issn.1006-7876.2018.09.004 |
| [3] |
Shi JF, Liu Y, Duan YX, et al. A new idea about reducing reperfusion injury in ischemic stroke:Gradual reperfusion[J]. Med Hypotheses, 2013, 80(2): 134-136. DOI:10.1016/j.mehy.2012.11.010 |
| [4] |
Duanmu WS, Cao L, Chen JY, et al. Ischemic postconditioning protects against ischemic brain injury by up-regulation of acid-sensing ion channel 2a[J]. Neural Regener Res, 2016, 11(4): 641-645. DOI:10.4103/1673-5374.180751 |
| [5] |
Zhao H, Sapolsky RM, Steinberg GK. Interrupting reperfusion as a stroke therapy:ischemic postconditioning reduces infarct size after focal ischemia in rats[J]. Cereb Blood Flow Metab, 2006, 26(9): 1114-1121. DOI:10.1038/sj.jcbfm.9600348 |
| [6] |
Salvadores N, Searcy JL, Holland PR, et al. Chronic cerebral hypoperfusion alters amyloid-β peptide pools leading to cerebral amyloid angiopathy, microinfarcts and haemorrhages in Tg-SwDI mice[J]. Clin Sci, 2017, 131: 2109-2123. DOI:10.1042/CS20170962 |
| [7] |
Gorelick PB, Scuteri A, Black SE, et al. Vascular contributions to cognitive impairment and dementia:a statement for healthcare professionals from the american heart association/American stroke association[J]. Stroke, 2011, 42(9): 2672-2713. DOI:10.1161/STR.0b013e3182299496 |
| [8] |
Debette S. Vascular risk factors and cognitive disorders[J]. Revue Neurol, 2013, 169(10): 757-764. DOI:10.1016/j.neurol.2013.07.022 |
| [9] |
罗燕, 付剑亮. 血管性痴呆的诊断和治疗进展[J]. 国际神经病学神经外科学杂志, 2017, 44(5): 550-554. |
| [10] |
Pendlebury ST, Rothwell PM. Prevalence, incidence, and factors associated with pre-stroke and post-stroke dementia:a systematic review and meta-analysis[J]. Lancet Neurol, 2009, 8(11): 1006-1008. DOI:10.1016/S1474-4422(09)70236-4 |
| [11] |
Li W, Huang R, Shetty RA, et al. Transient focal cerebral ischemia induces long-term cognitive function deficit in an experimental ischemic stroke model[J]. Neurobiol Dis, 2013(59): 18-25. |
| [12] |
张钱林, 孟兰芳, 赵丽娟, 等. 中老年初次脑梗死发作后血管性痴呆的相关影响因素分析[J]. 国际神经病学神经外科学杂志, 2017, 44(5): 492-497. |
| [13] |
Morris RG, Garrud P, Rawlins JN, et al. Place navigation impaired in rats with hippocampal lesions[J]. Nature, 1982, 297(5868): 681-683. DOI:10.1038/297681a0 |
| [14] |
Squire LR, Zola-Morgan S. Memory, brain system and behavior[J]. Trends Neurosci, 1988, 11(4): 170-175. DOI:10.1016/0166-2236(88)90144-0 |
| [15] |
Jeong HJ, Yoo DY, Kim DW, et al. Neuroprotective effect of PEP-1-peroxiredoxin2 on CA1 regions in the hippocampus against ischemic insult[J]. Biochim Biophys Acta, 2014, 1840(7): 2321-2330. DOI:10.1016/j.bbagen.2014.03.003 |
| [16] |
Leuner B, Gould E. Structural plasticity and hippocampal function[J]. Annu Rev Psychol, 2010, 61: 111-140. DOI:10.1146/annurev.psych.093008.100359 |
| [17] |
Karim A, Alkadhi, An T, et al. Exercise decreases BACE and APP levels in the hippocampus of a rat model of Alzheimer's disease[J]. Mol Cell Neurosci, 2018, 86: 25-29. DOI:10.1016/j.mcn.2017.11.008 |
| [18] |
Kienlen-Cam Pard PK, Tasiaux B, Octave JN. The processing and biological function of the human amylold precursor protein:lessons from different cellular models[J]. Exp Gerontol, 2000, 35(6-7): 843-850. DOI:10.1016/S0531-5565(00)00170-4 |
 2019, Vol. 46
2019, Vol. 46




