扩展功能
文章信息
- 曹慧, 黄卫, 杨栋, 傅锦华, 彭红莉, 魏宏萍, 刘丽妮, 熊中杰, 董轩萁
- CAO Hui, HUANG Wei, YANG Dong, FU Jin-Hua, PENG Hong-Li, WEI Hong-Ping, LIU Li-Ni, XIONG Zhong-Jie, DONG Xuan-Qi
- 帕金森病和抑郁症转录组生物信息学分析
- A bioinformatic analysis of the transcriptomes of Parkinson's disease and major depressive disorder
- 国际神经病学神经外科学杂志, 2019, 46(1): 40-44
- Journal of International Neurology and Neurosurgery, 2019, 46(1): 40-44
-
文章历史
收稿日期: 2018-09-19
修回日期: 2019-01-03
2. 中南大学湘雅医院, 湖南省长沙市 410008;
3. 益阳市第四人民医院, 湖南省益阳市 413000
帕金森病(Parkinson disease, PD)是一种慢性神经系统退行性疾病。抑郁症(Major depressive disorder, MDD)是一类情绪低落、快感缺失、意志活动减退等为主要症状的情绪障碍。PD的临床症状主要表现在运动症状和非运动症状,运动症状如震颤、运动迟缓、肌强直等;非运动症状主要包括抑郁、便秘、睡眠障碍、自主神经功能异常以及认知障碍等。研究显示超过90%的PD患者都会表现出非运动症状。这些症状可以早于运动症状多年出现[1],对于诊断前驱期PD更有意义。抑郁是PD患者最常出现的一种非运动性神经精神症状[2],PD患者抑郁发病率达40%[3],但临床识别率低,临床治疗率不足35%[4]。
有研究发现,PD患者除了多巴胺(DA)大量降解这一典型特征外,中脑黑质GABA受体也逐渐减少,而抑郁症患者额叶、枕叶皮质区GABA浓度与健康人相比也明显减少[5],试推测PD和MDD可能有共同致病机制。Tong等[6]对82名PD患者和64名非PD患者研究发现,PD患者的血浆5-TH及其代谢产物5-羟基吲哚乙酸(5-HIAA)较非PD患者明显下降,且降低程度与抑郁程度显著相关,认为5-HT和5-HIAA的血浆水平可以作为PD伴MDD的外周标志物,但其具体机制仍不明确。随着大数据及芯片测序技术的发展,通过文本挖掘及转录组数据探索疾病之间的相关机制是有效手段,其中基因富集聚类主要通过GO和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路分析。GO(gene ontology)数据库的产生是为了使对各种数据库中基因产物功能描述相一致,也就是将所有的蛋白功能进行分类。整体来说GO分为3个不同的类别,分别是分子功能(molecular function, MF)、生物学途径(biological process, BP)和细胞组份(cellular component, CC)。KEGG的PATHWAY数据库是一个分子互动网络,可以对蛋白质交互网络在各种细胞活动起的作用作出预测。本研究拟通过文本挖掘及转录组数据探讨PD与MDD可能的共同致病机制。
1 材料和方法 1.1 文本挖掘本项研究采用COREMINE[7](http://www.coremine.com/medical/)信息检索平台,用于检索PD和MDD相关的文献、基因、化学药品、BP、CC、MF和KEGG pathway。
1.2 数据和数据预处理通过在线数据库GEO(https://www.ncbi.nlm.nih.gov/gds/)选取帕金森转录组数据GSE68719(GPL11154),其为29例帕金森患者和44例正常对照组脑组织样本测序数据;MDD转录组数据GSE44593(GPL570),其为14例MDD患者和14例正常对照组脑组织样本芯片数据,并对数据进行了标准化处理。
1.3 差异表达分析本研究使用R语言limma包分析和筛选两种疾病的差异表达基因(DEGs),由于这两种疾病不属于同一类型的疾病,因此差异表达基因的筛选标准使用不同的阈值。PD差异表达基因筛选标准为P值小于0.01,且logFC大于1,MDD差异表达基因筛选标准为P值小于0.05。
1.4 功能富集分析通过R语言中的clusterprofiler包对显著差异表达的基因进行功能富集分析,并选择基因数大于或等于2且P值小于0.05作为富集数据。同时,KEGG pathway分析选择P值小于0.05作为进入富集生物途径的标准。
1.5 蛋白-蛋白相关网络在该研究中,STRING(在线获取:http://string-db.org/)数据库用于构建由差异表达基因的蛋白间相互作用网络(Protein-Protein Interaction, PPI)。将从在线STRING数据库获得的蛋白质相互作用数据导入Cytoscape软件,使用其cytohubba插件工具获得Degree大于2且Betweeness大于100的节点,该节点作为网络中心节点(Hub),由中心节点代表的蛋白质通常是具有重要生理功能的关键蛋白质(Hub基因)[8]。然后,使用Cytoscape中的MCODE插件工具进一步聚类分析,以找到蛋白质相互作用网络中的核心基因模块,并挖掘与疾病显著相关的生物学功能或通路。
2 结果 2.1 通过文本挖掘共同基因通过COREMINE平台文本挖掘工具,PD与4157基因相关,MDD与2089基因相关,PD基因中的32%和MDD基因中的63.8%为共同基因,共为1332个基因(表 1)。此外,两者共有相同的98个CC,438个BP,以及82个MF。因此,我们推测PD和MDD可能有共同的基因改变和生物学途径。
| 疾病 | 相关文章 | 基因/蛋白 | 化学药物 | CC | BP | MF |
| PD | 87011 | 4157 | 9190 | 289 | 1049 | 285 |
| MDD | 46210 | 2089 | 3900 | 115 | 538 | 117 |
| PD ∩MDD | 475 | 1332 | 3049 | 98 | 438 | 82 |
通过limma包,PD共得到616个差异基因,其中上调基因365个,下调基因251个;MDD共得到560个差异基因,其中上调基因253个,下调基因307个。对DEGs的简单统计分析表明,共有10个基因不仅与MDD显著相关,而且与PD密切相关。其中MYO1F和LILRA2为表达上调基因,其余ADCYAP1、MYLK2、CLSTN2、CAMK4、PCSK1、TRPC5、SLC5A1、TYPR1为表达下调基因。通过文献挖掘发现统计数据,在616 PD DEGs中,有185个基因与PD有关;在560个MDD DEGs中,有71个基因与MDD有关;PD和MDD的DEGs共同表达的10个基因中,据报道有5个基因与PD有关,有3个基因与MDD有关,并且ADCYAP1和PCSK1这2个基因与PD和MDD均相关。以上表明我们已筛选出可靠的差异表达基因,我们可以进行功能分析的下一步。
2.3 DEGs的功能富集PD中的DEGs显著富集765个条目,涉及623个BP,32个CC,82个MF和28条KEGG通路。MDD中的DEGs显著富集254个条目(计数≥2且P值< 0.05),包括144个BP,25个CC,54个MF和31条KEGG通路。结果表明PD和MDD在GO中具有共同的14个BP,10个MF,6个CC,并且有3条共同的KEGG信号通路。图 1显示了在这两种疾病中的功能富集结果及其比例。总结了765个PD基因富集结果和254个MDD基因富集结果,PD和MDD有33个共同数据。即使这两种疾病DEGs中只有10个共同基因,几乎完全不同的差异表达基因情况,但在基因富集数据中也存在极高的相关性,表明PD也可能与MDD的潜在发病机制有一定关联。

|
| 图 1 PD和MDD差异基因功能富集韦恩图 注:图(A-D)表示两种疾病的功能富集结果的相似性和差异。蓝色代表PD功能富集结果,红色代表MDD功能富集结果,中间重叠部分代表共同富集结果。BP:生物学过程,MF:分子功能,CC:细胞组成,KEGG:信号通路。 |
在本研究中,我们使用STRING在线工具构建了PD的377个蛋白和1373个相互作用的蛋白-蛋白网络(PPI),以及构建了MDD的323个蛋白和593个相互作用的PPI(图 2)。使用cytohubba插件在PD的PPI中得到182个HUB基因,MDD的PPI中得到129个HUB基因。其中,有4个基因:MYO1F、CAMK4、PCSK1、TRPC5在PD和MDD同为关键基因。

|
| 图 2 MDD和PD的蛋白质-蛋白质相互作用网络 注:A:MDD的蛋白质-蛋白质相互作用(PPI);B:PD的蛋白质-蛋白质相互作用网络 |
PD的PPI聚成13个模块,MDD的PPI经过MCODE聚类聚成9个模块,其中两者的模块1系数比较高,可能与相应疾病关联性较强(图 3)。分别对两者的模块1进行聚类分析发现有一条共同的生物学途径:运动行为。
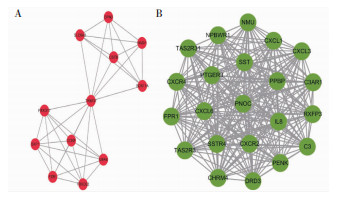
|
| 图 3 核心模块的PPI 注:A:MDD的核心模块PPI;B:PD的核心模块PPI。 |
据最新的一项Meta分析[9]全面回顾了11项相关研究,包括5项队列研究和6项病例对照研究,最终得出帕金森病与抑郁症的风险显著相关,相关系数为2.2。以往的观念认为帕金森病患者出现抑郁症状是由于患者运动障碍、生活自理能力下降而产生的心理性反应,而新近的研究发现抑郁症并不是继发于帕金森病运动障碍,而是中枢神经系统损害的原发表现,其与神经生化的改变有关[10]。
本研究实验结果显示,PD和MDD有10个共同的表达基因:Ⅰ类肌球蛋白(MYO1F)、活化免疫球蛋白样受体(LILRA2)、垂体腺苷酸环化酶激活多肽(ADCYAP1)、骨骼肌肌球蛋白轻链激酶(MYLK2)、钙结合蛋白2(CLSTN2)、钙调蛋白依赖性蛋白激酶4(CAMK4)、前蛋白转化酶枯草杆菌蛋白酶1(PCSK1)、瞬时受体电位阳离子通道5(TRPC5)、纳离子葡萄糖联合转运子(SLC5A1)、酪氨酸酶相关蛋白1(TYPR1)。CLSTN2是属于钙粘蛋白超家族的突触蛋白,在学习和记忆中起着重要作用,是与情景记忆表现和海马体积相关的候选基因。最新研究报道CLSTN2基因敲除小鼠(Clstn2-KO)缺乏GABA能中间神经元,伴有活动过度和空间记忆不足,且在Clstn2-KO雄性小鼠较雌性小鼠表现出更明显的抑郁焦虑情绪[11]。另有研究发现在小鼠中靶向缺失CLSTN2导致功能性抑制性突触的减少,抑制性传递的减少与海马和皮质中的微清蛋白中间神经元的减少有关[12],可能与帕金森病的认知功能相关。TRPC5参与氧化应激,导致细胞内锌离子和钙离子水平增加,离子通道的改变引起神经元线粒体功能的下降,可能在帕金森病的病因机制中起重要作用[13]。且TRPC5是在皮质和杏仁核区域中高度表达的非选择性阳离子通道,这些区域被认为在调节焦虑抑郁中是非常重要的。有研究表明抑制TRPC5可能具有抗焦虑作用[14]。另有研究提示,TRPC5的表达与抑郁大鼠模型的认知变化之间存在相关性,其机制可能是TRPC5的不同表达可引起海马神经元的形态学改变,影响其空间认知能力和突触可塑性[15]。LILRA2、ADCYAP1、CAMK4参与炎症过程[16-18],PCSK1、SLC5A1与代谢有关[19, 20],炎症和代谢异常已被证实在帕金森病和抑郁症的病理机制中起重要作用[21]。
本研究实验结果显示,PD和MDD有共同的生物学过程,氨基酸转运、细胞钙离子内稳态、脂质定位、调节脂质储存、细胞对营养的反应等。据文献报道这些通路在PD、MDD的发病机制发挥着重要的作用[22-24]。从蛋白质相互作用的角度来看,PD和MDD的关键聚类模块中发现一条共同的生物学通路,即运动行为。帕金森病为运动障碍疾病,主要运动症状表现为静止性震颤、运动迟缓、肌强直和姿势步态异常等。静止性震颤在兴奋、焦虑抑郁时表现明显,表明帕金森病和情绪本身有关联;运动迟缓可表现为多种动作的缓慢,随意运动减少,亦可表现为面部无表情、不眨眼、双眼凝视,被称为“面具脸”,这与抑郁症中患者表现为意志活动减退,行为缓慢,活动减少,愁眉苦脸,面无表情具有极其相似之处。本研究从基因的蛋白质相互作用角度,证实这两种疾病的临床表现有着共同的生物学途径,且与临床表现的高度相似性相符合。有研究证实,5-TH2A拮抗剂与5-HT1A/1B激动剂联合使用明显减轻了帕金森病大鼠和灵长类动物中的运动障碍[25, 26]。另有研究报道,单用5-HT1A受体部分激动剂丁螺环酮在PD患者中显示出改善运动功能的作用[27]。众所周知,抗抑郁焦虑药物主要为增强5-TH在突触内的浓度和激活功能,如5-TH1A受体部分激动剂丁螺环酮,起到改善患者的抑郁症状的作用,包括意志活动减退,行动缓慢等症状,证实PD和MDD的运动症状可能有着共同的生物学通路。
| [1] |
王芳, 刘彬, 邢冬梅, 等. 囊泡单胺转运蛋白2基因多态性与帕金森病患者抑郁状态相关性的研究[J]. 国际神经病学神经外科学杂志, 2018, 45(4): 331-335. |
| [2] |
郭配, 张晓韬, 李秀华. 帕金森病睡眠障碍的研究进展[J]. 国际神经病学神经外科学杂志, 2017, 44(3): 332-335. |
| [3] |
Gerber CS. Understanding and managing coma stimulation:are we doing everything we can?[J]. Crit Care Nurs Q, 2005, 28(2): 94-108. DOI:10.1097/00002727-200504000-00002 |
| [4] |
Shulman LM, Taback RL, Rabinstein AA, et al. Non-recognition of depression and other non-motor symptoms in Parkinson's disease[J]. Parkinsonism Relat Disord, 2002, 8(3): 193-197. DOI:10.1016/S1353-8020(01)00015-3 |
| [5] |
Hasler G, van der Veen JW, Tumonis T, et al. Reduced prefrontal glutamate/glutamine and gamma-aminobutyric acid levels in major depression determined using proton magnetic resonance spectroscopy[J]. Arch Gen Psychiatry, 2007, 64(2): 193-200. DOI:10.1001/archpsyc.64.2.193 |
| [6] |
Tong Q, Zhang L, Yuan Y, et al. Reduced plasma serotonin and 5-hydroxyindoleacetic acid levels in Parkinson's disease are associated with nonmotor symptoms[J]. Parkinsonism Relat Disord, 2015, 21(8): 882-887. DOI:10.1016/j.parkreldis.2015.05.016 |
| [7] |
Wu WJ, Wang Q, Zhang W, et al. Identification and prognostic value of differentially expressed proteins of patients with platinum resistance epithelial ovarian cancer in serum[J]. Zhonghua Fu Chan Ke Za Zhi, 2016, 51(7): 515-523. |
| [8] |
Jeong H, Mason SP, Barabasi AL, et al. Lethality and centrality in protein networks[J]. Nature, 2001, 411(6833): 41-42. DOI:10.1038/35075138 |
| [9] |
Wang S, Mao S, Xiang D, et al. Association between depression and the subsequent risk of Parkinson's disease:A meta-analysis[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2018, 86(1): 86-92. |
| [10] |
Costa FH, Rosso AL, Maultasch H, et al. Depression in Parkinson's disease:diagnosis and treatment[J]. Arquivos De Neuro-psiquiatria, 2012, 70(8): 617-620. DOI:10.1590/S0004-282X2012000800011 |
| [11] |
Boraxbekk CJ, Ames D, Kochan NA, et al. Investigating the influence of KIBRA and CLSTN2 genetic polymorphisms on cross-sectional and longitudinal measures of memory performance and hippocampal volume in older individuals[J]. Neuropsychologia, 2015, 78: 10-17. DOI:10.1016/j.neuropsychologia.2015.09.031 |
| [12] |
Lipina TV, Prasad T, Yokomaku D, et al. Cognitive Deficits in Calsyntenin-2-deficient Mice Associated with Reduced GABAergic Transmission[J]. Neuropsychopharmacology, 2016, 41(3): 802-810. DOI:10.1038/npp.2015.206 |
| [13] |
Naziroglu M. Molecular role of catalase on oxidative stress-induced Ca(2+) signaling and TRP cation channel activation in nervous system[J]. J Recept Signal Transduct Res, 2012, 32(3): 134-141. DOI:10.3109/10799893.2012.672994 |
| [14] |
Just S, Chenard BL, Ceci A, et al. Treatment with HC-070, a potent inhibitor of TRPC4 and TRPC5, leads to anxiolytic and antidepressant effects in mice[J]. PLoS One, 2018, 13(1): e0191225. DOI:10.1371/journal.pone.0191225 |
| [15] |
Qin X, Liu Y, Zhu M, et al. The possible relationship between expressions of TRPC3/5 channels and cognitive changes in rat model of chronic unpredictable stress[J]. Behavioural brain research, 2015, 290(1): 80-86. |
| [16] |
Hirayasu K, Saito F, Suenaga T, et al. Microbially cleaved immunoglobulins are sensed by the innate immune receptor LILRA2[J]. Nat Microbiol, 2016, 1(6): 16054. DOI:10.1038/nmicrobiol.2016.54 |
| [17] |
Abad C, Tan YV. Immunomodulatory Roles of PACAP and VIP:Lessons from Knockout Mice[J]. J Mol Neurosci, 2018, 66(1): 102-103. |
| [18] |
Koga T, Kawakami A. The role of CaMK4 in immune responses[J]. Mod Rheumatol, 2018, 28(2): 211-214. DOI:10.1080/14397595.2017.1413964 |
| [19] |
Ramos-Molina B, Molina-Vega M, Fernandez-Garcia JC, et al. Hyperphagia and Obesity in Prader(-)Willi Syndrome:PCSK1 Deficiency and Beyond?[J]. Genes (Basel), 2018, 9(6): E288. DOI:10.3390/genes9060288 |
| [20] |
Vallaeys L, van Biervliet S, de Bruyn G, et al. Congenital glucose-galactose malabsorption:a novel deletion within the SLC5A1 gene[J]. Eur J Pediatr, 2013, 172(3): 409-411. DOI:10.1007/s00431-012-1802-9 |
| [21] |
Rihmer Z, Gonda X, Dome P. Depression in Parkinson's disease[J]. Ideggyogy Sz, 2014, 67(7-8): 229-236. |
| [22] |
Sampson TR, Debelius JW, Thron T, et al. Gut Microbiota Regulate Motor Deficits and Neuroinflammation in a Model of Parkinson's Disease[J]. Cell, 2016, 167(6): 1469-1480. DOI:10.1016/j.cell.2016.11.018 |
| [23] |
Reus GZ, Titus SE, Abelaira HM, et al. Neurochemical correlation between major depressive disorder and neurodegenerative diseases[J]. Life Sci, 2016, 158(1): 21-29. |
| [24] |
Politis M, Wu K, Loane C, et al. Depressive symptoms in PD correlate with higher 5-HTT binding in raphe and limbic structures[J]. Neurology, 2010, 75(21): 1920-1927. DOI:10.1212/WNL.0b013e3181feb2ab |
| [25] |
Ko WK, Li Q, Cheng LY, et al. A preclinical study on the combined effects of repeated eltoprazine and preladenant treatment for alleviating L-DOPA-induced dyskinesia in Parkinson's disease[J]. Eur J Pharmacol, 2017, 813: 10-16. DOI:10.1016/j.ejphar.2017.07.030 |
| [26] |
Pinna A, Ko WK, Costa G, et al. Antidyskinetic effect of A2A and 5HT1A/1B receptor ligands in two animal models of Parkinson's disease[J]. Mov Disord, 2016, 31(4): 501-511. DOI:10.1002/mds.26475 |
| [27] |
Politis M, Wu K, Loane C, et al. Serotonergic mechanisms responsible for levodopa-induced dyskinesias in Parkinson's disease patients[J]. J Clin Invest, 2014, 124(3): 1340-1349. DOI:10.1172/JCI71640 |
 2019, Vol. 46
2019, Vol. 46




