扩展功能
文章信息
- 张晓峰, 张明文, 于志虎, 朱林, 周雁玲
- ZHANG Xiao-Feng, ZHANG Ming-Wen, YU Zhi-Hu, ZHU Lin, ZHOU Yan-Ling
- 弥散张量成像在颅脑损伤昏迷病人中的应用
- TApplication of diffusion tensor imaging in patients with coma after traumatic brain injury
- 国际神经病学神经外科学杂志, 2019, 46(1): 31-34
- Journal of International Neurology and Neurosurgery, 2019, 46(1): 31-34
-
文章历史
收稿日期: 2018-09-20
修回日期: 2018-12-17
意识障碍是上行网状激活系统(Ascending reticular activating system ARAS)损伤后的临床症状,昏迷病人ARAS损伤的程度和部位对颅脑损伤病人的预后有直接影响。弥散张量成像(Diffusion tensor image DTI)基础上的纤维示踪成像可以三维模拟重建人脑上行网状激动系统。尽管目前DTI技术已经应用于颅脑损伤病人的研究,关于ARAS损伤程度对患者意识状态恢复的影响研究仍较少。我们应用DTI和弥散张量纤维束成像(diffusion tensor tractography DTT)技术对最近3年颅脑损伤后昏迷病人的预后相关性进行分析、报道。
1 对象和方法 1.1 研究对象选取2016年6月~2018年3月我科收治的颅脑损伤后昏迷时间大于3周的13例病人为研究对象,其中男性患者11例,女性2例,年龄45±7岁。其中交通事故伤9例,高处坠落伤2例,打击伤2例。入院时GCS评分3~5分4例,GCS评分6~8分9例,其中行开颅手术病例11例。
排除标准:既往有严重肝肾功能障碍;合并重要脏器功能损伤,伤后发生低氧血症,颅内感染,脑积水等影响患者意识水平的并发症。
1.2 研究方法颅脑损伤昏迷病人伤后3周和5周行磁共振弥散加权成像和DTI检查,所用机器为GE公司Signa Excite 1 1.5T磁共振机,ADW 4.7工作站。记录患者伤后3周、5周时病变侧ARAS的FA、MD、TV;分别记录患者3周、3月时GCS评分和3月时GOS评分。
磁共振DTI检查:6通道头颅线圈1.5T GE磁共振机,单回波平面成像用来获取DTI资料。每个32非共线,弥散敏感梯度,以前后联合连线(AC-PC线)为基准,获取平行于前后联合平面70个连续切片。TR=7.5 ms,TE=3.5 ms,矩阵matrix=240×240,激励次数NSA=1,FOV=24 cm×24 cm,获取T1W1 3D/FFE解剖图像所有图像,经由2名放射科主治医生阅读,图像没有运动伪影、机器伪影,均符合图像后处理的要求。
DTI图像采集:采用单次激发双自旋回波EPI序列:重复时间repetition time (TR)=10, 398 ms;回波时间(TE)=72 ms;采集矩阵=96×96;矩阵重构=192×192;扫描视野=240×240 mm2;并行影像缩减因子=2;回波平面成像因子=59;b=1000 s/mm2;激发数=1;切片厚度2.3 mm。获得像素大小1.25×1.25×2.5 mm3。
感兴趣白质纤维束重建:用牛津脑功能磁共振成像中心软件(Version 5.0,FSL;)行弥散加权成像资料分析。用仿射多刻度二位注册纠正涡电流所致的头运动效应和影像扭曲。纤维示踪采用多纤维模式的概率法。采用两个感兴趣区(ROI)神经纤维束追踪重建ARAS,种子兴趣区:桥脑被盖区ARAS选取在三叉神经平面。目标兴奋区:选取在丘脑板内核。从种子像素产生5000样本,通过每个像素的两条流线的阈值处可视化分析。用MATLABTM (Matlab R2007b The Mathworks, Natick, MA, USA), 测量部分各向异性(fractional anisotropy FA),平均弥散率(mean diffusivity,MD),ARAS纤维束量(trace volume volume, TV)。其中感兴趣区经由2名放射科主治医生手动绘制,确保感兴趣区的准确性。重建后记录白质束的FA、M值及TV等相关参数。
1.3 统计分析采用SPSS 17软件包对数据进行分析,病变侧ARAS的FA、MD、TV与GCS评分和GOS评分的相关性采用spearman相关分析,P < 0.05为有统计学意义。
2 结果DTI显示所有病例,ARAS从桥脑三叉神经水平的网状结构,上行通过中脑导水管周围灰质前外侧、红核至前后联合水平的丘脑板内核。
3周时FA值和MD值与3周时GCS评分和3月时GCS评分、GOS评分无相关性。3周时TV值和3周时GCS评分相关,相关系数为0.86,P < 0.001;3周时TV和3月时GCS评分和GOS评分均相关,相关系数均为0.89,P < 0.001。5周时FA值、TV值与3月时GCS评分和GOS评分呈正相关(图 1),P < 0.001;5周时MD值与3月时GCS评分和GOS评分呈负相关,P < 0.05。设定DTI各指标值的变异为v,v=(5月时指标值-3月时指标值)/3月时指标值,FA变异(FAv)和3月时GCS评分和GOS评分呈正相关(P < 0.005,P < 0.05),TV变异(TVv)和3月时GCS评分和GOS评分呈正相关,P < 0.001;MD变异(MDv)和3月时GCS评分和GOS评分呈负相关,P < 0.05。结果见表 1。
| GCS 3w | GCS 3m | GOS 3m | ||||
| ρ | P | ρ | P | ρ | P | |
| FA 3w | -0.482 | 0.096 | -0.439 | 0.133 | -0.420 | 0.153 |
| MD 3w | 0.143 | 0.642 | 0.107 | 0.729 | 0.112 | 0.715 |
| TV 3w | 0.856 | 0.000 | 0.888 | 0.000 | 0.884 | 0.000 |
| FA 5w | 0.881 | 0.000 | 0.876 | 0.000 | ||
| MD 5w | -0.628 | 0.021 | -0.642 | 0.018 | ||
| TV 5w | 0.95 | 0.000 | 0.935 | 0.000 | ||
| FA v | 0.73 | 0.005 | 0.665 | 0.013 | ||
| MD v | -0.652 | 0.016 | -0.691 | 0.009 | ||
| TV v | 0.947 | 0.000 | 0.955 | 0.000 | ||
| 注:ρ=spearman相关系数;P=P值;v=变异;MD=mean diffusivity平均弥散率, FA=fractional anisotropy部分各向异性, TV=tract volume纤维束量 | ||||||
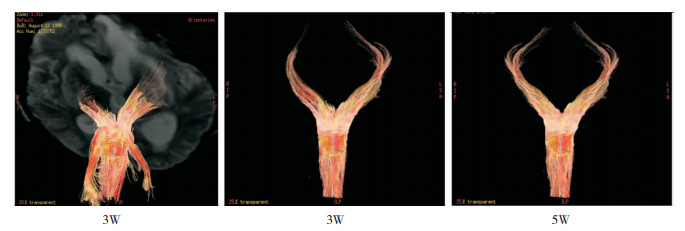
|
| 图 1 ARAS动态变化过程 颅脑损伤病人,入院时为右侧硬膜外血肿,左侧额颞叶挫伤,右侧瞳孔散大,行右侧开颅清除硬膜外血肿,术后复查CT左侧挫伤灶范围扩大,二次行左侧开颅。术后3周时DTI显示右侧ARAS纤维束稀疏。5周后纤维束量增加。患者由GCS评分8分转为15分。 |
ARAS包括脑干网状结构神经核团,下丘脑,额叶眶面,丘脑和丘脑皮层投射纤维。由三部分组成:低位腹侧部分、低位背侧部分,高位部分。丘脑不仅仅是中继核,并且在整合和调节脑干唤醒网络和皮层唤醒网络之间相互作用,Edlow等(2012)用高角度分辨率弥散加权成像研究人类ARAS神经解剖连接,发现递质特异性ARAS及丘脑核团和调节唤醒有关[1]。我们应用DTI和纤维示踪技术重建ARAS的低位背侧部分,选取两个兴趣区来重建低位ARAS:种子兴趣区选取三叉神经入脑干区桥脑网状结构[2],目标兴趣区选取前后联合水平丘脑板内核[3]。虽然我们没有纳入全部ARAS成分,但是已经包括了ARAS的主要部分。
FA值反映白质纤维显微结构(轴突、微管)方向性和完整性,受细胞内水肿和细胞外水肿影响。由于受伤机制的不同,病变区域FA可以上升和下降,细胞内水肿时,水易于沿着轴索弥散,FA值增高,细胞外水肿时,弥散更多表现为各向异性,FA下降。因此早期阶段FA预测预后困难,这和Roberts研究结果相同[4]。本研究同时发现,3周FA和3周时GCS评分无明显相关性,也不是损伤严重程度的影像标志。过去有临床应用研究将DTI用于意识障碍病人低位ARAS的研究[5, 6],发现颅脑损伤亚急性期FA值可以预测预后。他们测量幕上和幕下区域FA值,包括桥脑前后部,中脑,结果提示幕上和幕下FA值下降,除了桥脑后部,可以预测1年后的不良结果。我们认为3周和5周时,脑水肿尚未完全消退,FA对预测结果仍有局限性,本研究结果也显示亚急性期FA尚不能预测预后,和Sidaros的结果存在差异[7],但和Edlow结果相同[8]。虽然亚急性期FA尚不能预测预后,但FA的动态变化和功能改进相关,FA和轴索完整性相关,不完全损伤的轴索经历再生和凋亡两种不同的结果,同一部位病变伴有可逆和不可逆轴索损伤的混合,若轴索完整性恢复,FA则相应增加,因此病变FA增加是轴索结构恢复的潜在影像生物标志,外伤后FA动态变化可以帮助预测预后,和Sidaros和Edlow的结果一致[7, 8]。
急性期由于脑水肿类型的不同,MD可以升高和降低,细胞内水肿时细胞外水移动空间减少,MD下降;细胞外水肿明显的情况下,MD升高;随着水肿的下降,MD逐渐表现为相反的变化;但细胞内水肿经常导致慢性期轴索华勒氏变性、细胞凋亡,此时水分子有多余的空间弥散,弥散增加,MD增加,或者轴索出芽导致MD下降[9]。因此急性期MD多变,对预后无预测价值,亚急性和慢性期MD变化趋势稳定,可以预测患者预后。我们的结果显示3周时MD不能提示预后,5周时MD和预后相关,但相关性相对较小。其动态的变化,和预后相关,但相关性仍较小。不同损伤机制,神经束重建的时间和程度不同,同时伴有神经功能不同程度的恢复[10-14]。神经损伤的机制不同,神经功能恢复的快慢亦可不同。3周时TV和预后相关,5周时TV较3周时和预后相关系数更大,TV的动态变化也能很好的提示预后。
我们的结果显示5周时DTI各指标较3周时更好的提示患者3月时的意识恢复,三项指标中,TV能更好的提示3月时的预后。TV的动态变化可以模拟纤维束的变化,可以直观地反映纤维量的恢复程度。ARAS低位腹侧部分起自桥脑网状结构终于下丘脑;低位背侧部分起自桥脑网状结构,终于丘脑板内核和网状核;高位部分是由丘脑向皮层的投射部分。这三部分中的任一部分的损伤均可以导致患者出现不同程度的意识障碍,因此单纯低位ARAS纤维束变化不能充分反映患者的预后情况,应构建ARAS的全貌,以提示患者意识水平恢复能力。人类大脑有较强的功能可塑性,损伤的ARAS功能,部分可以由正常解剖结构部分替代。本研究显示即使神经功能恢复至正常,参考既往文献所给出的正常对照[15],DTI各指标值仍没有完全恢复正常,并且DTI所示结构连接不能反映突触连接[1],低位ARAS纤维束DTI指标不能精确判断神经功能预后,但可为颅脑损伤昏迷病人预后判断提供依据。
由于本研究病例数有限,所得结果仍需要大样本病例研究进行验证。
| [1] |
Edlow BL, Takahashi E, Wu O, et al. Neuroanatomic connectivity of the human ascending arousal system critical to consciousness and its disorders[J]. J Neuropathol Exp Neurol, 2012, 71(6): 531-546. DOI:10.1097/NEN.0b013e3182588293 |
| [2] |
Afifi AK, and Bergman RA. Functional neuroanatomy:Text and Atlas. New York: Lange Medical. Books/McGraw-Hill, 2005: 179-188.
|
| [3] |
Morel A. Stereotactic atlas of the human thalamus and basal ganglia. New York: Informa Healthcare, 2007: 86-97.
|
| [4] |
Roberts RM, Mathias JL, Rose SE. Relationship between diffusion tensor imaging (DTI) findings and cognition following pediatric tbi:a meta-analytic review[J]. Dev Neuropsychol, 2016, 41(3): 176-200. |
| [5] |
Newcombe VF, Williams GB, Scoffings D, et al. Aetiological differences in neuroanatomy of the vegetative state:insights from diffusion tensor imaging and functional implications[J]. J Neurol Neurosurg Psychiatry, 2010, 81(5): 552-561. DOI:10.1136/jnnp.2009.196246 |
| [6] |
Fernandez-Espejo D, Junque C, Cruse D, et al. Combination of diffusion tensor and functional magnetic resonance imaging during recovery from the vegetative state[J]. BMC Neurol, 2010, 10: 77. DOI:10.1186/1471-2377-10-77 |
| [7] |
Sidaros A, Engberg AW, Sidaros K, et al. Diffusion tensor imaging during recovery from severe traumatic brain injury and relation to clinical outcome:a longitudinal study[J]. Brain, 2008, 131(2): 559-572. |
| [8] |
Edlow BL, Copen WA, Izzy S., et al. Longitudinal diffusion tensor imaging detects recovery of fractional anisotropy within traumatic axonal injury lesions[J]. Neurocrit Care, 2016, 24(3): 342-352. DOI:10.1007/s12028-015-0216-8 |
| [9] |
Bendlin BB, Ries ML, Lazar M, et al. Longitudinal changes in patients with traumatic brain injury assessed with diffusion tensor and volumetric imaging[J]. Neuroimage, 2008, 42(2): 503-514. DOI:10.1016/j.neuroimage.2008.04.254 |
| [10] |
Jang SH, Chang CH, Jung YJ, et al. Change of ascending reticular activating system with recovery from vegetative state to minimally conscious state in a stroke patient[J]. Medicine (Baltimore), 2016, 95(49): e5234. DOI:10.1097/MD.0000000000005234 |
| [11] |
Jang SH, Seo JP. Restoration of the ascending reticular activating system compressed by hematoma in a stroke patient[J]. Medicine (Baltimore), 2017, 96(7): e6103. DOI:10.1097/MD.0000000000006103 |
| [12] |
Jang SH, Kim SH, Lim HW, et al. Recovery of injured lower portion of the ascending reticular activating system in a patient with traumatic brain injury[J]. Am J Phys Med Rehabil, 2015, 94(3): 250-253. DOI:10.1097/PHM.0000000000000274 |
| [13] |
Jang SH, Lee HD, Chang CH, et al. Recovery of hypersomnia concurrent with recovery of an injured ascending reticular activating system in a stroke patient:a case report[J]. Medicine (Baltimore), 2016, 95(2): e2484. DOI:10.1097/MD.0000000000002484 |
| [14] |
Jang SH, Hyun YJ, Lee HD. Recovery of consciousness and an injured ascending reticular activating system in a patient who survived cardiac arrest:A case report[J]. Medicine (Baltimore), 2016, 95(26): e4041. DOI:10.1097/MD.0000000000004041 |
| [15] |
Jang SH, Hyun YJ, Lee HD. Ascending reticular activating system recovery in a patient with brain injury[J]. Neurology, 2015, 84(19): 1997-1999. DOI:10.1212/WNL.0000000000001563 |
 2019, Vol. 46
2019, Vol. 46


