扩展功能
文章信息
- 任康, 申良方, 周琴, 刘超
- 青少年神经纤维瘤病Ⅱ型综合治疗1例报道
- 国际神经病学神经外科学杂志, 2018, 45(6): 614-617
-
文章历史
收稿日期: 2018-09-12
修回日期: 2018-11-22
神经纤维瘤病Ⅱ型(Neurofibromatosis type 2, NF2)是一种罕见的常染色体显性遗传病,在人群发病率约1/60, 000,其中18%为少年儿童发病[1]。儿童NF2临床表现多不典型、易漏诊,预后差。本文报道了一例青少年NF2,合并多个预后不良因素,属于NF2中预后较差的Wishart重型[2],目前此型国内外报道较少,现对我院收治的一例青少年Wishart重型NF2患者报道如下。
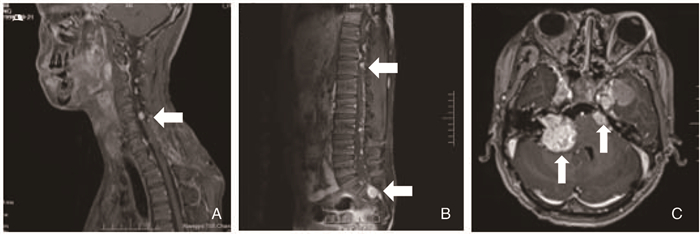
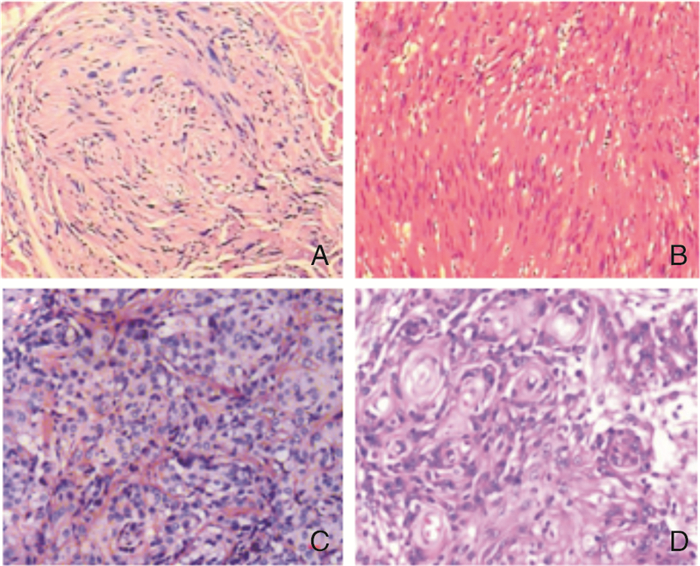
1 临床资料患者,男,13岁,2010年2月有左耳听力下降,2014年3月左耳听力丧失,至北京301医院神经外科行颅脑MRI提示双侧桥小脑区(Cerebellopontine angle,CPA)占位性病变,当时右耳听力正常,行左侧听神经瘤切除术。2015年6月患者出现颈部、胸背多处皮下结节,随后出现胸背胀痛、行走不稳,脊柱磁共振示:颈胸腰骶段椎管内、腰4椎旁多发占位(图 2.A、B)。于2015年6月接受背部结节切除手术,术后病理示真皮内神经纤维瘤病(图 1.A),2015年7月行C7、T1、T7椎管内肿物切除手术,术后病检示:(椎管内)多发神经鞘瘤及脊膜瘤(图 1.C)。
|
| 图 2 椎管内肿瘤及听神经瘤磁共振-T1增强图像 A、B颈胸腰骶段椎管内、L4椎旁多发结节,等T1稍长T2信号灶,较大者大小约1.3×1.9 cm,增强可见明显强化;C双侧桥小脑角区可见类圆形等T1稍长T2信号灶,左侧听瘤最大层面:1×1.5 cm,右侧听瘤最大层面:4×4 cm,部分病灶内可见片状长T1长T2信号灶。 |
|
| 图 1 各部位病理组织学形态 A:(背部)真皮内神经纤维瘤病(HE×100);B: (右侧CPA区)神经鞘瘤(HE×100);C:(椎管)脊膜瘤WHOI级(HE×100);D:(左顶枕叶)脑膜瘤WHOII级(HE×100) |
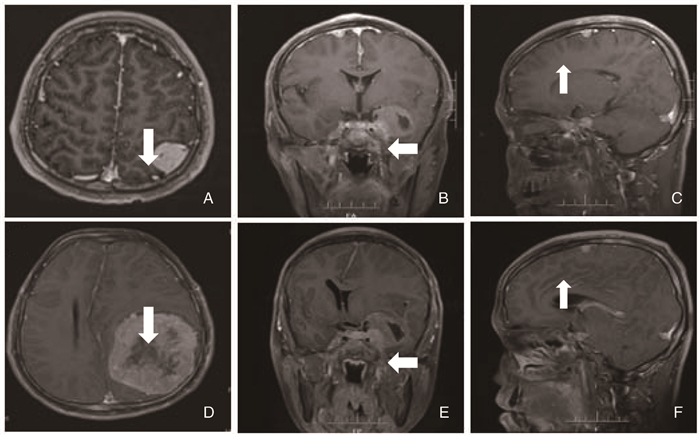
2016年6月患者因右耳听力下降就诊湘雅医院神经外科,完善颅脑MRI示:颅内双侧桥小脑角区、双侧鞍旁蝶骨嵴(图 2.C)、左顶叶占位(图 3.A)。2016年6月接受“右侧CPA区肿瘤切除术”,术中所见肿瘤位于右侧桥小脑角及岩尖斜坡区,边界清楚,血供丰富,与面听神经、三叉神经、后组颅神经粘连紧密,分离神经后予以全切。术后病检提示(右侧CPA区)神经鞘瘤(图 1.B)。术后患者右侧听力丧失,面神经功能Ⅱ级。
|
| 图 3 2016年6月与2017年6月颅内多发脑膜瘤影像学对比 A、B、C为2016年6月;D、E、F为2017年6月复查情况;A.左顶叶见类圆形等T1稍长T2信号灶,部分病灶内可见片状长T1长T2信号灶,大小约2.5×2.1,增强可见明显均匀强化;B.双侧鞍旁不规则肿物,最大直径为3.5 cm,呈长T1稍长T2信号灶,夹杂部分长T1长T2囊变区,增强后强化;C.右额叶类圆形结节,大小为0.7 cm×0.8 cm,增强后可见强化;D.左顶叶肿块较前增大,大小为7.6 cm×6.9 cm,呈长T1稍长T2信号灶,夹杂部分长T1长T2囊变区,增强后明显强化,其内见大片无强化坏死区,周围左侧侧脑室体部及前后角受压变扁、移位,中线结构向右侧移位;E.双侧鞍旁占位较前稍增大,最大直径为4 cm,呈长T1稍长T2信号灶,夹杂部分长T1长T2囊变区,增强后见强化;F.右额叶脑膜瘤大小无明显变化。 |
2017年3月患者因双眼视物模糊,就诊湘雅医院眼科,体格检查示:右前臂见一大小约4×5 cm的牛奶咖啡斑。眼科检查示:双侧晶体混浊,左眼视力0.2,右眼视力0.3。合并面瘫相关性倒睫、眼睑闭合不全。眼底照相:视乳头边界不清,双眼C/D:0.3,A/V=2:3,网膜水肿,无明显出血,黄斑中心反光不清。予以左眼睑内翻矫正术、倒睫拔除术、右睑缘缝合术处理。患者无神经纤维瘤病家族史,完善基因检测提示有NF2突变,根据Manchester诊断标准[3],患者诊断为NF2中的Wishart型[4]。
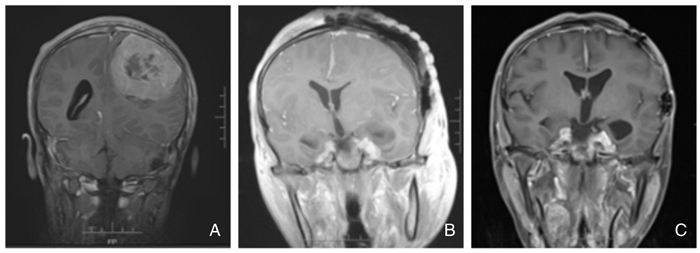
2017年6月患者因视物模糊、头痛进行性加重、癫痫发作再次就诊湘雅医院神经外科,体查:双耳听力丧失;双侧额纹消失,双侧面部感觉减退,张口向右侧歪斜,左侧颞肌、咬肌肌力较右侧减弱,双侧额纹变浅,双侧舌前三分之二味觉消失。头部磁共振示:右侧CPA区结构清晰,未见复发;左侧CPA区可见结节灶,大小为2 cm×1 cm;左侧鞍旁病灶均较前增大, 最大直径为4 cm,左顶枕肿瘤较前明显增大,大小为7.6 cm×6.9 cm(图 3.B、D、F)。于2017年6月30日行“左顶、左鞍旁肿瘤切除术+显微镜下幕上深部肿物切除术”, 术中所见:左顶部见巨大脑膜瘤,大小为7.5 cm×6.5 cm×7 cm,血供丰富,边界清楚,全切肿瘤;另一肿瘤位于左侧鞍旁,大小为3.5 cm×3 cm×3 cm, 血供丰富,边界尚清,部分包裹颈内动脉及动眼神经,视神经受压,予以分块全切。术后病理:(左鞍旁)脑膜瘤WHOI级;(左顶枕)非典型脑膜瘤WHOII级(图.1.D),免疫组化:Ki67(10%),E-cadherin(+),EMA(+), Bcl-2(+),CD34(血管+),STAT6(±), D2-40(-)。
患者多发脑膜瘤生物学行为不一,左顶叶脑膜瘤体积大、生长迅速,予以术后放疗:6MV-X线,IMRT,予以PTV 54 Gy/1.8y×30F。左CPA区听神经瘤复发,现体积较小,予以立体放疗,设置7个射点,处方剂量:12 Gy,最大剂量24 Gy。随访至2018年7月10日,复查颅脑磁共振未显示肿瘤生长迹象,患者行动自如,生活可自理,Karnofsky 90分。
2 讨论90%的NF2患者会发生单侧或双侧听神经瘤(Vestibular schwannoma,VS),合并NF2的VS(NF2-VS)生长速度快、术后复发率高。NF2-VS究竟采用手术还是立体定向放疗目前仍存争议。手术不可避免造成不同程度的听力损失和面神经瘫痪,伽玛刀放疗相比手术具有创伤小,对临近器官危险小等优点,适用于直径<3 cm的小体积肿瘤,5年肿瘤控制率可达87%[5]。但伽玛刀放疗作为VS的初始治疗有治疗失败、加重原有症状的风险,且增加了补救手术的难度,有学者建议对于听神经瘤的初始治疗应以争取显微手术全切为主[6]。本例报道患者初诊时已失去左侧听力,后右侧听力渐进性下降,均予以显微手术切除,2年后左侧听神经瘤复发,直径不足2 cm,予以伽玛刀放疗,随访至今无复发征象。可见NF2-VS初诊时应争取显微手术全切,放疗作为VS复发的补救治疗可取得较好的局控率。
根据临床表现不同,NF2主要分为两型:(1)Gardner轻型:成年起病的双侧VS可为唯一症状;(2)Wishar重型:除VS外还合并多个快速进展的中枢神经系统肿瘤[2]。早发型Wishar重型不同于Gardner轻型,初诊时可不表现为典型的VS,影像学检查不易发现,首次就诊常因牛奶咖啡斑或视力异常,值得注意的是约有2/3青少年NF2患者出现严重的癫痫、颅高压前仅表现为眼科异常,如晶状体浑浊、视神经盘异常等[1],50%的NF2无家族遗传病史,临床症状隐匿,漏诊率较高。基因检测对于非典型儿童NF2的早期确诊及预后判断有重要价值,NF2最常见的基因突变类型为移码、无义突变,这两种突变导致蛋白截短表达。蛋白截短突变发生中枢系统肿瘤及皮肤肿瘤概率更高,预后更差[7]。本研究通过对NF1, NF2,SMARCB1,LTRZ1这4个NF特征性基因进行检测发现该患者NF2基因存在无义突变,编码区第36号至37号核苷酸缺失,致使其后的第34号氨基酸终止,属于蛋白截短突变,结合患者双侧VS及多发神经系统肿瘤,可诊断为Wishar重型NF2,且基因检测提示预后不佳。
|
| 图 4 治疗前后患者颅脑磁共振图像对比 A.2017年6月左顶叶脑膜瘤切除术前;B. 2017年6月术左顶叶脑膜瘤切除后;C.2017年11月放疗后 |
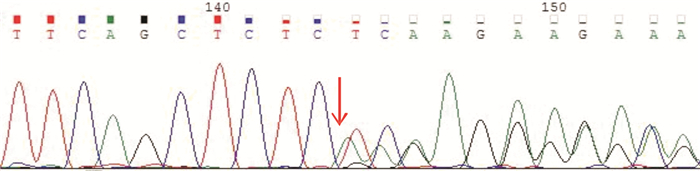
|
| 图 5 患者NF2基因突变检测 对目标区域捕获高通量正向和反向测序(Exon 1 c.36_37delCTp.L14Efs*34),箭头指向突变核苷酸,峰高表示突变概率 |
NF2合并脑膜瘤(NF2-M)的侵袭性及恶性程度高于单纯散发脑膜瘤[8]。本例患者1年时间,左顶部WHO Ⅱ级脑膜瘤增大3倍,左鞍旁WHO Ⅰ级脑膜瘤稍增大,右额部脑膜瘤大小无明显变化,同一个体多发脑膜瘤的生物学行为完全不一样,可据此采用不同的治疗策略。非典型脑膜瘤手术全切的比例仅为80%~90%,术后仍有35%~75%的患者复发,尽管有部分研究显示对于行术后行辅助放疗,总照射量达55~60 Gy,无进展生存期可由13%提高到65%[9]。但目前对术后究竟是密切观察还是辅助放疗仍无定论,术后放疗的指征也有争议。本研究权衡多发脑膜瘤的生物学行为及患者的耐受性,对恶性程度较高、生长迅速的左顶叶WHO Ⅱ级脑膜瘤行全切并辅以术后放疗,剂量达54 Gy,根据最近随访复查结果显示颅内脑膜瘤无复发征象,右额部脑膜瘤已不显示。可见对于NF2合并WHOⅡ级非典型脑膜瘤加做术后术区辅助放疗对于提高局部控制率,对于WHOⅠ级脑膜瘤可行密切观察。
总之,该患者的诊治过程提示青少年NF2累及系统广泛,易漏诊,早期诊断要重视眼科疾患以及全脊柱的影像学筛查,基因检测对鉴别诊断及判定预后很有意义。对于此类复发、颅内多发不同级别脑膜瘤的NF2患者,目前治疗无统一标准,我们从一例典型患者为例,难免有偏倚,但也对复发NF2的治疗提供了新的治疗思路,即以手术为基础、多学科协作,针对病灶不同复发部位,术后结合局部放射治疗及立体放疗,可取得较为理想的治疗效果。
| [1] |
Anand G, Vasallo G, Spanou M, et al. Diagnosis of sporadic neurofibromatosis type 2 in the paediatric population[J]. Arch Dis Child, 2018, 103(5): 463-469. DOI:10.1136/archdischild-2017-313154 |
| [2] |
Ruggieri M, Pratico AD, Evans DG. Diagnosis, Management, and New Therapeutic Options in Childhood Neurofibromatosis Type 2 and Related Forms[J]. Semin Pediatr Neurol, 2015, 22(4): 240-258. |
| [3] |
Smith MJ, Bowers NL, Bulman M, et al. Revisiting neurofibromatosis type 2 diagnostic criteria to exclude LZTR1-related schwannomatosis[J]. Neurology, 2017, 88(1): 87-92. |
| [4] |
Kruyt IJ, Verheul JB, Hanssens PEJ, et al. Gamma Knife radiosurgery for treatment of growing vestibular schwannomas in patients with neurofibromatosis Type 2:a matched cohort study with sporadic vestibular schwannomas[J]. J Neurosurg, 2018, 128(1): 49-59. |
| [5] |
杨华堂, 王喜旺. 听神经鞘瘤的治疗现状[J]. 国际神经病学神经外科学杂志, 2014, 41(3): 253-256. |
| [6] |
李毅锋, 苏燕东, 袁贤瑞. 伽玛刀放疗失败后听神经瘤的显微外科治疗[J]. 国际神经病学神经外科学杂志, 2017, 44(03): 247-251. |
| [7] |
Selvanathan SK, Shenton A, Ferner R, et al. Further genotype-phenotype correlations in neurofibromatosis 2[J]. Clin Genet, 2010, 77(2): 163-170. |
| [8] |
Dewan R, Pemov A, Dutra AS, et al. First insight into the somatic mutation burden of neurofibromatosis type 2-associated grade Ⅰ and grade Ⅱ meningiomas:a case report comprehensive genomic study of two cranial meningiomas with vastly different clinical presentation[J]. Bmc Cancer, 2017, 17(1): 127. DOI:10.1186/s12885-017-3127-6 |
| [9] |
Piscevic I, Villa A, Milicevic M, et al. The Influence of Adjuvant Radiotherapy in Atypical and Anaplastic Meningiomas:A Series of 88 Patients in a Single Institution[J]. World Neurosurg, 2015, 83(6): 987-995. DOI:10.1016/j.wneu.2015.02.021 |
 2018, Vol. 45
2018, Vol. 45




