扩展功能
文章信息
- 杨勇涛, 曹毅, 鲍娟, 景睿, 张媛媛, 李云飞, 胡佳怡, 赵青
- Yang Yong-tao, Cao Yi, Bao Juan, Jing Rui, Zhang Yuan-yuan, Li Yun-fei, Hu Jia-yi, Zhao Qing
- 44例支架辅助弹簧圈栓塞颅内动脉瘤临床分析
- Clinical effect of stent-assisted coil embolization in treatment of intracranial aneurysms: An analysis of 44 cases
- 国际神经病学神经外科学杂志, 2018, 45(6): 600-605
- Journal of International Neurology and Neurosurgery, 2018, 45(6): 600-605
-
文章历史
收稿日期: 2018-09-17
修回日期: 2018-11-28
2002年国际蛛网膜下腔动脉瘤试验(International Subarachnoid Aneurysm Trial,ISAT)研究结果表明,血管内介入治疗是治疗颅内动脉瘤的重要方法[1]。但对于一些特殊的动脉瘤,如宽颈动脉瘤、夹层动脉瘤、梭形动脉瘤、以及与载瘤动脉或分支有特殊毗邻关系等的复杂动脉瘤,单纯的弹簧圈栓塞处理往往较为困难。支架辅助下弹簧圈栓塞动脉瘤技术日渐成熟,对于复杂性动脉瘤能够取得较好的疗效[2-4],但也可能会降低围手术期的安全性。本文对我科完成的44例支架辅助弹簧圈栓塞颅内动脉瘤进行了临床分析与总结。
1 资料与方法 1.1 一般资料回顾性分析了昆明医科大学第二附属医院脑血管病科2016年9月~2018年4月采用支架辅助弹簧圈栓塞治疗的颅内动脉瘤患者共44例。其中男性17例,女性27例。年龄42~85岁,平均(57.4±11.27)岁。52.27%有高血压病史。81.81%的患者Hunt-Hess分级为0~2级。患者一般情况见表 1。
| 例数,x±s | % | |
| 高血压 | 23 | 52.27 |
| 糖尿病 | 5 | 11.36 |
| 冠心病 | 3 | 6.82 |
| 既往脑梗死 | 2 | 4.55 |
| Hunt-Hess分级0级 | 16 | 36.36 |
| Hunt-Hess分级1级 | 3 | 6.82 |
| Hunt-Hess分级2级 | 17 | 38.64 |
| Hunt-Hess分级3级 | 6 | 13.64 |
| Hunt-Hess分级4级 | 2 | 4.54 |
44例患者共51个颅内动脉瘤,破裂至蛛网膜下腔出血28个(54.90%),未破裂动脉瘤23个(45.1%),均为宽颈动脉瘤,其中夹层动脉瘤8个,单纯弹簧圈栓塞后动脉瘤复发1例。所有患者均行颅脑计算机断层扫描(computed tomography,CT)、计算机断层扫描血管成像(computed tomography angiography,CTA)或磁共振血管造影(magnetic resonance angiography,MRA)以及全脑数字减影血管造影(digital subtraction angiography,DSA)检查明确诊断。动脉瘤大小、位置特征见表 2、表 3。
| 动脉瘤位置 | 例数 | % |
| 颈内动脉颅内段 | 23 | 45.09 |
| 大脑中动脉 | 8 | 15.69 |
| 前交通动脉 | 6 | 11.76 |
| 大脑前动脉 | 4 | 7.84 |
| 椎动脉 | 7 | 13.73 |
| 基底动脉 | 3 | 5.88 |
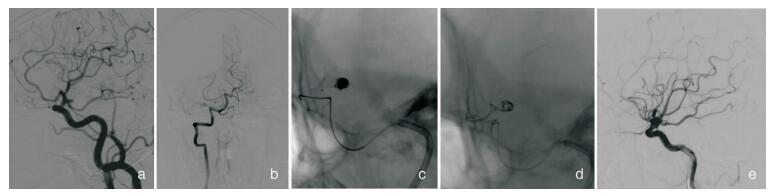
所有患者均在全身麻醉下行血管内介入治疗。未破裂动脉瘤患者术前服用硫酸氢氯吡格雷片(75 mg/d)、阿司匹林(100 mg/d)双联抗血小板3~5 d,或术前负荷剂量硫酸氢氯吡格雷片75 mg、阿司匹林300 mg。常规股动脉穿刺置6F动脉鞘,给予常规肝素化。6F导引导管行三维DSA成像,选取工作角度并测量动脉瘤瘤体大小、瘤颈及载瘤动脉远端、近端宽度,根据动脉瘤的形态特征、位置、载瘤动脉管径、动脉瘤与载瘤动脉及其分支的关系等选择合适的支架。其中有3例夹层动脉瘤患者采用“双支架”辅助弹簧圈栓塞治疗,共使用支架54枚。术中使用的支架类型见表 4。微导丝导引下先将支架微导管送入载瘤动脉远端,再将输送弹簧圈用微导管送入动脉瘤腔内,经支架导管输送支架至拟释放位置,根据需要采用半释放技术或先释放支架后进微导管,必要时采取“灯笼”技术,推挤支架,以增强支架的贴壁性、加强瘤颈处的填塞或保护与瘤颈关系密切的重要血管分支。缓慢、均匀释放支架覆盖部分、大部分或全部动脉瘤颈,弹簧圈成篮、填塞至动脉瘤达到致密栓塞。支架打开时均给予替罗非班注射液负荷剂量(10 μg/kg)静脉推注(3 min内团注),随后持续泵入维持量0.15 μg/(kg·min)12~24小时(据术中是否有血栓事件及造影剂滞留),停替罗非班前4小时叠加硫酸氢氯吡格雷片(75 mg /d)、阿司匹林(100 mg/d),维持口服双抗3个月(患者均予完善氯吡格雷基因型检测,如为中间代谢或慢代谢型,改服替格瑞洛90 mg Bid),然后改为单用阿司匹林(100 mg/d)长期口服。术后患者重症监护室密切观察生命体征、神经系统体征,动态复查头颅CT。(见图 1~图 4)
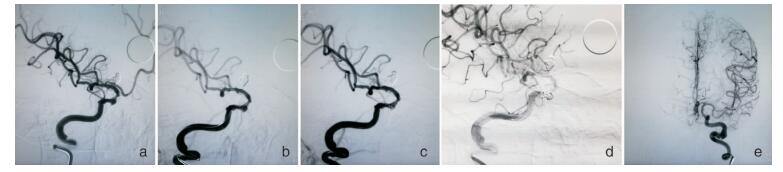
|
| 图 1 基底动脉尖动脉瘤支架辅助下栓塞术 a.基底动脉尖破裂动脉瘤。b.通过微导丝将支架微导管预置到右侧大脑后动脉,经微导管送入LEO支架。c.采用支架半释放技术,LEO 2.5×18 mm半释放,填塞弹簧圈,采用“灯笼”技术,推挤支架,同时保护双侧大脑后动脉、右侧小脑上动脉。d.完全释放支架,将动脉瘤致密填塞,但基底动脉尖与双侧大脑后动脉交界处支架内部分血栓形成。e.经微导管缓慢注入尿激酶8万u,血栓消失。各血管血流通畅。 |
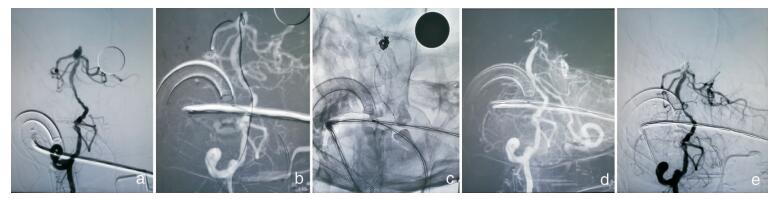
|
| 图 2 前交通动脉瘤支架辅助下栓塞术。 前交通动脉瘤支架辅助下栓塞术。a, b.前交通动脉破裂瘤。c. LVIS JR. 2.5 mm×17置入同侧大脑前动脉A1段。d.完全打开支架,致密填塞动脉瘤。e.动脉瘤致密填塞,各血管血流通畅。 |
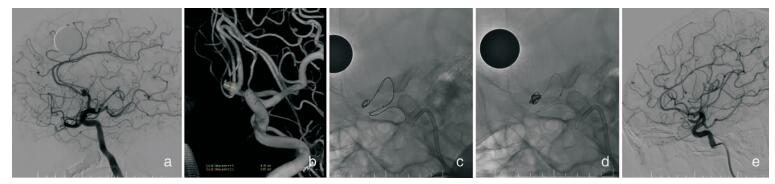
|
| 图 3 右颈内动脉后交通动脉开口处动脉瘤支架辅助下栓塞术。 a.右侧颈内动脉后交通动脉开口处破裂动脉瘤b.右侧大脑后动脉P1段缺如,考虑为胚胎型大脑后动脉,栓塞动脉瘤必须保留右侧后交通动脉。c.支架微导管预先置入右侧大脑中动脉M1段,LVIS 4.5mm×15mm支架采取半释放技术辅助栓塞。d.采用“灯笼”技术,将支架在瘤颈处推密,加强瘤颈处致密填塞,同时保护后交通动脉开口。e.动脉瘤致密栓塞,自瘤颈处发出的后交通动脉完整保留。 |
术后即刻行DSA,根据Raymond分级评价动脉瘤即刻栓塞程度。术后6个月改良Rankin量表(modified Rankin scale,mRS)评分评估疗效,mRS评分0~2分为结局良好。
2 结果所有支架完全释放,支架释放率100%。术后即刻DSA,51个动脉瘤Ⅰ级栓塞38个(74.5%),Ⅱ级栓塞9个(17.6%),Ⅲ级栓塞4个(7.84)。其中28个破裂动脉瘤Ⅰ级栓塞24个(85.7%),Ⅱ级栓塞3个(10.7%),Ⅲ级栓塞1个(3.6%);23个未破裂动脉瘤Ⅰ级栓塞14个(60.9%),Ⅱ级栓塞6个(26.1%),Ⅲ级栓塞3个(13.04%)。
术中支架内血栓形成7例(15.90%)(Enterprise支架1例,LVIS支架4例,LEO支架2例)。其中3例术中为支架内少量血栓形成或是仅见载瘤动脉远端造影剂有滞留,予常规静脉泵入替罗非班后改善,血管恢复通畅,但24小时后仍有1例血管再次闭塞,大面积脑梗死,最终死亡,另2例结局良好。4例术中支架内形成明显血栓者,在常规静脉泵入替罗非班基础上,给予尿激酶或替罗非班微导管内推注动脉溶栓,血管均恢复通畅,但术后仍有2例结局不良(mRS分别为3分和4分),2例结局良好。
发生出血性并发症共4例(9.09%)(LVIS支架1例,LVIS JR.支架2例,Enterprise支架1例)。2例为填塞动脉瘤过程中动脉瘤破裂,2例为术后24小时内再次出血,其中2例死亡。
死亡共3例(6.82%),评估随访余41例患者36例结局良好(mRS评分0~2分)(81.81%),但有1例大脑中动脉M1段夹层动脉瘤及1例椎动脉夹层动脉瘤复发,经再次栓塞治疗后,结局良好。见表 5。
支架辅助栓塞术(stent-assist coiling,SAC)是一项广泛应用于颅内动脉瘤的治疗方法,尤其是对于宽颈动脉瘤、微小动脉瘤、夹层动脉瘤等复杂动脉瘤,支架辅助能够提高动脉瘤的栓塞成功率,并降低动脉瘤的复发率[5, 6]。支架所起的作用包括:①避免微弹簧圈从宽颈动脉瘤颈部的逃逸而误栓载瘤动脉。②减少动脉瘤内的血流量,促进瘤内血栓形成。③支架促进血管内膜的生长。④保护与动脉瘤相关部位的穿支血管。⑤支架引起动脉瘤内血流动力学改变[7]。目前临床上常用的Enterprise为激光雕刻闭环支架,不易发生变形,有较强径向支撑力[8],金属网孔大,可减少穿支血管闭塞的几率。LVIS支架是自膨式编织支架,全程可视,较Enterprise支架具有更高的金属覆盖率(23%),有一定血流导向作用,促进动脉瘤的闭塞[9],同时柔顺性、贴壁性更好,而且可为血管内皮细胞再生提供很好的物理支撑[10]。有研究证实,LVIS支架辅助弹簧圈栓塞安全可行,可提高动脉瘤的栓塞率和降低复发率[11, 12]。LVIS支架还可根据术中具体情况进行适当推挤,增强支架在血管转角处的贴壁性;采用“灯笼”技术在瘤颈处推密支架以更好的封闭瘤颈及保护自瘤颈发出的重要血管分支。基于此,本研究中大部分患者选取了LVIS支架辅助栓塞动脉瘤(66.67%)。当载瘤动脉伴有明显原位狭窄或大型动脉瘤,需要有较强径向支撑力的支架辅助栓塞时,我们更倾向于选择Enterprise支架。夹层动脉瘤亦可选择双LVIS支架辅助栓塞,以更好的修复载瘤动脉。本研究共8例夹层动脉瘤,其中3例使用了双LVIS支架辅助栓塞,6月后复查均结局良好。2例使用了LVIS单支架辅助栓塞的夹层动脉瘤6月后随访复发(1例椎动脉,1例大脑中动脉M1段),再次予栓塞并再贴入支架一枚,术后结局良好。7例载瘤动脉直径 < 2.5 mm的患者,我们则选取直径较小的LVIS Jr.支架进行辅助栓塞。LEO支架与LVIS支架类似,为自膨式编织支架,亦有良好的顺应性,释放90%可回收,操作空间大,由于LEO支架具有16根编织丝(LVIS支架为12根),支撑性略强于LVIS支架,但如要进行推密操作则需谨慎。
本研究术中术后总体并发症发生率25%(11例),支架内血栓形成发生率15.90%,出血性并发症发生率9.09%,其中死亡3例(6.82%),但最终大部分病人获得了良好结局(随访6月mRS评分0~2分,81.81%)。其中2例患者随访mRS 4分者起病Hunt-Hess已为4级。
急性血栓形成是支架辅助动脉瘤栓塞主要的并发症之一[13],以术中发生最为常见。主要原因包括:①血管内操作时间过长或在支架打开过程中内膜损伤[14]。②支架贴壁不良,尤其是支架通过血管转角或分叉部,原因可能为释放操作技术的影响,血管转角过锐以及支架选择偏小。③围手术期抗凝不充分。④支架的类型也与血栓发生密切相关。LEO及LVIS支架金属覆盖率高,致栓性强。在支架半释放过程中,支架部分打开,载瘤动脉血流减缓,容易导致血栓形成。在对这两种支架使用推密技术时,如推挤过度,可能对血管壁造成刺激,诱发血栓形成,尤其是LEO支架。关于如何最大程度的预防血栓形成,选择的支架一般不应小于拟释放支架血管管径,如血管远近端粗细不均,应采取“就大不就小的原则”。在术中,应注意缓慢、均匀地顺势释沿血管走形释放支架,支架尽量避免通过血管分叉部或过大的血管转角;尽量缩短操作时间,避免反复推拉支架或过度推挤;支架打开后,在弹簧圈填塞动脉瘤过程中,应注意避免选圈过大及瘤颈处的过度填塞导致支架变形。围手术期充分的抗凝治疗亦是避免血栓形成的重要措施。包括阿司匹林和氯吡格雷在内的抗血小板药物能够有效预防支架内血栓形成并减少不良脑血管事件的发生[15]。国外研究证实,在破裂动脉瘤急性期的患者,术中使用替罗非班对于降低缺血事件的发生可能有更高的有效性,且不增加出血的风险[16, 18]。本研究中未破裂动脉瘤患者均术前口服常规双抗至少3天或术前负荷剂量双抗,未破裂与破裂动脉瘤患者术中均予静脉替罗非班泵入,如术中有明显血栓事件,可酌情给予尿激酶或替罗非班微导管动脉溶栓。
术中、术后并发出血可能原因有:①微导丝及微导管的张力在进入动脉瘤腔之前未提前释放,导致微导管直接穿破动脉瘤壁。②支架释放后,微导管被压于支架与瘤颈壁之间,使微导管头端在填塞弹簧圈时,失去活动空间,增加动脉瘤壁张力导致术中动脉瘤破裂,尤其在动脉瘤较小时或动脉瘤形态复杂,存在子囊等,由于导管头调整困难而导致动脉瘤栓塞不全,在持续抗凝状态下再次出血。本研究发生出血的4例动脉瘤最大径分别为2.5 mm、3.5 mm、2.0 mm、3.0 mm,均为小型动脉瘤。在支架辅助填塞较小动脉瘤时,易选用较柔软的弹簧圈,采取半释放技术,可在动脉瘤填塞已大部分完成时再予完全打开支架。动脉瘤应尽量予完全致密栓塞,尤其是破裂动脉瘤。
总之,支架辅助栓塞颅内动脉瘤技术对于治疗复杂动脉瘤相对安全、有效。需根据动脉瘤、载瘤动脉的具体情况,兼顾支架的输送性、顺应性贴壁性、径向支撑力等选择支架,采取适当的释放技术及弹簧圈栓塞技术,并针对患者采取个体化抗凝治疗,最大程度避免并发症的发生。
| [1] |
Molyneux A, Kerr R, Stratton I, et al. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms:a randomised trial[J]. Lancet, 2002, 360(9342): 1267-1274. DOI:10.1016/S0140-6736(02)11314-6 |
| [2] |
Yang P, Zhao K, Zhou Y, et al. Stent-assisted coil placement for the treatment of 211 acutely ruptured wide-necked intracranial aneurysms:a single-center 11-year Experience[J]. Radiology, 2015, 276(2): 545-552. |
| [3] |
Muto M, Giurazza F, Ambrosanio G, et al. Stent-assisted coiling in ruptured cerebral aneurysms:multi-center experience in acute phase[J]. Radiol Med, 2017, 122(1): 43-52. |
| [4] |
Grossberg JA, Hanel RA, Dabus G, et al. Treatment of wide-necked aneurysms with the Low-profile Visualized Intraluminal Support (LVIS Jr) device:a multicenter experience[J]. J Neurointerv Surg, 2017, 9(11): 1098-1102. DOI:10.1136/neurintsurg-2016-012687 |
| [5] |
Feng MT, Wen WL, Feng ZZ, et al. Endovascular embolization of intracranial aneurysms:To use stent(s) or not? Systematic Review and Meta-analysis[J]. World Neurosurg, 2016, 93: 271-278. DOI:10.1016/j.wneu.2016.06.014 |
| [6] |
Ho MJ, Göricke SL, Mummel P, et al. Stent-assisted treatment of ruptured intracranial aneurysms in the acute phase:A single centerexperience[J]. Neurological Sci, 2018, 28(10): 31-36. |
| [7] |
Kono K, Shintani A, Terada T. Hemodynamic effects of stent struts versus straightening of vessels in stent-assisted coil embolization for sidewall cerebral aneurysms[J/OL]. PLoS One, 2014, 9(9): e108033.
|
| [8] |
Lodi Y, Latorre J, El-Zammar Z, et al. Single stage versus multi-staged stent-assisted endovascular repair of intracranial aneurysms[J]. J Vasc Interv Neurol, 2011, 4(1): 24-28. |
| [9] |
Feng Z, Fang Y, Xu Y, et al. The safety and efficacy of low profile visualized intraluminal support (LVIS) stents in assisting coil embolization of intracranial saccular aneurysms:a single center experience[J]. J Neurointerv Surg, 2016, 8(11): 1192-1196. DOI:10.1136/neurintsurg-2015-012090 |
| [10] |
Möhlenbruch M, Herweh C, Behrens L, et al. The LVIS Jr.microstent to assist coil embolization of wide-neck intracranial aneurysms. clinical study to assess safety and efficacy[J]. Neuroradiology, 2014, 56(5): 389-395. DOI:10.1007/s00234-014-1345-z |
| [11] |
盛斌, 方兴根, 李真保, 等. LVIS支架辅助栓塞治疗颅内动脉瘤20例的临床分析[J]. 国际神经病学神经外科学杂志, 2016, 43(6): 551-554. |
| [12] |
张荣举, 王君, 邸海, 等. LVIS支架在颅内动脉瘤治疗中的安全性及有效性的单中心观察性研究[J]. 中国卒中杂志, 2018, 13(8): 785-789. DOI:10.3969/j.issn.1673-5765.2018.08.005 |
| [13] |
Akins PT, Amar AP, Pakbaz RS, et al. Complications of endovascular treatment for acute stroke in the SWIFT trial with solitaire and Merci devices[J]. Am J Neuroradiol, 2014, 35(3): 524-528. DOI:10.3174/ajnr.A3707 |
| [14] |
Lane DA, Grant PJ. Role of hemostatic gene polymorphisms in venous and arterial thrombotic disease[J]. Blood, 2000, 95(5): 1517-1532. |
| [15] |
Ge H, Lv X, Ren H, et al. Influence of cyp2c19 genetic polymorphisms on clinical outcomes of intracranial aneurysms treated with stent-assisted coiling[J]. J Neurointerv Surg, 2017, 9(10): 958-962. DOI:10.1136/neurintsurg-2016-012635 |
| [16] |
Zi-Liang W, Xiao-Dong L, Tian-Xiao L, et al. Intravenous administration of tirofiban versus loading dose of oral clopidogrel for preventing thromboembolism in stent-assisted coiling of intracranial aneurysms[J]. Int J Stroke, 2017, 12(5): 553-559. |
| [17] |
Kim S, Choi JH, Kang M, et al. Safety and efficacy of intravenous tirofiban as antiplatelet premedication for stent-assisted coiling in acutely ruptured intracranial aneurysms[J]. Am J Neuroradiol, 2016, 37(3): 508-514. DOI:10.3174/ajnr.A4551 |
| [18] |
Sedat J, Chau Y, Mondot L, et al. Is eptifibatide a safe and effective rescue therapy in thromboembolic events complicating cerebral aneurysm coil embolization? Single-center experience in 42 cases and review of the literature[J]. Neuroradiology, 2013, 56(2): 145-153. |
 2018, Vol. 45
2018, Vol. 45