扩展功能
文章信息
- 刘志强, 方薪淇, 宋涛, 王莹, 黄天翔, 马玉杰, 伍军
- Liu Zhi-qiang, Fang Xin-qi, Song Tao, Wang Ying, Huang Tian-xiang, Ma Yu-jie, Wu Jun
- 92例高级别胶质瘤患者术后生存分析
- Postoperative survival of high-grade glioma: An analysis of 92 cases
- 国际神经病学神经外科学杂志, 2018, 45(6): 577-581
- Journal of International Neurology and Neurosurgery, 2018, 45(6): 577-581
-
文章历史
收稿日期: 2018-09-17
修回日期: 2018-11-26
2. 中南大学湘雅医学院, 湖南 长沙 410013
2. Grade 2015 Major in Clinical Medicine, Xiangya Medical College, Central South University, Changsha, Hunan, 410013
胶质瘤起源于神经胶质细胞或者其前体细胞,WHO Ⅲ-Ⅳ级的胶质瘤归类为高级别胶质瘤。高级别胶质瘤预后差, 2年的生存率为14.6%[1-3]。其治疗原则是手术最大范围安全切除肿瘤后采用积极的辅助治疗。目前术后辅助治疗主要推荐STUPP方案,即术后同步放疗和同步TMZ化疗,后续予以TMZ辅助化疗6~12个月,但预后仍不容乐观,GBM 5年生存率低至10%[4, 5]。近期研究表明MGMT基因启动子是否甲基化和IDH基因是否突变能指导高级别胶质瘤术后放、化疗方案的制定,此类与预后紧密相关的分子指标的不断发现预示着术后个体化辅助治疗已经成为主流趋势,并且随着复发后再次治疗方案的完善以及靶向治疗和免疫疗法的应用,高级别胶质瘤患者的预后将会进一步改善。
此研究对2014年1月至2016年8月在中南大学湘雅医院神经外科同一治疗组进行首次诊治的92例高级别脑胶质瘤患者进行了回顾性分析,探讨影响高级别脑胶质瘤患者术后生存的因素,并结合此项研究和相关文献对高级别胶质瘤的个体化治疗进行探讨。
2 材料与方法 2.1 术前资料主要搜集的信息为年龄、性别、临床症状、术前KPS评分、肿瘤部位、数目、大小和累及皮层脑叶数目。本研究中13例患者为颅内多发肿瘤,无法精确计算肿瘤大小,遂未纳入肿瘤大小与OS关系的统计分析;21例患者肿瘤累及深部脑组织或靠近中线,遂未纳入肿瘤累及皮层脑叶数与OS关系的统计分析。
2.2 术后资料主要搜集的信息为手术时间、肿瘤切除程度、病理资料、术后辅助治疗方式、复发时间、复发后治疗方式和死亡时间。所有患者均进行手术治疗,通过术后72 h内头部磁共振复查结果来判断肿瘤切除程度,其中非全切除包括次全切除(≥90%)和部分切除(< 90%)。术后化疗患者均采用TMZ,其中完成同步放化疗但在辅助化疗过程中肿瘤复发导致死亡4例,在单独TMZ化疗6个月过程中肿瘤复发导致死亡1例,单纯放疗1例,病理资料中未行免疫组化1例。首次手术时间和死亡时间的间隔为OS,首次手术时间和复发时间的间隔为PFS。
2.3 统计学方法分别应用SPSS 18.0和Graphpad prism 5.0软件进行数据分析和图表制作,采用Kaplan-Meier法对患者OS和PFS进行分析,采用Log-rank检验进行单因素分析。采用Cox比例风险回归模型进行多因素分析,引入检验水准α为0.01。P < 0.05认为差异有统计学意义。
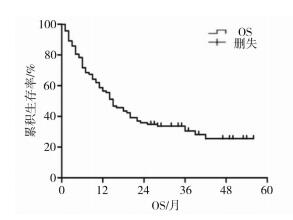
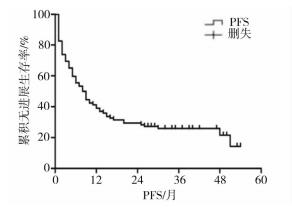
3 结果 3.1 患者生存情况随访截止至2018年8月31日,65例(70.65%)患者死亡,27例(29.35%)患者存活,随访时间为1~56个月,中位PFS为8±1.439(95% confidence interval [CI]:5.180~10.820)个月(图 1),中位OS为15±2.175(95%CI:10.736~19.264)个月,1年、2年、3年、4年生存率分别为56.5%、35.9%、30.4%、25.4%(图 2)。
|
| 图 1 92例高级别胶质瘤患者总生存期曲线 |
|
| 图 2 92例高级别胶质瘤患者无进展生存期曲线 |
年龄≥65岁、术前KPS评分<70分、肿瘤多发、累及多个皮层脑叶或运动功能区、直径≥5 cm、未全切除、病理级别高、IDH野生型、MGMT启动子非甲基化、Ki 67>15%、术后未进行放化疗或者仅进行单独化疗、进行放化疗后复发后仅进行对症支持治疗的患者预后较差(P<0.05),而性别与预后无明显关系(P>0.05)(表 1)。
| 因素 | 例数 | 存活/[例数(%)] | 死亡/[例数(%)] | 中位OS/月 | P值 |
| 性别 | |||||
| 男 | 50 | 13(14.13%) | 37(40.22%) | 14±2.65 | |
| 女 | 42 | 14(15.22%) | 28(30.43%) | 15±4.63 | 0.405 |
| 年龄/岁 | |||||
| ≥65 | 15 | 1 (1.09%) | 14(15.22%) | 6±0.69 | |
| <65 | 77 | 26(28.26%) | 51(55.43%) | 18±2.63 | 0.001 |
| 肿瘤直径/cm | |||||
| ≥5 | 56 | 14(17.72%) | 42(53.16%) | 12±1.87 | |
| <5 | 23 | 11(13.92%) | 12(15.19%) | 36±9.25 | 0.021 |
| 累及运动功能区 | |||||
| 是 | 27 | 3 (3.26%) | 24(26.09%) | 7±1.73 | |
| 否 | 65 | 24(26.09%) | 41(44.57%) | 20±4.92 | 0.002 |
| 累及皮层脑叶数目/个 | |||||
| >1 | 27 | 4 (5.63%) | 23(32.39%) | 12±4.30 | |
| 1 | 44 | 17(23.94%) | 27(38.03%) | 15±4.26 | 0.018 |
| 肿瘤数目/个 | |||||
| >1 | 13 | 1 (1.09%) | 12(13.04%) | 6±1.17 | |
| 1 | 79 | 26(28.26%) | 53(57.61%) | 18±2.64 | 0.004 |
| 术前KPS评分/分 | |||||
| ≥70 | 75 | 25(27.17%) | 50(54.35%) | 18±2.60 | |
| <70 | 17 | 2 (2.17%) | 15(16.30%) | 6±1.54 | 0.004 |
| 切除程度 | |||||
| 全切除 | 67 | 27(29.35%) | 40(43.48%) | 22±5.21 | |
| 非全切除 | 25 | 0 (0.00%) | 25(27.17%) | 5±1.25 | <0.001 |
| 病理级别 | |||||
| Ⅲ级 | 33 | 14(15.22%) | 19(20.65%) | 25±10.53 | |
| Ⅳ级 | 59 | 13(14.13%) | 46(50.00%) | 13±1.71 | 0.023 |
| IDH | |||||
| 突变型 | 17 | 7 (7.69%) | 10(10.99%) | 36±7.78 | |
| 野生型 | 74 | 19(20.88%) | 55(60.44%) | 12±2.39 | 0.045 |
| MGMT启动子 | |||||
| 甲基化 | 51 | 19(20.88%) | 32(35.16%) | 19±3.06 | |
| 非甲基化 | 40 | 7 (7.69%) | 33(36.26%) | 12±3.16 | 0.040 |
| Ki67 | |||||
| >15% | 59 | 12(13.19%) | 47(51.65%) | 13±1.92 | |
| ≤15% | 32 | 14(15.38%) | 18(19.78%) | 22±7.06 | 0.027 |
| 术后辅助治疗方式 | |||||
| 放疗和/或化疗 | 62 | 26(28.26%) | 36(39.13%) | 28±6.74 | |
| 对症支持治疗 | 30 | 1 (1.09%) | 29(31.52%) | 4±0.75 | <0.001 |
| 术后放化疗方式 | |||||
| 同步放化疗+辅助 | 50 | 24(39.34%) | 26(42.62%) | 39±9.18 | |
| 化疗 | 11 | 2 (3.28%) | 9 (14.75%) | 14±2.13 | 0.013 |
| 同步放化疗+辅助化疗后 | |||||
| 复发后治疗方式 | |||||
| 手术和/或化疗或贝伐珠单抗 | 18 | 3 (9.09%) | 15(45.45%) | 22±5.30 | |
| 对症支持治疗 | 15 | 1 (3.03%) | 14(42.42%) | 12±1.93 | 0.030 |
引入检验水准α= 0.01,结果显示:年龄、肿瘤切除程度、术后是否进行放疗和/或化疗为影响高级别胶质瘤临床预后的独立危险因素(P<0.01)(表 2)。
| 因素 | RR | 95%CI | P值 |
| 切除程度 | |||
| 全切除 | 1 | ||
| 非全切除 | 3.204 | 1.832-5.606 | <0.001 |
| 年龄/岁 | |||
| <65 | 1 | ||
| ≥65 | 2.415 | 1.270-4.591 | 0.007 |
| 术后放疗和/或化疗 | |||
| 是 | 1 | ||
| 否 | 4.349 | 2.426-7.796 | <0.001 |
| 注:RR(relative risk):相对危险度。 | |||
高级别胶质瘤首选手术治疗,并且本研究证明肿瘤切除程度为影响患者预后的独立危险因素,但是如何做到最大程度安全切除肿瘤成为临床上一大难题。使用5-aminolevulinic acid (5-ALA, 5-氨基乙酰丙酸)进行荧光介导手术后肿瘤全切率为65%[6],而神经导航辅助下手术的全切率仅为31%[7]。本研究中肿瘤全切率为72.83%,明显高于上述两者,原因如下:①样本量较小,同质性不强,存在选择偏倚可能;②患者术前常规进行功能磁共振检查(如:BOLD- fMRI和/或DTI),有利于术前辨别肿瘤和功能区以及周围神经传导束的位置关系,设计最佳的手术入路,术中进行电生理监测,不仅有利于对并发癫痫的肿瘤病灶进行全切除,而且可以精确掌控重要部位周边肿瘤的切除程度,进而客观上提高了肿瘤全切率,减少了神经功能的缺失,又降低了复发率。
单纯手术治疗并不能完全控制肿瘤,术后早期(2周后)无化疗禁忌症即可开始进行TMZ化疗,并且当术后进行TMZ同步放化疗时,延迟放疗时间并不影响预后[4, 8]。本研究中术后进行放疗和/或化疗的患者中位OS明显长于术后仅进行单独对症支持治疗的患者(P<0.001),并且采用STUPP方案治疗的患者中位OS明显高于术后仅单独化疗患者(P<0.05),表明高级别胶质瘤术后进行STUPP方案能使患者获得更好的预后,同时证实了该方案的有效性。MGMT能修复烷化剂类化疗药物(如TMZ)导致的肿瘤细胞DNA的破坏,而MGMT基因启动子甲基化使表达MGMT的基因沉默[9]。本研究中MGMT甲基化患者中位OS明显长于非甲基化患者(P<0.05),原因可能为非甲基化肿瘤细胞内MGMT水平较高,降低了TMZ对肿瘤细胞DNA的破坏效果,这可能是MGMT非甲基化肿瘤对TMZ耐药的原因之一。IDH基因突变在胶质母细胞瘤和老年患者出现较少[10],并且低水平的NADPH可使肿瘤对放疗和化疗更加敏感[11],而本研究中WHO Ⅳ级、年龄≥65岁、IDH基因未突变的患者预后分别明显差于WHO Ⅲ级(P<0.05)、年龄<65岁(P<0.01)、IDH基因突变(P<0.05)的患者,IDH基因的突变状态可以部分解释本研究结果。所以,MGMT甲基化患者更加获益于化疗,而非甲基化患者可能更多地从放疗中受益。Ki67指数主要反映细胞增殖情况,与肿瘤多灶性成正相关,但是与预后成负相关。本研究中Ki67>15%和肿瘤个数>1的中位OS预后明显差于Ki67≤15%(P<0.05)和单发肿瘤(P<0.01)的患者,这一结果与文献报道一致[11]。术前KPS评分≥70分和肿瘤直径<5 cm的患者预后较好,与Assistant等的研究结果相符[12]。本研究中累及多个脑叶和运动功能区的肿瘤患者预后差的原因可能是:①术前患者症状明显,术前KPS评分较低;②肿瘤全切率较低;③手术易导致神经功能缺失,术后KPS评分较低,难以耐受常规放化疗。对于术后不宜采用STUPP方案的老年患者,MGMT甲基化患者可行单独化疗,而非甲基化患者可行单独放疗,并且短时程放疗联合TMZ化疗预后更加优于单独短时程放疗[13]。
治疗复发高级别胶质瘤首先应明确是否为复发还是假性进展。假性进展常在放疗后3个月出现,常无明显症状,在脑灌注成像(PWI)上为低灌注[14, 15]。Chul-Kee等提出的评分法认为0~1分适合手术治疗,2分适合保守治疗[16]。适合手术的患者尽量做到肿瘤全切,对不能进行全切的患者采取减瘤手术将肿瘤体积减小至20%或10 cm3以下,仍有利于预后[17, 18]。建议首次术后已行放化疗后至少1年才复发的MGMT非甲基化患者采用放疗结合贝伐珠单抗,而MGMT甲基化患者术后可行TMZ剂量密集方案或长时程TMZ治疗[19, 20]。因为本研究中第一次术后未行放化疗的患者复发后均仅进对症支持治疗,遂只对第一次术后行放化疗的患者进行复发后治疗方式的统计分析,结果显示第一次术后已经行同步放化疗和辅助化疗的患者复发之后行再次手术和/或再次TMZ化疗或贝伐珠单抗靶向治疗的预后明显优于行单独对症支持治疗(P<0.05),说明高级别胶质瘤复发后应根据患者自身情况选择积极的治疗方式,而不宜单独对症支持治疗。但是使用贝伐珠单抗进行治疗时不能忽略其产生的并发症,如动脉血栓和消化道穿孔等[21]。本研究中仅2例患者在肿瘤复发后使用贝伐珠单抗,均出现心肌缺血所致的心率失常而被迫停止使用。因此在使用贝伐珠单抗前需明确身体状况,尤其对于合并多种基础疾病的老年人应请相关专业科室评估,谨慎使用,一旦出现严重并发症应该立即停止用药。
本研究样本量较小,为单中心研究,后续笔者将进一步扩大样本量,延长随访时间,并重点对复发高级别胶质瘤患者的各种治疗方式进行统计学分析,寻找新的临床预后因素,力求实现患者生存和生活质量利益最大化。
| [1] |
Wen PY, Kesari S. Malignant gliomas in adults[J]. N Engl J Med, 2008, 359(5): 492-507. DOI:10.1056/NEJMra0708126 |
| [2] |
Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007, 114(2): 97-109. DOI:10.1007/s00401-007-0243-4 |
| [3] |
Chen B, Wang H, Ge P, et al. Gross total resection of glioma with the intraoperative fluorescence-guidance of fluorescein sodium[J]. Int J Med Sci, 2012, 9(8): 708-714. DOI:10.7150/ijms.4843 |
| [4] |
中国中枢神经系统胶质瘤诊断和治疗指南编写组. 中国中枢神经系统胶质瘤诊断与治疗指南(2015)[J]. 中华医学杂志, 2016(7): 485-509. DOI:10.3760/cma.j.issn.0376-2491.2016.07.003 |
| [5] |
Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study:5-year analysis of the EORTC-NCIC trial[J]. Lancet Oncol, 2009, 10(5): 459-466. DOI:10.1016/S1470-2045(09)70025-7 |
| [6] |
Stummer W, Pichlmeier U, Meinel T, et al. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma:a randomised controlled multicentre phase Ⅲ trial[J]. Lancet Oncol, 2006, 7(5): 392-401. DOI:10.1016/S1470-2045(06)70665-9 |
| [7] |
Mahboob SO, Eljamel M. Intraoperative image-guided surgery in neuro-oncology with specific focus on high-grade gliomas[J]. Future Oncol, 2017, 13(26): 2349-2361. DOI:10.2217/fon-2017-0195 |
| [8] |
Blumenthal DT, Won M, Mehta MP, et al. Short delay in initiation of radiotherapy for patients with glioblastoma-effect of concurrent chemotherapy:a secondary analysis from the NRG Oncology/Radiation Therapy Oncology Group database[J]. Neuro Oncol, 2018, 20(7): 966-974. DOI:10.1093/neuonc/noy017 |
| [9] |
Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study:5-year analysis of the EORTC-NCIC trial[J]. Lancet Oncol, 2009, 10(5): 459-466. DOI:10.1016/S1470-2045(09)70025-7 |
| [10] |
Weller M. Novel diagnostic and therapeutic approaches to malignant glioma[J]. Swiss Med Wkly, 2011, 141: w13210. |
| [11] |
Ahmadipour Y, Jabbarli R, Gembruch O, et al. Impact of multifocality and molecular markers on survival of glioblastoma[J]. World Neurosurg, 2018. |
| [12] |
Kashi AS, Rakhsha A, Houshyari M. Overall survival in adult patients with low-grade, supratentorial glioma:Ten years' follow up at a single institution[J]. Electron Physician, 2015, 7(3): 1114-1120. |
| [13] |
Pellerino A, Franchino F, Soffietti R, et al. Overview on current treatment standards in high-grade gliomas[J]. Q J Nucl Med Mol Imaging, 2018, 62(3): 225-238. |
| [14] |
Brandsma D, Stalpers L, Taal W, et al. Clinical features, mechanisms, and management of pseudoprogression in malignant gliomas[J]. Lancet Oncol, 2008, 9(5): 453-461. DOI:10.1016/S1470-2045(08)70125-6 |
| [15] |
Young RJ, Gupta A, Shah AD, et al. MRI perfusion in determining pseudoprogression in patients with glioblastoma[J]. Clin Imaging, 2013, 37(1): 41-49. |
| [16] |
Park CK, Kim JH, Nam DH, et al. A practical scoring system to determine whether to proceed with surgical resection in recurrent glioblastoma[J]. Neuro Oncol, 2013, 15(8): 1096-1101. DOI:10.1093/neuonc/not069 |
| [17] |
Keles GE, Lamborn KR, Chang SM, et al. Volume of residual disease as a predictor of outcome in adult patients with recurrent supratentorial glioblastomas multiforme who are undergoing chemotherapy[J]. J Neurosurg, 2004, 100(1): 41-46. DOI:10.3171/jns.2004.100.1.0041 |
| [18] |
Oppenlander ME, Wolf AB, Snyder LA, et al. An extent of resection threshold for recurrent glioblastoma and its risk for neurological morbidity[J]. J Neurosurg, 2014, 120(4): 846-853. |
| [19] |
Flieger M, Ganswindt U, Schwarz SB, et al. Re-irradiation and bevacizumab in recurrent high-grade glioma:an effective treatment option[J]. J Neurooncol, 2014, 117(2): 337-345. DOI:10.1007/s11060-014-1394-5 |
| [20] |
Kamiya-Matsuoka C, Gilbert MR. Treating recurrent glioblastoma:an update[J]. CNS Oncol, 2015, 4(2): 91-104. |
| [21] |
Chinot OL, Wick W, Mason W, et al. Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma[J]. N Engl J Med, 2014, 370(8): 709-722. DOI:10.1056/NEJMoa1308345 |
 2018, Vol. 45
2018, Vol. 45



