扩展功能
文章信息
- 刘李静, 傅勤慧, 裴建
- 基质金属蛋白酶-9在脑梗死溶栓治疗中作用的研究进展
- 国际神经病学神经外科学杂志, 2018, 45(5): 546-550
-
文章历史
收稿日期: 2018-03-15
修回日期: 2018-07-11
全球疾病负担数据显示[1],脑卒中为中国人排序第一的死亡原因,也是影响中国民众伤残调整生命年(disability adjusted of life years, DALYS)的首位疾病[2]。急性缺血性脑卒中的处理应强调早期诊断、早期治疗、早期康复和早期预防再发[3]。目前,对于急性脑梗死患者,静脉用重组组织型纤维蛋白溶酶原激活剂(recombinant tissue plasminogen activator, rt-PA)是唯一FDA认证的药理学治疗。系统评价结果显示,符合筛选要求的急性脑卒中病患者中,rt-PA显著降低死亡率并改善患者的预后[4]。然而,rt-PA在脑卒中后最多只有4.5 h治疗时间窗[5, 6],而且静脉用rt-PA治疗与致命性颅内出血的发生率增高有关,这些都限制了溶栓治疗的临床应用。
研究表明,溶栓可触发基底金属蛋白-9(matrix metalloproteinases-9, MMP-9)的表达上调,进而破坏血脑屏障(blood brain barrier, BBB)的完整性,增加溶栓的风险[7, 8]。在溶栓同时联合使用MMP-9抑制剂治疗缺血性脑卒中的动物研究中,rt-PA溶栓时诱导的自发性出血风险被减少,溶栓治疗的时间窗相对延长,这样的结果既进一步肯定了MMP-9表达在溶栓过程中破坏血脑屏障的结论,又为预防溶栓中的脑出血,延长治疗时间窗提供了可行的临床思路[9]。
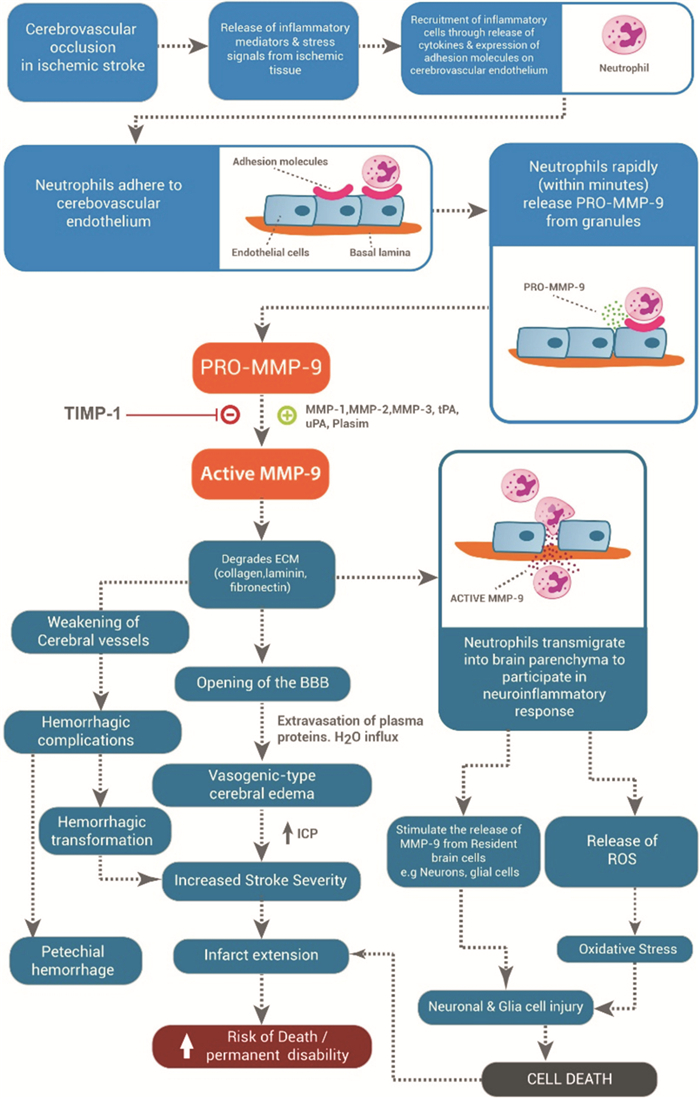
1 MMP-9参与急性缺血性脑卒中血脑屏障破坏脑梗死出现的脑水肿和出血性转化(hemorrhagic transformation, HT)是临床脑卒中较危重的不良结局。BBB的破坏是卒中后继发性损伤级联中的关键事件,其通过各种机制加剧损伤,包括允许外周免疫细胞进入脑中以增强神经炎症反应,并加速血管性水肿的发展等。大量研究显示,基质金属蛋白酶(MMPs)在中风后有破坏血脑屏障,特别是细胞外基质(ECM)的作用与卒中后BBB通透性改变相关[10]。MMPs家族庞大,而其中MMP-9表达水平提高所导致的BBB完整性的延迟破裂与基底层和紧密连接部分的完全降解引起严重的屏障破坏[11],在脑缺血的动物模型中,MMP-9表达显著增加,引起血脑屏障破坏、血管源性水肿形成及出血性转化。
Renée等[12]的实验动物研究阐明了缺血性卒中后BBB的开放和修复顺序(图 1)。缺血性卒中后早期嗜中性粒细胞黏附于脑血管内皮,嗜中性粒细胞释放的MMP-9通过内皮细胞、神经胶质细胞和神经元等转移到脑组织中,致使它们释放MMP-9和其它有害物质,刺激脑细胞释放MMP-9并造成细胞损伤和细胞死亡。嗜中性粒细胞衍生的MMP-9主动降解BBB的成分,致使脑水肿和出血性转化的发展,两者都是脑卒中致命点,导致梗死扩展并增加卒中后死亡和残疾风险因此MMP-9是治疗急性缺血性脑卒中的可能标志物[13],成为了新药开发研究的可能性靶点。
脑卒中后,外周和中枢细胞(包括神经元、神经胶质细胞、内皮细胞和嗜中性粒细胞)都检测到MMP-9水平的升高,其中每种细胞类型都具有独特的MMP分泌/表达谱[14]。与野生型动物相比,MMP-9基因敲除动物的梗死体积和脑水肿体积更小,HT发生率更低,功能障碍更少[15]。这些发现促使研究者将MMP-9抑制剂应用于急性缺血性脑卒中的治疗。其中研究得较多的是广谱的MMP抑制剂GM6001(外源性抑制剂)与组织金属蛋白酶抑制剂(tissue inhibitor of matrix metalloproteinases, TIMPs)。
在卒中后3 h,激活的MMP-9就开始升高,卒中后18 h达到高峰,早在脑缺血后6 h即出现的BBB破坏和24 h后出现的脑水肿。在用广谱的MMP抑制剂GM6001来抑制MMP改善BBB通透性和脑水肿时[16],发现MMP抑制剂治疗可降低MMP-9的激活,并减弱紧密连接蛋白的破坏,包括闭合蛋白和闭合小环蛋白,从而导致血管渗漏减少和BBB完整性的保存[17]。此外,GM6001抑制MMP后,可改善脑卒中后6 h的BBB破坏和24 h的脑水肿[16]。
组织金属蛋白酶抑制剂TIMPs是正常条件下组织中存在的,用于调节MMP活性的内源性抑制剂。TIMPs的内源性组织抑制剂可以通过与MMP催化结构域的高亲和力非共价结合,抑制MMPs的活性。TIMP-1对MMP-9具有特异性亲和力[18],为MMP-9的内源性抑制剂。有研究表明,类似于卒中后MMP-9水平升高,TIMP-1的表达也在卒中后失调[19],因此MMP-9/TIMP-1比值可作为卒中的标志物。实际上,大鼠缺血性脑卒中后MMP-9/TIMP-1比值与脑水肿的相关性甚至比单纯MMP-9与脑水肿的相关性更强[20]。Fujimoto等[21]研究发现经TIMP-1基因敲除的小鼠表现出显著的伊文思蓝外渗升高,表明严重的BBB破裂、血管性水肿以及增大的梗死面积,与MMP-9的表达与活性增加有关。
3 抑制MMP-9减少rt-PA溶栓过程中出血性转化的治疗策略 3.1 rt-PA可激活MMP-9rt-PA可以直接激活MMP-9,并且rt-PA治疗可以增加缺血性卒中患者血清的MMP-9活性,rt-PA介导的MMP-9活化可进一步强化MMP-9对卒中的应答和其在损伤途径中的参与度[22]。作为氧化应激的标志物进行监测的MMP-9水平与自由基水平相关,与未经治疗的对照组比较,rt-PA溶栓治疗组在急性缺血性卒中后第1天静脉血的MMP-9水平增加[23]。与非出血性和非缺血性组织相比,在HT区域中观察到更高水平的活动性MMP-9。在HT升高的患者中,MMP-9水平较高,甚至在有症状和无症状的HT之间观察到MMP-9水平的差异。因此,MMP-9的早期抑制可减少出血并发症。MMP抑制剂可通过抑制rt-PA与脑实质的结合来维持卒中后BBB的完整性,从而减少出血并发症。通过检测血清MMP-9基础水平可预测rt-PA溶栓疗法导致脑实质出血的可能性[24]。
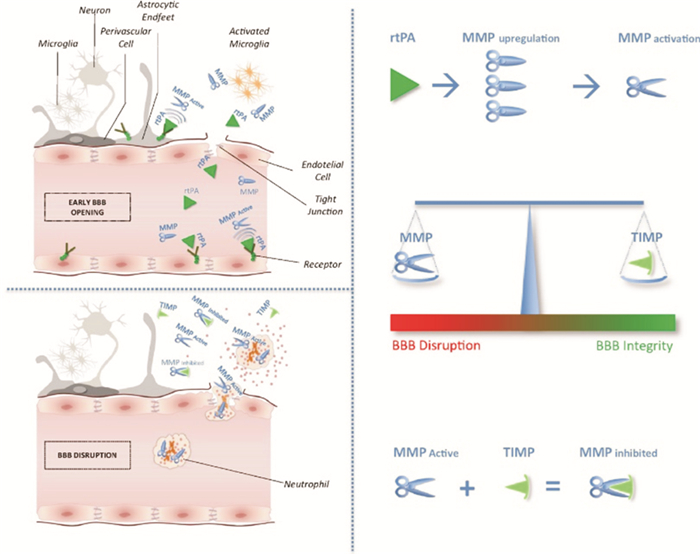
3.2 rt-PA对MMP/TIMP在神经血管单元中失衡的影响急性缺血性脑卒中后,rt-PA可通过血脑屏障(BBB)进入脑实质,从而促进金属蛋白酶(MMPs)的产生和激活,从而损伤神经血管单位成分。MMPs与其天然抑制剂(金属蛋白酶组织抑制剂,TIMPs)之间的不平衡可能会加剧BBB破坏,导致缺血性脑损伤的出血转化和水肿(图 2)。
|
| 图 2 组织纤溶酶原激活物对基质金属蛋白酶/TIMP在神经血管单位水平失衡的影响 注:此图出版文献Piccardi B, Palumbo V, Nesi M, et al. Unbalanced Metalloproteinase-9 and Tissue Inhibitors of Metalloproteinases Ratios Predict Hemorrhagic Transformation of Lesion in Ischemic Stroke Patients Treated with Thrombolysis: Results from the MAGIC Study[J]. Front Neurol, 2015, 6(3): 382-393. |
溶栓治疗时机是影响疗效的关键因素。目前溶栓时间段有3 h、4.5 h和6 h三种[25]。由于狭窄的时间窗,只有百分之几的患者符合要求,严重影响溶栓治疗的实用化。为扩展脑卒中患者溶栓时间窗及保护神经元免受缺血性损伤,国内外学者积极探索如何延长溶栓时间窗以及提高溶栓剂安全性与疗效。
1995年,美国国立神经疾病脑卒中研究率先报道,应用阿替普酶对超早期3 h内的脑卒中患者行溶栓治疗能明显改善临床症状[26]。欧洲协作性急性卒中研究(ECASS试验)将卒中的rt-PA静脉溶栓时间窗从3 h延迟至4.5 h,获得学术界认可[27]。2010年Lees等[28]进行的一项Meta分析结果显示,时间窗3~4.5 h内使用rt-PA治疗是有效的,且接受治疗的时间越早越好,此结果获得加拿大阿替普酶研究机构证实。
rt-PA的时间窗用了15年扩大了1.5 h,之后研究者又积极寻找新药用于减少溶栓后的出血转化,以将溶栓时间窗扩大到6 h,从而MMP-9成为关注的焦点。
溶栓后出血并发症的发生与溶栓后MMP-9表达上调密切相关。在溶栓同时联合使用MMP-9抑制剂治疗缺血性脑卒中的动物研究中,rt-PA溶栓时诱导的自发性出血风险被减少,溶栓治疗的时间窗相对延长[29]。近十年来,大量以MMP-9为靶点的研究在实验室中展开。其中米诺环素(广谱抗生素的四环素衍生物)因其在缺血性中风中具有神经保护功能而被研究得最多。大量体外和体内研究证据表明,由米诺环素介导的神经保护是通过抑制MMP-9实现的[30]。在rt-PA溶栓时治疗缺血再灌注大鼠的研究结果是脑内梗死面积比单用溶栓剂减少了约25%,且使溶栓剂rt-PA治疗时间延长至发病6 h[31]。临床已有小样本量的报道它扩大溶栓时间窗的可能性,需要更大规模的安全性与有效性临床研究[32]。
西洛他唑是一种抗血小板药物,其通过选择性抑制磷酸二酯酶Ⅲ来提高cAMP和cGMP的水平,从而达到舒张血压和降低rt-PA诱导的MMP-9活性升高的效果,并通过影响环磷酸腺苷(cAMP)活性可保护血管内皮细胞和周细胞免受rt-PA诱导的损伤[33]。随着对西洛他唑与rt-PA相互作用机制的深入了解,提示了西洛他唑在溶栓过程中对脑缺血后血脑屏障具有潜在保护作用。Rho激酶抑制剂(ROCK)法舒地尔在改善涉及MMP-9的rt-PA诱导HT方面表现出相似的潜力[34]。有研究以神经保护剂盐酸法舒地尔的脂质体为溶栓时协同用药,治疗缺血性脑卒中模型大鼠研究光化学诱导血栓形成模型。结果显示,在溶栓之前静脉注射法舒地尔脂质物可以明显抑制由rt-PA诱导的MMP-9的活性从而减少脑出血转化的几率。单纯使用rt-PA溶栓大鼠的最佳治疗时间窗为2 h,但在与法舒地尔联合使用后,这个时间窗被扩大到了4.5 h[35]。
草苔虫素是一种从海洋生物草苔虫中分离得到的一类大环内酯类化合物,之前的研究显示,作为一种蛋白激酶(PKC)调节剂,它可以减少脑梗死后的脑部损伤,保护血脑屏障而发挥神经保护作用[36]。在延长rt-PA溶栓时间窗的MCAO大鼠模型研究中,它通过下调MMP-9和调节PKCε的表达而抑制了血脑屏障破坏和出血转化从而将溶栓介入时间增加到了6 h。提高了溶栓治疗的安全性和疗效[37]。
4 小结与展望MMP-9表达水平的显著增加与神经元损伤、细胞凋亡、血脑屏障开放后脑水肿出血性转化以及再灌注损伤有关。通过探究MMP-9结构及其在基因水平和蛋白质水平上的规律,可以进一步研发MMP特殊抑制剂以阻断信号通路,直接抑制其活性或降低MMP-9组合物的表达,提高内源性TIMP水平,研发具有调控MMP/TIMP平衡的药物;将能调节MMP活性的TIMPs与rt-PA联合很可能会成为一种潜在的缺血性脑卒中治疗策略。
MMP-9是缺血性卒中关键的治疗靶点之一,值得更深入的研究以制订更高效的控制策略与临床治疗方法。虽然上述干预措施明确减少了迟发性rt-PA所致脑卒中模型的出血性转化,但这些药物的长期疗效尚未确定,因此需要进一步优化,以加快其临床应用。
| [1] |
GBD 2016 Causes of Death Collaborators. Global, regional, and national age-sex specific mortality for 264 causes of death, 1980-2016:a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet, 2017, 390(10100): 1151-1210. DOI:10.1016/S0140-6736(17)32152-9 |
| [2] |
GBD 2016 DALYs and HALE Collaborators. Global, regional, and national disability-adjusted life-years (DALYs) for 333 diseases and injuries and healthy life expectancy (HALE) for 195 countries and territories, 1990-2016:a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet, 2017, 390(10100): 1260-1344. DOI:10.1016/S0140-6736(17)32130-X |
| [3] |
中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组. 中国急性缺血性脑卒中诊治指南2010[J]. 中华神经科杂志, 2010, 43(2): 146-153. DOI:10.3760/cma.j.issn.1006-7876.2010.02.022 |
| [4] |
Wardlaw JM, Murray V, Berge E, et al. Thrombolysis for acute ischaemic stroke[J]. Cochrane Database Syst Rev, 2014, 7: CD000213. |
| [5] |
Bluhmki E, Chamorro A, Dávalos A, et al. Stroke treatment with alteplase given 3.0-4.5 h after onset of acute ischeamic stroke (ECASS Ⅲ):additional outcomes and subgroup analysis of a randomised controlled trial[J]. Lancet Neurol, 2009, 8(12): 1095-1102. DOI:10.1016/S1474-4422(09)70264-9 |
| [6] |
Wechsler LR, Jovin TG. Intravenous recombinant tissue-type plasminogen activator in the extended time window and the US Food and Drug Administration:confused about the time[J]. Stroke, 2012, 43(9): 2517-2519. DOI:10.1161/STROKEAHA.112.670554 |
| [7] |
顾悦华, 尤晓欣, 裴建. 基质金属蛋白酶:一个缺血性脑卒中急性期的治疗靶点[J]. 国际神经病学神经外科学杂志, 2013, 40(3): 266-270. |
| [8] |
Inzitari D1, Giusti B, Nencini P, et al. MMP9 Variation After Thrombolysis Is Associated With Hemorrhagic Transformation of Lesion and Death[J]. Stroke, 2013, 44(10): 2901-2903. DOI:10.1161/STROKEAHA.113.002274 |
| [9] |
Piccardi B, Palumbo V, Nesi M, et al. Unbalanced Metalloproteinase-9 and Tissue Inhibitors of Metalloproteinases Ratios Predict Hemorrhagic Transformation of Lesion in Ischemic Stroke Patients Treated with Thrombolysis:Results from the MAGIC Study[J]. Front Neurol, 2015, 6(3): 382-393. |
| [10] |
del Zoppo GJ. The neurovascular unit, matrix proteases, and in-nate inflammation[J]. Ann N Y AcadSci, 2010, 1207(1): 46-49. DOI:10.1111/nyas.2010.1207.issue-1 |
| [11] |
Asahi M, Sumii T, Fini ME, et al. Matrix metalloproteinase 2 gene knockout has no effect on acute brain injury after focal ischemia[J]. Neuroreport, 2001, 12(13): 3003-3007. DOI:10.1097/00001756-200109170-00050 |
| [12] |
Renée J, Turner, Frank R, et al. Implications of MMP9 for Blood Brain Barrier Disruption and Hemorrhagic Transformation Following Ischemic Stroke[J]. Front Cell Neurosci, 2016, 10(305): 56. |
| [13] |
Abdelnaseer MM, Elfauomy NM, Esmail EH, et al. Matrix-Metalloproteinase-9 and Recovery of Acute Ischemic Stroke[J]. J Stroke Cerebrovasc Dis, 2017, 26(4): 733-740. DOI:10.1016/j.jstrokecerebrovasdis.2016.09.043 |
| [14] |
Gasche Y, Soccal PM, Kanemitsu M, et al. Matrix metalloproteinases and diseases of the central nervous system with a special emphasis on ischemic brain[J]. Front Biosci, 2006, 11(2): 1289-1301. |
| [15] |
Wang CX, Ding X, Noor R, et al. Rosiglitazone alone or in combination with tissue plasminogen activator improves ischemic brain injury in an embolic model in rats[J]. J Cereb Blood Flow Metab, 2009, 29(10): 1683-1694. DOI:10.1038/jcbfm.2009.87 |
| [16] |
Shigemori Y, Katayama Y, Mori T, et al. Matrix metalloproteinase-9 is associated with blood-brain barrier opening and brain edema formation after cortical contusion in rats[J]. Acta Neurochir Suppl, 2006, 96(10): 130-133. |
| [17] |
Bauer AT, Bürgers HF, Rabie T, et al. Matrix metalloproteinase-9 mediates hypoxia-induced vascular leakage in the brain via tight junction rearrangement[J]. J Cereb Blood Flow Metab, 2010, 30(4): 837-848. DOI:10.1038/jcbfm.2009.248 |
| [18] |
Clark IM, Swingler TE, Sampieri CL, et al. The regulation of matrix metalloproteinases and their inhibitors[J]. Int J Biochem Cell Biol, 2008, 40(6-7): 1362-1378. DOI:10.1016/j.biocel.2007.12.006 |
| [19] |
Rivera S, Ogier C, Jourquin J, et al. Gelatinase, B. and TIMP-1 are regulated in a cell-and time-dependent manner in association with neuronal death and glial reactivity after global forebrain ischemia[J]. Eur J Neurosci, 2002, 15(1): 19-32. DOI:10.1046/j.0953-816x.2001.01838.x |
| [20] |
Li DD, Song JN, Huang H, et al. The roles of MMP-9/TIMP-1 in cerebral edema following experimental acute cerebral infarction in rats[J]. Neurosci Lett, 2013, 550(5): 168-172. |
| [21] |
Fujimoto M, Takagi Y, Aoki T, et al. Tissue inhibitor of metalloproteinases protect blood-brain barrier disruption in focal cerebral ischemia[J]. J Cereb Blood Flow Metab, 2008, 28(10): 1674-1685. DOI:10.1038/jcbfm.2008.59 |
| [22] |
Golab P, Boguszewska-Czubara A, Kielbus M, et al. The rtPA increases MMP-9 activity in serum during ischaemic stroke[J]. Neurol Neurochir Pol, 2014, 48(5): 309-314. |
| [23] |
Carbone F, Vuilleumier N, Bertolotto M, et al. Treatment with recombinant tissue plasminogen activator (r-TPA) induces neutrophil degranulation in vitro via de? ned pathways[J]. Vascul Pharmacol, 2015, 64: 16-27. DOI:10.1016/j.vph.2014.11.007 |
| [24] |
朱卫香, 刘彦敏, 韩亚军, 等. 缺血性脑卒中患者血清MMP-9、Hs-CRP与脑梗死体积及神经功能缺损的关系[J]. 中国免疫学杂志, 2012, 28(04): 341-343. DOI:10.3969/j.issn.1000-484X.2012.04.012 |
| [25] |
Sobolewski P, Kozera G, Kazmierski R, et al. Efficacy of cerebral thrombolysis in an extended 'time window'[J]. J Clin pharm Ther, 2015, 40(4): 472-476. DOI:10.1111/jcpt.2015.40.issue-4 |
| [26] |
Tissue plasminogen activator for acute ischemic stroke. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group[J]. N Engl J Med, 1995, 333(24): 1581-1587. DOI:10.1056/NEJM199512143332401 |
| [27] |
Hacke W, Kaste M, Bluhmki E, et al. Thrombolysis with aheplase 3 to 4.5 hours after acute ischemic stroke[J]. N Engl J Med, 2008, 359(13): 1317-1329. DOI:10.1056/NEJMoa0804656 |
| [28] |
Lees KR, Bluhmki E, von Kummer R, et al. Time to treatment with intravenous alteplase and outcome in stroke:an updated pooled analysis of ECASS, ATLANTIS, NINDS, and EPITHET trials[J]. Lancet, 2010, 375(9727): 1695-1703. DOI:10.1016/S0140-6736(10)60491-6 |
| [29] |
Mishiro K, Ishiguro M, Suzuki Y, et al. A broad-spectrum matrix metalloproteinase inhibitor prevents hemorrhagic complications induced by tissue plasminogen activator in mice[J]. Neuroscience, 2012, 205: 39-48. DOI:10.1016/j.neuroscience.2011.12.042 |
| [30] |
Fagan SC, Cronic LE, Hess DC. Minocycline development for acute ischemic stroke[J]. Transl Stroke Res, 2011, 2(2): 202-208. DOI:10.1007/s12975-011-0072-6 |
| [31] |
Machado LS, Sazonova IY, Kozak A, et al. Minocycline and tissue-type plasminogen activator for stroke assessment of interaction potential[J]. Stroke, 2009, 40(9): 3028-3033. DOI:10.1161/STROKEAHA.109.556852 |
| [32] |
Malhotra K, Chang JJ, Khunger A, et al. Minocycline for acute stroke treatment:a systematic review and meta-analysis of randomized clinical trials[J]. J Neurol, 2018. |
| [33] |
Ishiguro M, Mishiro K, Fujiwara Y, et al. Phosphodiesterase-Ⅲ inhibitor prevents hemorrhagic transformation induced by focal cerebral ischemia in mice treated with tPA[J]. PLoS One, 2010, 5(12): 51-78. |
| [34] |
Ishiguro M, Kawasaki K, Suzuki Y, et al. A rho kinase (ROCK) inhibitor, fasudil, prevents matrix metalloproteinase-9-related hemorrhagic transformation in mice treated with tissue plasminogen activator[J]. Neuroscience, 2012, 220(38): 302-312. |
| [35] |
Fukuta T, Asai T, Yanagida Y, et al. Combination therapy with liposomal neuroprotectants and tissue plasminogen activator for treatment of ischemic stroke[J]. FASEB J, 2017, 31(5): 1879-1890. DOI:10.1096/fj.201601209R |
| [36] |
Tan Z, Turner RC, Leon RL, et al. Bryostatin improves survival and reduces ischemic brain injury in aged rats after acute ischemic stroke[J]. Stroke, 2013, 44(12): 3490-3497. DOI:10.1161/STROKEAHA.113.002411 |
| [37] |
Lucke-Wold BP, Logsdon AF, Smith KE, et al. Bryostatin-1 Restores Blood Brain Barrier Integrity following Blast-Induced Traumatic Brain Injury[J]. Mol Neurobiol, 2015, 52(3): 1119-1134. DOI:10.1007/s12035-014-8902-7 |
 2018, Vol. 45
2018, Vol. 45