扩展功能
文章信息
- 樊丽超, 周立春, 安春华
- FAN Li-Chao, ZHOU Li-Chun, AN Chun-Hua
- 银杏总黄酮对脂多糖诱导的小胶质细胞炎症反应的抑制作用
- Inhibitory effect of total ginkgo flavonoids on lipopolysaccharide-induced inflammatory response in microglial cells
- 国际神经病学神经外科学杂志, 2018, 45(5): 477-480
- Journal of International Neurology and Neurosurgery, 2018, 45(5): 477-480
-
文章历史
收稿日期: 2018-03-02
修回日期: 2018-08-22
近年来大量研究表明,神经系统退行性疾病的发生发展与脑内的慢性炎症反应密切相关,强烈的局灶性炎症反应在许多神经系统退行性疾病患者脑内都有发生,从而对神经元造成伤害,诱发或加重神经系统退行性病变[1]。在中枢神经系统中,小胶质细胞(microglia, MG)是神经系统中主要的免疫细胞,广泛分布于大脑和脊髓中,约占胶质细胞总数的10%~20%[2]。当发生神经病变时,小胶质细胞聚集在变性神经元周围成为脑中巨噬细胞,当其受到不同因素刺激时会大量增殖,释放大量活性氧自由基和致炎细胞因子,从而促进了中枢神经系统炎症反应的发生发展。近几年来有研究证明,银杏叶总黄酮(total flavones of ginkgo, TFG)能明显抑制脂多糖(lipopolysaccharide, LPS)所诱导的小胶质细胞增殖及炎性因子释放,但其机制尚未见详细报道。因此本研究就其抑制LPS所诱导的小胶质细胞炎症反应的机制进行探讨。
1 材料与方法 1.1 主要试剂与仪器 1.1.1 主要试剂小胶质细胞系(BV-2)由第三军医大学脑科学研究中心提供;银杏总黄酮(上海杏灵科技药业有限公司);胎牛血清、DMEM/F12培养基、LPS、L-多聚赖氨酸、二甲基亚砜(DMSO)、青霉素及链霉素混合液和0.25%胰蛋白酶液(北京鼎国昌盛生物技术有限公司);CCK-8试剂盒(上海仁捷生物科技有限公司);四甲基偶氮唑蓝(MTT)及PBS磷酸盐缓冲液(Sigma公司,美国);小胶质细胞OX-42抗体(Santa)、小鼠IL-1β及IL-1和TNF-α ELISA试剂盒(上海依科赛生物制品有限公司);蛋白抗体(Cell Singaling Technology,美国);PE标记的TLR4抗体(Bioss)、SYBR Premix Ex TaqTM、兔抗小鼠TLR4、抑制性卡巴蛋白(IκB-α)、核因子κB (NF-κB)/p65(CST)、HRP标记羊抗兔二抗(Santa Cruz)、TRIzol RNA提取试剂盒和反转录试剂盒(TaKaRa公司)。
1.1.2 主要仪器荧光显微镜(X81,OIympus公司,日本);CO2培养箱(ThermoForma);多功能酶标仪、PCR仪和Western blot设备(Bio-Rad,美国);FACS Calibar流式细胞仪(Becton-Dickins)。
1.2 细胞培养BV-2小胶质细胞采用10%胎牛血清DMEM/F12培养基培养,置于恒温培养箱,进行常规培养和传代。
1.3 CCK-8检测细胞活性检测及形态变化观察根据细胞贴壁情况定时更换培养基培养液,设空白对照组、DMSO(浓度 < 0.1%)组、TFG(40、80、120和160 mg/mL)组。每组3个复孔,干预24 h。加入CCK-8试剂0.01 ml, 置于培养箱孵育2~4 h后,使用多功能酶标仪读取光密度值[D(450)]。此外再设空白对照组、1 μg/mL LPS处理组以及在LPS刺激前30 min给予80 mg/mL TFG处理组,各组经过相应处理后用倒置相差显微镜察细胞形态变化。
1.4 细胞炎症因子及TLR4、IκBα、NF-κB/p65蛋白表达检测酶联免疫吸附法(ELISA)检测白细胞介素-1β(Interleukin-1β, IL-1β)、白细胞介素6(Interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)水平,PT-PCR检测炎性因子分泌情况,Western blot检测Toll样受体4(TLR4)、抑制性卡巴蛋白(IκB-α)、核因子κB(NF-κB)/p65蛋白表达。
1.5 统计学方法采用SPSS 19.0对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
2 结果 2.1 CCK-8检测BV-2细胞活性情况DMSO组与40和80 mg/mL TFG对小胶质细胞活性与空白对照组相比,无显著影响(P>0.05);120和160 mg/mL TFG对BV-2细胞活性具有明显抑制作用(P < 0.01),如表 1A所示。经过TFG提前干预细胞,LPS组与TFG组对细胞活性与空白对照组相比均无显著影响(P>0.05),如表 1B所示。
| 组别 | D(450)值 |
| 空白对照组 | 1.43±0.12 |
| DMSO组 | 1.46±0.11 |
| TFG组(40 mg/mL) | 1.45±0.11 |
| TFG组(80 mg/mL) | 1.38±0.09 |
| TFG组(120 mg/mL) | 0.92±0.06* |
| TFG组(160 mg/mL) | 0.75±0.05* |
| 注:*为与空白对照组比较,P < 0.01 | |
空白对照组细胞在倒置相差显微镜下呈静息状态,胞体细长,胞体两侧伸出细长突起的分枝,如图 1A所示;TFG组细胞大多数胞体变大变圆,聚集成团,表面突起粗、变短,如图 1B所示;TFG(80 mg/mL)预处理后的细胞有一定改善,如图 1C所示。
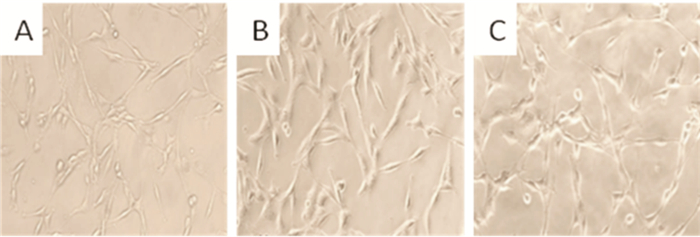
|
| 图 1 倒置相差显微镜下观察各组BV-2小胶质细胞形态变化 注:A:空白对照组;B:LPS组;C:TFG+LPS组 |
BV-2细胞经LPS处理后与空白对照组相比IL-1β、IL-6和TNF-α表达水平显著升高(P < 0.01);TFG(80 mg/mL)预处理后与LPS组相比IL-1β、IL-6和TNF-α表达水平显著降低(P < 0.01)。如表 2所示。
| (x±s) | |||
| 组别 | IL-1β(pg/mL) | IL-6(pg/mL) | TNF-α(pg/mL) |
| 空白对照组 | 95.62±1.94 | 101.24±4.56 | 102.51±3.62 |
| LPS组 | 964.31±30.56* | 784.54±16.33* | 913.66±12.24* |
| TFG+LPS组 | 624.94±16.31# | 510.28±7.46# | 613.84±5.52# |
| 注:*为与空白对照组比较,P < 0.01;#为与LPS组比较,P < 0.01 | |||
LPS组细胞各炎症因子水平与空白对照组相比,均明显升高(P < 0.01)。而TFG预处理后细胞IL-1β、IL-6和TNF-α水平较LPS组明显下降(P < 0.01)。如表 3所示。
| 组别 | IL-1β(pg/mL) | IL-6(pg/mL) | TNF-α(pg/mL) |
| 空白对照组 | 50.32±2.85 | 52.86±3.21 | 203.27±7.58 |
| LPS组 | 603.41±12.37* | 564.83±7.62* | 1080.82±14.68* |
| TFG+LPS组 | 386.24±4.33# | 392.56±4.82# | 731.21±8.32# |
| 注:*为与空白对照组相比,P < 0.01;#为与LPS组相比,P < 0.01 | |||
LPS组TLR4蛋白、细胞核内NF-κB/p65与空白对照组相比明显上调(P < 0.01);TFG+LPS组与LPS组相比TLR4蛋白、细胞核内NF-κB/p65水平明显下降(P < 0.01)。LPS组细胞质内IκBα、NF-κB/p65较空白对照组明显减少(P < 0.01),而TFG+LPS组胞质内IκBα、NF-κB/p65较LPS组表达明显增多(P < 0.01),如表 4所示。
| 组别 | TLR4 | IκBα | 细胞质内NF-κB/p65 | 细胞核内NF-κB/p65 |
| 空白对照组 | 1.02±0.04 | 0.92±0.06 | 1.02±0.05 | 1.00±0.02 |
| LPS组 | 2.46±0.08* | 0.36±0.02* | 0.54±0.07* | 1.64±0.06* |
| TFG+LPS组 | 1.54±0.05# | 0.68±0.03# | 1.32±0.02# | 1.38±0.04# |
| 注:*为与空白对照组比较,P < 0.01;#为与LPS组比较,P < 0.01 | ||||
有研究表明小胶质细胞作为脑内的免疫细胞,在参与吞噬及抗原呈递等过程中发挥重要作用,而过度激活小胶质细胞会促使神经系统退行性疾病发生和发展[3]。LPS是革兰阴性菌细胞的细胞壁成分,当其对机体产生刺激时,会促使内源性细胞因子及补体蛋白产生[4]。Yang等[5]实验研究发现,通过减少TNF-α表达,尿皮素能降低炎症对多巴胺神经元伤害。Lorentecebrián等[6]研究表明尼麦角林能显著抑制内毒素诱导的小胶质细胞中TNF-α和IL-1β等炎性因子表达,从而对神经中枢产生保护作用。由此可见,神经系统毒性损伤的重要机制是在LPS刺激下激活小胶质细胞并促进其增殖,上调多种炎症因子。因此,干预LPS诱导的小胶质细胞激活及阻止其释放大量细胞毒性代谢产物对预防以神经炎症为主要病变的神经系统退行性疾病具有重要意义。
TFG是一种天然中药提取物,具有抗炎、扩张血管、镇痛、抗衰老和调节内分泌等功能。相关研究证明,神经退行性变化的基础是小胶质细胞增生,并证明TFG能抑制LPS诱导的神经炎性细胞毒作用[7, 8]。结合本实验研究结果,在LPS刺激下,静息状态下BV-2小胶质细胞形态迅速发生变化,胞突回缩,胞体增大,而提前给予TFG预处理后可抑制BV-2活性以及胞体形态改变。因此,TFG可能抑制LPS诱导的BV-2小胶质细胞活化。此外,在LPS刺激下,小胶质细胞释放的IL-1β、IL-6和TNF-α大量增加,但经TFG预处理后,其IL-1β、IL-6和TNF-α表达较LPS组显著下降。其机制可能是TFG能提高机体氧化能力,从而减少小胶质细胞代谢释放的炎性因子,降低LPS诱导的神经炎性细胞毒作用,这与唐嘉航等[9]实验研究结果一致。TLR4在介导LPS炎症信号向胞内传导中起主要作用,亦在神经炎症发生发展过程中发挥重要作用;而NF-κB是在TLR4与相应配体结合下所激活,从而诱发多种炎性因子基因表达,其中IκB-α作为NF-κB的抑制蛋白,在调节NF-κB亚细胞定位中具有重要作用[10, 11]。进一步检测LPS激活的BV-2小胶质细胞TLR4、IκB-α和NF-κB/p65蛋白表达,发现LPS组TLR4水平较空白对照组显著升高,经TFG预处理后,TLR4水平较LPS组显著下降,而IκB-α显著升高,且胞质内NF-κB/p65蛋白表达明显增加,胞核内NF-κB/p65蛋白表达明显减少。其机制可能是LPS使胶质细胞受到刺激后,激活IκB-α泛素化以及磷酸化后降解,从而使游离的NF-κB活化并转位入核并与κB结合,促进炎性细胞因子转录,发挥其病理生理作用[12-14];而TFG可能通过抑制TLR4水平阻止NF-κB/p65向核内转位和增加胞质内NF-κB/p65表达,从而减少炎性因子表达,发挥其抗炎作用。
综上,TFG抑制LPS诱导的小胶质细胞炎症反应效果良好,在治疗老年患者神经系统退行性疾病中具有广阔前景,为临床应用此方法治疗神经系统退行性疾病提供参考价值。
| [1] |
王回, 石晶, 卞合涛, 等. C/EBP β在神经退行性疾病炎症反应机制中的作用[J]. 中华行为医学与脑科学杂志, 2016, 25(2): 188-192. DOI:10.3760/cma.j.issn.1674-6554.2016.02.020 |
| [2] |
耿悦, 田雪松. 缺血性脑损伤状态下小胶质细胞的极化现象与影响因素[J]. 神经解剖学杂志, 2017, 33(4): 503-507. |
| [3] |
Cao SN, Bao XQ, Sun H, et al. Microglial Phagocytosis in the Neurodegenerative Diseases[J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao, 2016, 38(2): 228-233. |
| [4] |
Pang M, Yuan YY, Wang D, et al. Recombinant CC16 protein inhibits the production of pro-inflammatory cytokines via NF-κB and p38 MAPK pathways in LPS-activated RAW264.7 macrophages[J]. Acta Biochim Biophys Sin (Shanghai), 2017, 49(5): 435-443. DOI:10.1093/abbs/gmx020 |
| [5] |
Yang XY, Zhao EY, Zhuang WX, et al. LPA signaling is required for dopaminergic neuron development and is reduced through low expression of the LPA1 receptor in a 6-OHDA lesion model of Parkinson's disease[J]. Neurol Sci, 2015, 36(11): 2027-2033. DOI:10.1007/s10072-015-2295-x |
| [6] |
Lorentecebrián S, Decaunes P, Dungner E, et al. Allograft inflammatory factor 1(AIF-1) is a new human adipokine involved in adipose inflammation in obese women[J]. Bmc Endocr Disord, 2013, 13(1): 54. DOI:10.1186/1472-6823-13-54 |
| [7] |
Wang XX, Wang CM, Wang JM, et al. Pseudoginsenoside-F11(PF11) exerts anti-neuroinflammatory effects on LPS-activated microglial cells by inhibiting TLR4-mediated TAK1/IKK/NF-κB, MAPKs and Akt signaling pathways[J]. Neuropharmacology, 2014, 79: 642-656. DOI:10.1016/j.neuropharm.2014.01.022 |
| [8] |
Sasmita AO, Ling A, Voon K, et al. Madecassoside activates anti? neuroinflammatory mechanisms by inhibiting lipopolysaccharide-induced microglial inflammation[J]. Int J Mol Med, 2018, 41(5): 3033-3040. |
| [9] |
唐嘉航, 叶希韵, 刘江, 等. 银杏叶总黄酮对胰岛素抵抗大鼠糖脂代谢和肝功能的影响[J]. 上海交通大学学报(医学版), 2009, 29(2): 150-153. DOI:10.3969/j.issn.1674-8115.2009.02.007 |
| [10] |
Rashidian A, Muhammadnejad A, Dehpour AR, et al. Atorvastatin attenuates TNBS-induced rat colitis:the involvement of the TLR4/NF-kB signaling pathway[J]. Inflammopharmacology, 2016, 24(2-3): 109-118. DOI:10.1007/s10787-016-0263-6 |
| [11] |
Marcomini I. L'attivazione di PXR, CAR e NF-κB èmodulata dalla colestasi:effetti sul metabolismo dei farmaci[J]. Value Health, 2015, 8(6): A18. |
| [12] |
覃万翔, 罗敏, 石英, 等. 双氢青蒿素抑制LPS诱导的小胶质细胞炎症反应[J]. 第三军医大学学报, 2017, 39(22): 2189-2194. |
| [13] |
隋正, 刘启龙, 孙国平, 等. Tubacin抑制脂多糖诱导活化的小胶质细胞炎症介质释放的实验研究[J]. 中华神经医学杂志, 2017, 16(4): 363-368. DOI:10.3760/cma.j.issn.1671-8925.2017.04.008 |
| [14] |
徐蛟天, 陈孝祥, 王威, 等. Nurr1对小胶质细胞联合神经干细胞共培养促进神经干细胞向多巴胺神经元分化作用研究[J]. 国际神经病学神经外科学杂志, 2018, 45(1): 52-57. |
 2018, Vol. 45
2018, Vol. 45




